11-12高二上·福建泉州·期末
解题方法
1 . 回答下列问题:
(1)燃料电池作为绿色能源得到迅速发展,二甲醚(CH3OCH3)质子交换膜燃料电池的电池反应为:CH3OCH3+3O2→2CO2+3H2O,制取二甲醚的反应如下:
CO(g)+H2O(g)⇌CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO(g)+2H2(g)⇌CH3OH(g) △H=-90.7kJ·mol-1
2CH3OH(g)⇌CH3OCH3(g)+H2O(g) △H=-23.5kJ·mol-1
①写出由CO和H2制取二甲醚和CO2的热化学方程式:______ 。
②二甲醚质子交换膜燃料电池是以酸性溶液为电解质溶液,二甲醚从一个电极通入,O2从另一电极通入,中间为质子交换膜,通入O2的一极为______ 极,电极反应式为______
(2)钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程的有关问题。
①工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:______
②生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式______
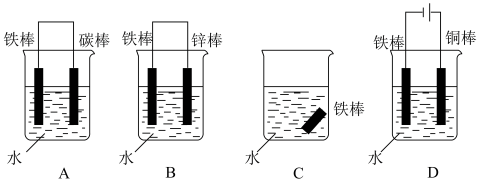
③下列哪个装置可防止铁棒被腐蚀______
④在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下,请回答:
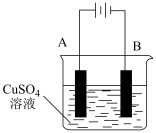
A电极对应的金属是______ (写元素名称),B电极的电极反应式是______
(1)燃料电池作为绿色能源得到迅速发展,二甲醚(CH3OCH3)质子交换膜燃料电池的电池反应为:CH3OCH3+3O2→2CO2+3H2O,制取二甲醚的反应如下:
CO(g)+H2O(g)⇌CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO(g)+2H2(g)⇌CH3OH(g) △H=-90.7kJ·mol-1
2CH3OH(g)⇌CH3OCH3(g)+H2O(g) △H=-23.5kJ·mol-1
①写出由CO和H2制取二甲醚和CO2的热化学方程式:
②二甲醚质子交换膜燃料电池是以酸性溶液为电解质溶液,二甲醚从一个电极通入,O2从另一电极通入,中间为质子交换膜,通入O2的一极为
(2)钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程的有关问题。
①工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
②生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式
③下列哪个装置可防止铁棒被腐蚀

④在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下,请回答:

A电极对应的金属是
您最近一年使用:0次
9-10高二下·福建龙岩·期末
解题方法
2 .
(1)在25℃、101KPa时,1g甲醇完全燃烧生成CO2和液态水时放热22.68kJ,则能表示甲醇燃烧的热化学方程式为:_______________________ 。
(2)已知:C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2(g); △H=-394kJ/mol;
2CO(g)+O2(g)=2CO2(g); △H=-566kJ/mol;
2H2(g)+O2(g)=2H2O(g); △H=-484 kJ/mol;
①在25℃、101kPa时,1 g甲醇不完全燃烧生成1∶1的CO、CO2和液态水,写出此甲醇燃烧的热化学方程式:___________________________________ 。
②工业上可由CO和H2合成甲醇。试写出由C(s)与水蒸气在高温条件下反应生成氢气和一氧化碳的热化学方程式_______________________ 。
(3)利用甲醇可设计燃料电池。
①如用氢氧化钾溶液做电解质溶液,用多孔石墨做电极,在电极上分别充入甲醇和氧气。写出负极的电极反应式___________________ 。
②下列有关甲醇燃料电池的说法中,错误的是_________ 。
A.甲醇燃料电池的负极发生氧化反应
B.甲醇燃料电池的电子由负极、经外电路流入正极
C.甲醇燃料电池在负极区产生CO
D.甲醇燃料电池中使用的氢氧化钾浓度保持不变
(1)在25℃、101KPa时,1g甲醇完全燃烧生成CO2和液态水时放热22.68kJ,则能表示甲醇燃烧的热化学方程式为:
(2)已知:C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2(g); △H=-394kJ/mol;
2CO(g)+O2(g)=2CO2(g); △H=-566kJ/mol;
2H2(g)+O2(g)=2H2O(g); △H=-484 kJ/mol;
①在25℃、101kPa时,1 g甲醇不完全燃烧生成1∶1的CO、CO2和液态水,写出此甲醇燃烧的热化学方程式:
②工业上可由CO和H2合成甲醇。试写出由C(s)与水蒸气在高温条件下反应生成氢气和一氧化碳的热化学方程式
(3)利用甲醇可设计燃料电池。
①如用氢氧化钾溶液做电解质溶液,用多孔石墨做电极,在电极上分别充入甲醇和氧气。写出负极的电极反应式
②下列有关甲醇燃料电池的说法中,错误的是
A.甲醇燃料电池的负极发生氧化反应
B.甲醇燃料电池的电子由负极、经外电路流入正极
C.甲醇燃料电池在负极区产生CO

D.甲醇燃料电池中使用的氢氧化钾浓度保持不变
您最近一年使用:0次
9-10高二下·福建福州·期末
3 . (1)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。
已知:N2(g) + 2O2(g)= 2NO2(g) △H =" +67.7" kJ/mol;
N2H4(g)+ O2(g)=N2(g)+2H2O(g) △H=-534 kJ/mol
则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为___________________ 。
(2)已知:常温下0.1mol/L的某酸H2A的pH=4,则该酸为_____ 酸(填“强”或“弱”), H2A的电离方程式为_______________________________________ ,该溶液中由水电离出的c(H+)=____________________ 。
(3)一定温度下,两种酸:a、盐酸 b、醋酸:
①当两种酸的物质的量浓度相同时,c(H+):a________ b(填“>”、“<”或“=”,下同)。
②在pH相同、体积相同的两种酸溶液中加入过量的铁粉,反应结束时生成H2的总体积: a______________ b。
③将pH相同,体积相同的两种酸溶液分别加水稀释100倍,所得溶液的pH值:a________ b
已知:N2(g) + 2O2(g)= 2NO2(g) △H =" +67.7" kJ/mol;
N2H4(g)+ O2(g)=N2(g)+2H2O(g) △H=-534 kJ/mol
则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为
(2)已知:常温下0.1mol/L的某酸H2A的pH=4,则该酸为
(3)一定温度下,两种酸:a、盐酸 b、醋酸:
①当两种酸的物质的量浓度相同时,c(H+):a
②在pH相同、体积相同的两种酸溶液中加入过量的铁粉,反应结束时生成H2的总体积: a
③将pH相同,体积相同的两种酸溶液分别加水稀释100倍,所得溶液的pH值:a
您最近一年使用:0次
4 . 已知 蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
则表中a为
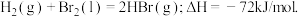 蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:| H2(g) | Br2(g) | HBr(g) | |
| 1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | a | 369 |
| A.404 | B.260 | C.230 | D.200 |
您最近一年使用:0次
2016-12-09更新
|
2035次组卷
|
55卷引用:2011-2012年福建省福州市罗源一中高二上学期第一次月考化学试卷
(已下线)2011-2012年福建省福州市罗源一中高二上学期第一次月考化学试卷(已下线)2011-2012学年福建省南安一中高二上学期期中考试化学试卷(已下线)2011-2012学年福建省南安一中高二上学期期中考试化学(理)试卷(已下线)2010年6月浙江省金温七校高二化学期末卷(已下线)2010年辽宁省沈阳四校联合体高二上学期期中考试化学卷(已下线)2010年山西省临汾一中高二上学期期中考试化学试题(已下线)2011-2012年广东省汕头市金山中学高二上学期期中考试化学试卷(理科)(已下线)2011-2012学年甘肃省兰州一中高二上学期期中考试化学(理)试卷(已下线)2011-2012学年山东省莘县实验高中高二上学期期中考试化学试卷(已下线)2014届新疆乌鲁木齐市兵团二中高二(上)期末化学试卷(已下线)2014届浙江省嘉兴一中高二下学期期中考试化学试卷 (已下线)2013-2014安徽省安庆一中、合肥六中第二学期期末联考高二化学试卷(已下线)2014-2015学年河南鄢陵县第一高中高二上第一次考试化学(A)试卷(已下线)2014-2015学年河南鄢陵县第一高中高二上第一次考试化学(B)试卷2014-2015学年浙江省衢州第二中学高二上学期期中化学试卷2015-2016学年山西太原五中高二上第一周考理科化学试卷2015-2016学年江西省南昌二中高二上第一次月考化学试卷2015-2016学年江西八一、洪都、麻丘中学等高二上期中联考化学试卷2015-2016学年山东省烟台市莱山一中高二化学上学期段考试卷2016-2017学年河北正定中学高二上开学考试化学卷2016-2017学年黑龙江省大庆一中高二上开学测化学卷2016-2017学年广东实验中学顺德学校高二上阶段质检化学试卷2016-2017学年辽宁省盘锦高中高二上期中化学卷河北省邢台市第八中学2018-2019学年高二上学期期中考试化学试题高二人教版选修4 第一章 第一节 化学反应与能量的变化山西省应县第一中学校2019-2020学年高二上学期期中考试化学试题鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第1节 化学反应的热效应山东省新泰一中东校2020-2021学年高二上学期第一次月考化学试题河北省石家庄市藁城区第一中学2020-2021学年高二上学期第一次月考化学试题江西省抚州市金溪县第一中学2020-2021学年高二上学期第一次月考化学试题青海省海南州贵德高级中学2020-2021学年高二下学期期中化学试题河南省郑州国庆中学2021-2022学年高二上学期期中考试化学试题浙江省湖州市长兴县等三县2017-2018学年高二上学期期中考试化学试题湖南省宁乡市四校联考2022-2023学年高二上学期10月月考化学试题黑龙江省哈尔滨市第三中学2022-2023学年高二上学期第二次验收化学试题黑龙江省牡丹江市第一高级中学2022-2023学年高二上学期期中考试化学试题山东省菏泽市曹县第一中学2022-2023学年高二上学期12月份阶段检测化学试题辽宁省恒仁满族自治县第二高级中学2021-2022学年高二上学期期中考试化学试题2010年普通高等学校招生全国统一考试理综化学部分(重庆卷)2010年高考化学试题分项专题七 化学反应中的能量变化2010年高考化学试题分项专题十四 化学计算(已下线)2010年黑龙江省双鸭山一中高三上学期期中考试(化学)(已下线)2012届河北省衡水中学高三第三次调研考试化学试卷(已下线)2011-2012学年浙江省金华一中高一下学期期中考试化学试卷(已下线)2012-2013学年浙江省杭州二中高一下学期期中考试化学理科试卷(已下线)2014年高一下学期化学必修2 2-1 化学能与热能练习卷(已下线)2015届四川省成都市高新区高三9月月考化学试卷2016届甘肃省兰州第一中学高三12月月考化学试卷2017届陕西省师范大学附属中学高三上学期第二次模考化学试卷安徽省黄山市2016-2017学年高一下学期期末考试化学试题【全国百强校】北京市第四中学2017-2018学年高一下学期期末考试化学(选考)试题2020届高三化学选修4二轮专题练——盖斯定律的应用【选择精编25题】广西壮族自治区田阳高中2019-2020学年高一5月月考化学试题高中化学苏教2019版必修第二册-专题6 第二单元 第1课时 放热反应与吸热反应重庆市望江中学校2021-2022学年高一下学期期中考试化学试题
9-10高二下·福建福州·期中
5 . (1)经测定,20g氢气在氧气中燃烧生成水蒸气,放热2418.0kJ,写出该反应的热化学方程式_____________________________________ ;
已知:3Fe (s)+2O2(g)="=" Fe3O4(s) △H=-1118.4kJ• mol—1,根据以上信息,则反应 3Fe(s)+4H2O(g)==Fe3O4(s)+4H2(g) 的△H=_______________________ ,该反应达平衡时,化学平衡常数表达式K=___________________________ 。
(2)某学生实验小组用50mL0.50mol•L—1的盐酸与50mL0.50mol•L—1的NaOH溶液在下图所示的装置中进行中和反应反应热的测定
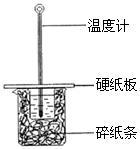
①图中装置缺少的一种仪器,该仪器名称为_____ 。
②将反应混合液的____ 温度记为反应的终止温度。
③下列说法正确的是_____________
A.小烧杯内残留有水,会使测得的反应热数值偏小
B.酸、碱混合时,应把量筒中的溶液缓缓倒入烧杯的溶液中,以防液体外溅
C.烧杯间填满碎纸条的作用是固定小烧杯
D.可用相同浓度和体积的醋酸代替稀盐酸溶液进行实验
已知:3Fe (s)+2O2(g)="=" Fe3O4(s) △H=-1118.4kJ• mol—1,根据以上信息,则反应 3Fe(s)+4H2O(g)==Fe3O4(s)+4H2(g) 的△H=
(2)某学生实验小组用50mL0.50mol•L—1的盐酸与50mL0.50mol•L—1的NaOH溶液在下图所示的装置中进行中和反应反应热的测定


①图中装置缺少的一种仪器,该仪器名称为
②将反应混合液的
③下列说法正确的是
A.小烧杯内残留有水,会使测得的反应热数值偏小
B.酸、碱混合时,应把量筒中的溶液缓缓倒入烧杯的溶液中,以防液体外溅
C.烧杯间填满碎纸条的作用是固定小烧杯
D.可用相同浓度和体积的醋酸代替稀盐酸溶液进行实验
您最近一年使用:0次
13-14高三·全国·课时练习
名校
解题方法
6 . 碳是形成化合物种类最多的元素,其单质及其部分化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
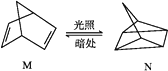
ΔH=+88.6 kJ·mol-1,则M、N相比,较稳定的是__________ 。
(2)CH3OH+O2(g) =CO2(g)+2H2O(g) ΔH=-akJ·mol-1,则a________ (填“>”“<”或“=”)238.6。(已知甲醇的燃烧热为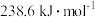 )
)
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:____________________________ 。
(4)将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s) ===2Al2O3(s)+3TiC(s) ΔH= -1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为_____________ 。
(1)有机物M经过太阳光光照可转化成N,转化过程如下:

ΔH=+88.6 kJ·mol-1,则M、N相比,较稳定的是
(2)CH3OH+O2(g) =CO2(g)+2H2O(g) ΔH=-akJ·mol-1,则a
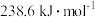 )
) (3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:
(4)将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s) ===2Al2O3(s)+3TiC(s) ΔH= -1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为
您最近一年使用:0次
2016-12-08更新
|
2134次组卷
|
14卷引用:【全国百强校】福建省三明市第一中学2018-2019学年高二上学期第一次月考化学试题
【全国百强校】福建省三明市第一中学2018-2019学年高二上学期第一次月考化学试题山西省实验中学2017-2018学年高二上学期10月月考化学试题重庆市九校联盟2017-2018学年高二上学期期中考试化学试题【全国百强校】广东仲元中学2017-2018学年高二下学期期中考试(理)化学试题2018-2019学年人教版高二化学选修四章:化学反应与能量末测试题2018-2019学年人教版高中化学选修四 章末综合测评1 化学反应与能量河南省鹤壁市淇县第一中学2018-2019学年高二(普通班)上学期第一次月考化学试题(已下线)《2018-2019学年同步单元双基双测AB卷》第一单元 化学反应与能量单元测试(A卷)高二人教版选修4 期末学业测评(二)(已下线)2014年高考化学一轮复习课后规范训练6-1练习卷(已下线)二轮复习 专题8 化学反应中与能量变化 押题专练河北省安平中学2017-2018学年高一下学期期末考试化学试题1四川省成都经济技术开发区实验中学校2019届高三上学期入学考试化学试题辽宁省普兰店市第一中学2019届高三上学期期中考试化学试题
名校
7 . 已知热化学方程式:
①CO(g)+1/2O2(g)=CO2(g)ΔH=-283.0kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1
则下列说法正确的是( )
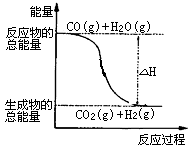
①CO(g)+1/2O2(g)=CO2(g)ΔH=-283.0kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1
则下列说法正确的是( )

| A.H2的燃烧热为241.8kJ·mol-1 |
| B.由反应①、②可知上图所示的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g)ΔH=-41.2 kJ·mol-1 |
| C.H2(g)转变成H2O(g)的化学反应一定要放出能量 |
| D.根据②推知反应H2(g)+1/2O2(g)=H2O(l)ΔH>-241.8 kJ·mol-1 |
您最近一年使用:0次
2016-12-05更新
|
262次组卷
|
6卷引用:福建省漳州市长泰县第一中学2019-2020学年高二10月月考化学试题
8 . 已知下列热化学方程式:
① Fe2O3(s) + 3CO(g) = 2Fe(s) + 3CO2(g) △H= -25kJ·mol-1
② 3Fe2O3(s) + CO(g) = 2Fe3O4(s) + CO2(g) △H= - 47kJ·mol-1
则下列关于Fe3O4(s)被CO还原成Fe(s)和CO2的热化学方程式的书写中正确的是
① Fe2O3(s) + 3CO(g) = 2Fe(s) + 3CO2(g) △H= -25kJ·mol-1
② 3Fe2O3(s) + CO(g) = 2Fe3O4(s) + CO2(g) △H= - 47kJ·mol-1
则下列关于Fe3O4(s)被CO还原成Fe(s)和CO2的热化学方程式的书写中正确的是
| A.Fe3O4 + 4CO = 3Fe + 4CO2△H= -14kJ·mol-1 |
| B.Fe3O4(s) + 4CO(g) = 3Fe(s) + 4CO2(g)△H= -22kJ·mol-1 |
| C.Fe3O4(s) + 4CO(g) = 3Fe(s) + 4CO2(g)△H= +14kJ·mol-1 |
| D.Fe3O4(s) + 4CO(g) = 3Fe(s) + 4CO2(g)△H= -14kJ·mol-1 |
您最近一年使用:0次
2016-05-23更新
|
172次组卷
|
6卷引用:2015-2016学年福建省大田一中高二上学期期中考试化学试卷
11-12高二上·福建·期中
9 . (1)已知①C2H5OH(g)+3O2(g)==2CO2(g)+3H2O(g) △H1=akJ·mol-1;
②H2O(g)==H2O(1) △H2=bkJ·mol-1;
③C2H5OH(g)==C2H5OH(1) △H3=ckJ·mol-1,
写出 C2H5OH(1)完全燃烧生成CO2(g)和H2O(1)的热化学方程式__________________
(2)已知下列热化学方程式:
① H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ/mol
② C(s)+1/2O2(g)=CO(g) ΔH=-110.5 kJ/moL
则水煤气能源的制取原理:C(s)+H2O(g)=H2(g)+CO (g) ΔH=______ kJ/moL
②H2O(g)==H2O(1) △H2=bkJ·mol-1;
③C2H5OH(g)==C2H5OH(1) △H3=ckJ·mol-1,
写出 C2H5OH(1)完全燃烧生成CO2(g)和H2O(1)的热化学方程式
(2)已知下列热化学方程式:
① H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ/mol
② C(s)+1/2O2(g)=CO(g) ΔH=-110.5 kJ/moL
则水煤气能源的制取原理:C(s)+H2O(g)=H2(g)+CO (g) ΔH=
您最近一年使用:0次
11-12高二上·福建福州·阶段练习
10 . 同素异形体相互转化的反应热相当少而且转化速率较慢,有时还很不完全,测定反应热很困难,现在可根据盖斯定律进行计算。
已知:P4(固体.白磷)+5O2(气体)= P4O10(固体) △H=-2983.2kJ·mol-1①
P(固体.红磷)+5/4 O2(气体)=1/4 P4O10(固体) △H=-738.5kJ·mol-1②
由热化学方程式来看,更稳定的磷的同素异形体是_______ 。试写出白磷转化为红磷的热化学方程式________________________ 。
已知:P4(固体.白磷)+5O2(气体)= P4O10(固体) △H=-2983.2kJ·mol-1①
P(固体.红磷)+5/4 O2(气体)=1/4 P4O10(固体) △H=-738.5kJ·mol-1②
由热化学方程式来看,更稳定的磷的同素异形体是
您最近一年使用:0次



