名校
1 . 氢能是一种绿色能源,研发新型制氢技术具有重要意义。
(1)甘油 、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
反应I: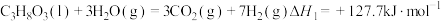
反应Ⅱ: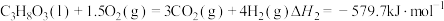
①
___________ 。
②除 外,可能还会产生
外,可能还会产生 等副产物,为了提高原子利用率,最需要抑制
等副产物,为了提高原子利用率,最需要抑制 的生成,原因是
的生成,原因是___________ 。
(2)“表面改性铝粉分解水制氢”因 储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响
储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响 还原活性的主要因素,工业上常用
还原活性的主要因素,工业上常用 溶液或锡酸钠
溶液或锡酸钠 溶液作为
溶液作为 粉的改性试剂。已知:
粉的改性试剂。已知: 。
。
①利用 溶液改性
溶液改性 粉的原理可用化学方程式表示为
粉的原理可用化学方程式表示为___________ 。
② 下,向两份质量和粒径均相同的
下,向两份质量和粒径均相同的 粉中,分别加入等体积
粉中,分别加入等体积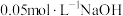 溶液和
溶液和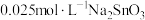 溶液来改性
溶液来改性 粉,氢气产率随时间的变化关系如图1所示。
粉,氢气产率随时间的变化关系如图1所示。 溶液改性效果明显优于
溶液改性效果明显优于 溶液的可能原因是
溶液的可能原因是___________ 。 溶液浓度的变化关系如图2所示。当
溶液浓度的变化关系如图2所示。当 溶液浓度为
溶液浓度为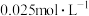 时,氢气产率接近
时,氢气产率接近 。但
。但 溶液过大或过小会大大降低氢气产率,其可能原因分别是
溶液过大或过小会大大降低氢气产率,其可能原因分别是___________ 。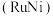 催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与
催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与 原子相连的3个
原子相连的3个 原子分别用
原子分别用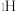 、
、 和
和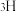 标记)。根据元素电负性的变化规律推测题图的虚线框内微粒
标记)。根据元素电负性的变化规律推测题图的虚线框内微粒 和
和 的化学式分别为
的化学式分别为___________ ;步骤Ⅱ可描述为___________ 。
(1)甘油
 、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:反应I:
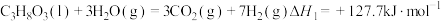
反应Ⅱ:
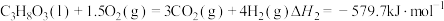
①

②除
 外,可能还会产生
外,可能还会产生 等副产物,为了提高原子利用率,最需要抑制
等副产物,为了提高原子利用率,最需要抑制 的生成,原因是
的生成,原因是(2)“表面改性铝粉分解水制氢”因
 储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响
储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响 还原活性的主要因素,工业上常用
还原活性的主要因素,工业上常用 溶液或锡酸钠
溶液或锡酸钠 溶液作为
溶液作为 粉的改性试剂。已知:
粉的改性试剂。已知: 。
。①利用
 溶液改性
溶液改性 粉的原理可用化学方程式表示为
粉的原理可用化学方程式表示为②
 下,向两份质量和粒径均相同的
下,向两份质量和粒径均相同的 粉中,分别加入等体积
粉中,分别加入等体积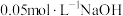 溶液和
溶液和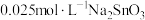 溶液来改性
溶液来改性 粉,氢气产率随时间的变化关系如图1所示。
粉,氢气产率随时间的变化关系如图1所示。 溶液改性效果明显优于
溶液改性效果明显优于 溶液的可能原因是
溶液的可能原因是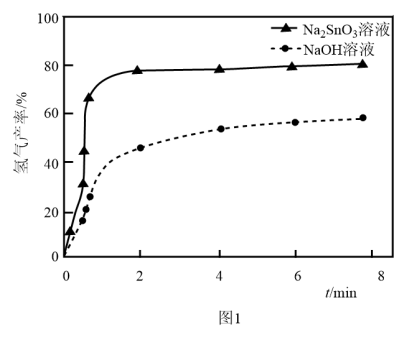
 溶液浓度的变化关系如图2所示。当
溶液浓度的变化关系如图2所示。当 溶液浓度为
溶液浓度为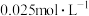 时,氢气产率接近
时,氢气产率接近 。但
。但 溶液过大或过小会大大降低氢气产率,其可能原因分别是
溶液过大或过小会大大降低氢气产率,其可能原因分别是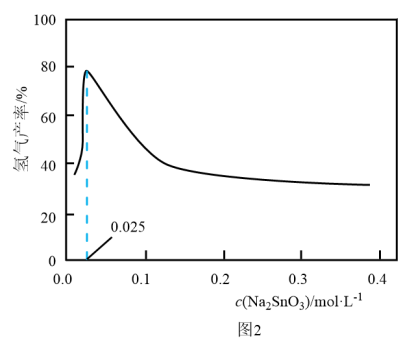
 催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与
催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与 原子相连的3个
原子相连的3个 原子分别用
原子分别用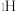 、
、 和
和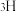 标记)。根据元素电负性的变化规律推测题图的虚线框内微粒
标记)。根据元素电负性的变化规律推测题图的虚线框内微粒 和
和 的化学式分别为
的化学式分别为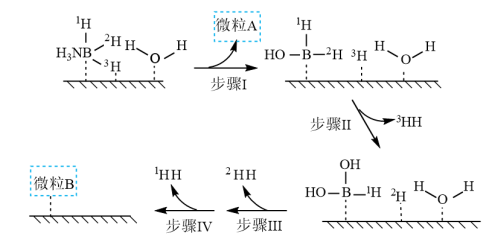
您最近一年使用:0次
2 . 利用化学知识可以合成物质、消除大气污染。
Ⅰ.二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物 、
、 合成二甲醚。
合成二甲醚。
(1)利用水煤气合成二甲醚的三步反应如下:
①
②
③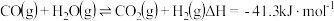
总反应: 的
的
_______ ;一定条件下的密闭容器中,该总反应达到平衡,要提高 的转化率,可以采取的措施是
的转化率,可以采取的措施是 _______  填字母代号
填字母代号 。
。
a.高温高压 b.加入催化剂 c.分离出二甲醚 d.增加 的浓度
的浓度
(2)已知反应 某温度下的平衡常数为
某温度下的平衡常数为 ,此温度下,在密闭容器中加入
,此温度下,在密闭容器中加入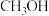 ,反应到某时刻测得各组分的浓度如下:
,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:
_____  填“
填“ ”、“
”、“ ”或“
”或“ 。
。
②若加入 后,经
后,经 反应达到平衡,此时
反应达到平衡,此时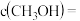
_______ ;该时间内反应速率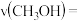
______ 。
Ⅱ.在有氧条件下,新型催化剂 能催化
能催化 与
与 反应生成
反应生成 ,消除烟气中的
,消除烟气中的 污染。
污染。
(3)① 与
与 生成
生成 的反应中,当生成
的反应中,当生成 时,转移的电子数为
时,转移的电子数为_____ 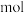 。
。
②将一定比例 、
、 和
和 的混合气体,匀速通入装有催化剂
的混合气体,匀速通入装有催化剂 的反应器中反应
的反应器中反应 装置图
装置图 。
。  的去除率随反应温度的变化曲线如图
的去除率随反应温度的变化曲线如图 所示,在
所示,在 范围内随着温度的升高,
范围内随着温度的升高, 的去除率迅速上升的主要原因是
的去除率迅速上升的主要原因是 ______ ;当反应温度高于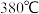 时,
时, 的去除率迅速下降的原因可能是
的去除率迅速下降的原因可能是 _______ 。
Ⅰ.二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物
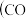 、
、 合成二甲醚。
合成二甲醚。(1)利用水煤气合成二甲醚的三步反应如下:
①

②

③
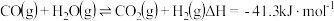
总反应:
 的
的
 的转化率,可以采取的措施是
的转化率,可以采取的措施是  填字母代号
填字母代号 。
。 a.高温高压 b.加入催化剂 c.分离出二甲醚 d.增加
 的浓度
的浓度(2)已知反应
 某温度下的平衡常数为
某温度下的平衡常数为 ,此温度下,在密闭容器中加入
,此温度下,在密闭容器中加入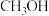 ,反应到某时刻测得各组分的浓度如下:
,反应到某时刻测得各组分的浓度如下: | 物质 | 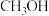 | 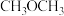 |  |
浓度 |  | 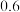 | 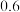 |

 填“
填“ ”、“
”、“ ”或“
”或“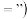 。
。 ②若加入
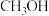 后,经
后,经 反应达到平衡,此时
反应达到平衡,此时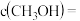
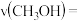
Ⅱ.在有氧条件下,新型催化剂
 能催化
能催化 与
与 反应生成
反应生成 ,消除烟气中的
,消除烟气中的 污染。
污染。 (3)①
 与
与 生成
生成 的反应中,当生成
的反应中,当生成 时,转移的电子数为
时,转移的电子数为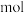 。
。 ②将一定比例
 、
、 和
和 的混合气体,匀速通入装有催化剂
的混合气体,匀速通入装有催化剂 的反应器中反应
的反应器中反应 装置图
装置图 。
。 
 的去除率随反应温度的变化曲线如图
的去除率随反应温度的变化曲线如图 所示,在
所示,在 范围内随着温度的升高,
范围内随着温度的升高, 的去除率迅速上升的主要原因是
的去除率迅速上升的主要原因是 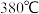 时,
时, 的去除率迅速下降的原因可能是
的去除率迅速下降的原因可能是 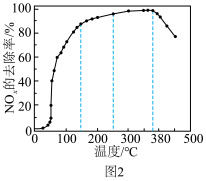
您最近一年使用:0次
3 .  甲烷化加快了能源结构由化石燃料向可再生碳资源的转变。
甲烷化加快了能源结构由化石燃料向可再生碳资源的转变。
(1) 甲烷化反应最早由化学家Paul Sabatier提出。在一定的温度和压力条件下,将按一定比例混合的
甲烷化反应最早由化学家Paul Sabatier提出。在一定的温度和压力条件下,将按一定比例混合的 和
和 通过装有催化剂的反应器可得到甲烷。已知:
通过装有催化剂的反应器可得到甲烷。已知:

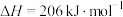 ;
;

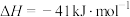 。
。
则反应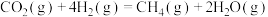 的
的
___________  ,
,
___________ 0(填“>”、“<”或“=”)。
(2)催化剂的选择是 甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得
甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得 转化率和生成
转化率和生成 选择性随温度变化的影响如下图所示。
选择性随温度变化的影响如下图所示。
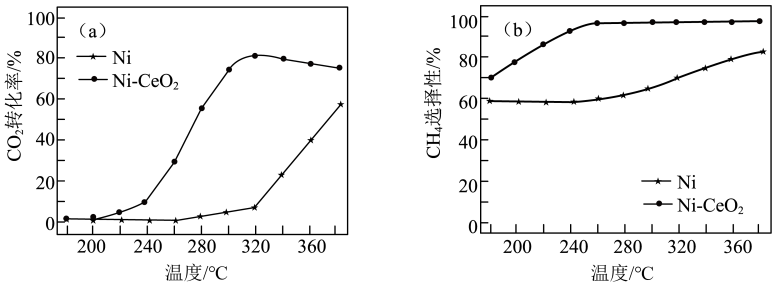
①高于320℃后,以Ni- 为催化剂,
为催化剂, 转化率略有下降,而以Ni为催化剂,
转化率略有下降,而以Ni为催化剂, 转化率却仍在上升,其原因是
转化率却仍在上升,其原因是___________ 。
②对比上述两种催化剂的催化性能,工业上应选择的催化剂是___________ ,使用的合适温度为___________ 。
(3)近年来新兴的生物电催化技术运用微生物电解池也可实现 甲烷化,其工作原理如图所示。
甲烷化,其工作原理如图所示。
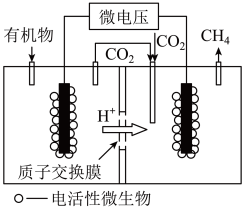
①微生物电解池实现 甲烷化的阴极电极反应式为
甲烷化的阴极电极反应式为___________ 。
②如果处理有机物[ ]产生标准状况下56L的甲烷,则理论上导线中通过的电子的物质的量为
]产生标准状况下56L的甲烷,则理论上导线中通过的电子的物质的量为___________ 。
 甲烷化加快了能源结构由化石燃料向可再生碳资源的转变。
甲烷化加快了能源结构由化石燃料向可再生碳资源的转变。(1)
 甲烷化反应最早由化学家Paul Sabatier提出。在一定的温度和压力条件下,将按一定比例混合的
甲烷化反应最早由化学家Paul Sabatier提出。在一定的温度和压力条件下,将按一定比例混合的 和
和 通过装有催化剂的反应器可得到甲烷。已知:
通过装有催化剂的反应器可得到甲烷。已知:
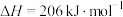 ;
;
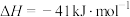 。
。则反应
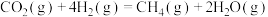 的
的
 ,
,
(2)催化剂的选择是
 甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得
甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得 转化率和生成
转化率和生成 选择性随温度变化的影响如下图所示。
选择性随温度变化的影响如下图所示。
①高于320℃后,以Ni-
 为催化剂,
为催化剂, 转化率略有下降,而以Ni为催化剂,
转化率略有下降,而以Ni为催化剂, 转化率却仍在上升,其原因是
转化率却仍在上升,其原因是②对比上述两种催化剂的催化性能,工业上应选择的催化剂是
(3)近年来新兴的生物电催化技术运用微生物电解池也可实现
 甲烷化,其工作原理如图所示。
甲烷化,其工作原理如图所示。
①微生物电解池实现
 甲烷化的阴极电极反应式为
甲烷化的阴极电极反应式为②如果处理有机物[
 ]产生标准状况下56L的甲烷,则理论上导线中通过的电子的物质的量为
]产生标准状况下56L的甲烷,则理论上导线中通过的电子的物质的量为
您最近一年使用:0次
4 . “2030年前实现碳达峰、2060年前实现碳中和”是中国对世界的庄严承诺,体现大国的责任和担当。
(1)CO2作为未来的重要碳源,其选择性加氢合成CH3OH一直是研究热点,在CO2加氢合成CH3OH的体系中,同时发生以下反应:
反应Ⅰ: ΔH1=-49kJ·mol-1
ΔH1=-49kJ·mol-1
反应Ⅱ: ΔH2=+41.2kJ·mol-1
ΔH2=+41.2kJ·mol-1
①反应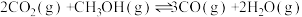 的ΔH=
的ΔH=_____ 。
②将1molCO2和3molH2混合气体以一定流速通过装有催化剂的反应器,CH3OH的选择性、H2的转化率与温度的关系如图1所示。( )
)
a.230℃时,测得CO2的转化率为40%,此时反应Ⅱ中消耗H2的物质的量为_____ 。
b.随着温度的升高,H2的转化率增大,其主要原因是_____ 。
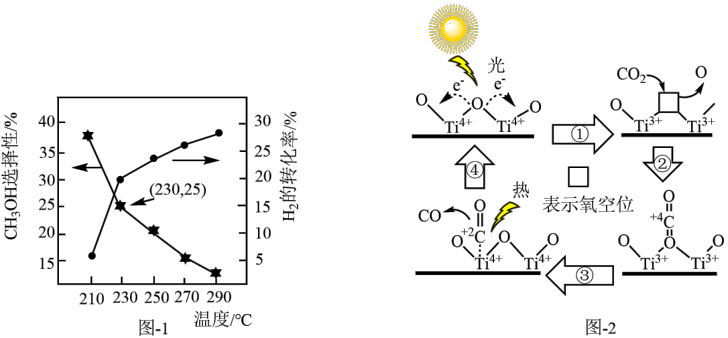
(2)以TiO2为催化剂,光热化学循环分解CO2为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图2所示。根据元素电负性的变化规律,该过程可以描述为_____ 。
(3)一种脱除和利用水煤气中的CO2的方法如图3所示:
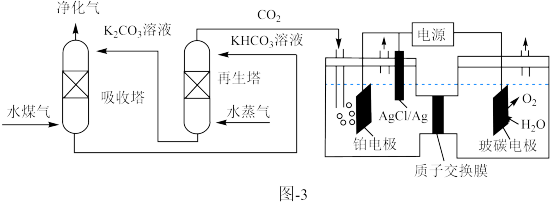
①某温度下,吸收塔中K2CO3溶液吸收一定量的CO2后,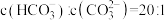 ,则该溶液的pH=
,则该溶液的pH=_____ 。(该温度下H2CO3的Ka1=4.6×10-7,Ka2=5.0×10-11)
②利用电化学原理,将CO2电催化还原为CH4,阴极上除发生AgCl转化为Ag的反应外,另一个电极反应式为_____ 。
(1)CO2作为未来的重要碳源,其选择性加氢合成CH3OH一直是研究热点,在CO2加氢合成CH3OH的体系中,同时发生以下反应:
反应Ⅰ:
 ΔH1=-49kJ·mol-1
ΔH1=-49kJ·mol-1反应Ⅱ:
 ΔH2=+41.2kJ·mol-1
ΔH2=+41.2kJ·mol-1①反应
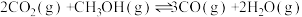 的ΔH=
的ΔH=②将1molCO2和3molH2混合气体以一定流速通过装有催化剂的反应器,CH3OH的选择性、H2的转化率与温度的关系如图1所示。(
 )
)
a.230℃时,测得CO2的转化率为40%,此时反应Ⅱ中消耗H2的物质的量为
b.随着温度的升高,H2的转化率增大,其主要原因是
(2)以TiO2为催化剂,光热化学循环分解CO2为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图2所示。根据元素电负性的变化规律,该过程可以描述为
(3)一种脱除和利用水煤气中的CO2的方法如图3所示:

①某温度下,吸收塔中K2CO3溶液吸收一定量的CO2后,
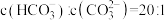 ,则该溶液的pH=
,则该溶液的pH=②利用电化学原理,将CO2电催化还原为CH4,阴极上除发生AgCl转化为Ag的反应外,另一个电极反应式为
您最近一年使用:0次
解题方法
5 . 将 转化为
转化为 ,其主要反应如下:
,其主要反应如下:
碳氯化:
直接氯化:
在 ,将
,将 以物质的量比
以物质的量比 进行反应。体系中气体的平衡分压
进行反应。体系中气体的平衡分压 随温度变化如题图所示。
随温度变化如题图所示。

已知:用气体物质的分压代替浓度计算得到的平衡常数称为分压平衡常数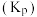 。下列说法正确的是
。下列说法正确的是
 转化为
转化为 ,其主要反应如下:
,其主要反应如下:碳氯化:

直接氯化:

在
 ,将
,将 以物质的量比
以物质的量比 进行反应。体系中气体的平衡分压
进行反应。体系中气体的平衡分压 随温度变化如题图所示。
随温度变化如题图所示。
已知:用气体物质的分压代替浓度计算得到的平衡常数称为分压平衡常数
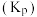 。下列说法正确的是
。下列说法正确的是A.反应 |
| B.碳氯化的反应趋势远小于直接氯化 |
C. 时,反应 时,反应 的分压平衡常数 的分压平衡常数 |
D.生产中采用 进行的原因是提高 进行的原因是提高 的转化率 的转化率 |
您最近一年使用:0次
解题方法
6 . 空气中有丰富的氮气,科学家展开了向空气要氨气的系列研究。
(1)已知: 2H2(g)+O2(g)=2H2O(l) ΔH=a kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=c kJ·mol-1
工业上合成氨反应N2(g)+3H2(g)⇌2NH3(g) ΔH=_______ kJ·mol-1
(2)脱除烟气中的氮氧化物(主要是指NO和NO2)可净化空气、改善环境,是环境保护的主要课题。
①NO2的消除。
可以用碳酸钠溶液来进行吸收,在产生CO2的同时,会生成NaNO2,NaNO2是工业盐的主要成分,在漂白、电镀等方面应用广泛。
a.写出碳酸钠溶液消除NO2的化学方程式:_______ 。
b.经过一系列后续操作可以得到产品NaNO2,但一般会混有一定量_______ 的杂质。
②NO的消除。
HClO可有效脱除NO,但HClO不稳定,实际应用中常用其盐。 次氯酸盐脱除NO的主要过程如下:a.NO+HClO=NO2+HCl b.NO+NO2+H2O=2HNO2 c.HClO+HNO2=HNO3+HCl
下列分析不正确的是_______ 。
A.烟气中含有的少量O2能提高NO的脱除率
B.NO2单独存在时不能被脱除
C.脱除过程中,次氯酸盐溶液的pH下降
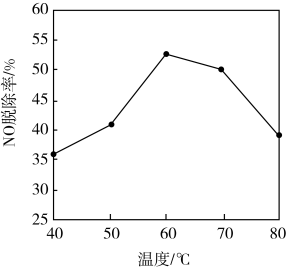
(3)研究不同温度下Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。脱除过程中往往有Cl2产生,原因是_______ (用离子方程式表示);60~80℃NO脱除率下降的原因是_______ 。
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如下图所示。当NO2与NO的物质的量之比为1∶1时,与足量氨气在一定条件下发生脱氮反应。该反应的化学方程式为_______ 。

(1)已知: 2H2(g)+O2(g)=2H2O(l) ΔH=a kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=c kJ·mol-1
工业上合成氨反应N2(g)+3H2(g)⇌2NH3(g) ΔH=
(2)脱除烟气中的氮氧化物(主要是指NO和NO2)可净化空气、改善环境,是环境保护的主要课题。
①NO2的消除。
可以用碳酸钠溶液来进行吸收,在产生CO2的同时,会生成NaNO2,NaNO2是工业盐的主要成分,在漂白、电镀等方面应用广泛。
a.写出碳酸钠溶液消除NO2的化学方程式:
b.经过一系列后续操作可以得到产品NaNO2,但一般会混有一定量
②NO的消除。
HClO可有效脱除NO,但HClO不稳定,实际应用中常用其盐。 次氯酸盐脱除NO的主要过程如下:a.NO+HClO=NO2+HCl b.NO+NO2+H2O=2HNO2 c.HClO+HNO2=HNO3+HCl
下列分析不正确的是
A.烟气中含有的少量O2能提高NO的脱除率
B.NO2单独存在时不能被脱除
C.脱除过程中,次氯酸盐溶液的pH下降
(3)研究不同温度下Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。脱除过程中往往有Cl2产生,原因是

(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如下图所示。当NO2与NO的物质的量之比为1∶1时,与足量氨气在一定条件下发生脱氮反应。该反应的化学方程式为

您最近一年使用:0次
2023-03-30更新
|
606次组卷
|
3卷引用:江苏省连云港市赣榆智贤中学2022-2023学年高一3月阶段检测化学试题
名校
解题方法
7 . 在二氧化碳加氢制甲烷的反应体系中,主要发生反应的热化学方程式为
反应Ⅰ:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH= -164.7 kJ/mol
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH= 41.2 kJ/mol
反应Ⅲ:2CO(g)+2H2(g)=CO2(g)+CH4(g) ΔH= -247.1 kJ/mol
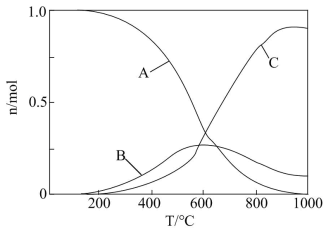
向恒压、密闭容器中通入1 mol CO2和4 mol H2,平衡时CH4、CO、CO2的物质的量随温度的变化如图所示。下列说法正确的是
反应Ⅰ:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH= -164.7 kJ/mol
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH= 41.2 kJ/mol
反应Ⅲ:2CO(g)+2H2(g)=CO2(g)+CH4(g) ΔH= -247.1 kJ/mol
向恒压、密闭容器中通入1 mol CO2和4 mol H2,平衡时CH4、CO、CO2的物质的量随温度的变化如图所示。下列说法正确的是

A.反应Ⅰ的平衡常数可表示为K=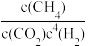 |
| B.图中曲线B表示CO的物质的量随温度的变化 |
| C.提高 CO2转化为CH4的转化率,需要研发在低温区高效的催化剂 |
| D.CH4(g)+H2O(g) =CO(g)+3H2(g)的ΔH= -205.9 kJ/mol |
您最近一年使用:0次
2021-08-11更新
|
2609次组卷
|
17卷引用:江苏省连云港高级中学2022-2023学年高二下学期第二次学情检测化学试题
江苏省连云港高级中学2022-2023学年高二下学期第二次学情检测化学试题(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)2021年秋季高三化学开学摸底考试卷03(广东专用)(已下线)课时38 化学平衡常规图像-2022年高考化学一轮复习小题多维练(全国通用)河北省实验中学2022届高三年级上学期开学考试化学试题江苏省南通市海安高级中学2022届高三期中考试化学试题江苏省海安市实验中学2021-2022学年高三上学期第一次月考化学试题河北深州市长江中学2021-2022学年高二上学期10月月考化学(理)试题河北省石家庄市第二中学2022届高三补偿诊断性考试江苏省高邮市2021-2022学年高二上学期期中学情调研化学试题(已下线)章末培优2 专题2 化学反应速率与化学平衡-2021-2022学年高二化学课后培优练(苏教教版2019选择性必修1)(已下线)专题12 化学反应速率与化学平衡-2022年高考化学二轮复习重点专题常考点突破练2.3.2温度 催化剂对化学平衡的影响 课后湖北省武汉市第四十九中学2023-2024学年高二上学期10月月考化学试题河南省焦作市第十一中学2023-2024学年高二上学期9月份月考 化学试卷四川省眉山市仁寿县校际2023-2024学年高二上学期10月联考化学试题
名校
解题方法
8 . 在二氧化碳加氢制甲醇的反应体系中,主要发生反应的热化学方程式为
反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)∆H1=-49.5kJ·mol-1
反应Ⅱ:CO(g)+2H2(g)=CH3OH(g)∆H2
反应Ⅲ:CO2(g)+H2(g)=CO(g)+H2O(g)∆H3=40.9kJ·mol-1
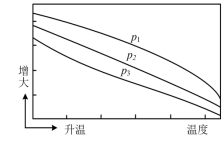
在体积为1L的恒容密闭容器中通入1molCO2和3molH2,发生上述反应,CO2的平衡转化率随温度和压强的变化如图所示。下列说法正确的是
反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)∆H1=-49.5kJ·mol-1
反应Ⅱ:CO(g)+2H2(g)=CH3OH(g)∆H2
反应Ⅲ:CO2(g)+H2(g)=CO(g)+H2O(g)∆H3=40.9kJ·mol-1
在体积为1L的恒容密闭容器中通入1molCO2和3molH2,发生上述反应,CO2的平衡转化率随温度和压强的变化如图所示。下列说法正确的是

| A.∆H2=90.4kJ·mol-1 |
| B.在某温度下,平衡时容器中CH3OH(g)为0.3mol,CO(g)为0.3mol,则反应Ⅲ的平衡常数为0.25 |
| C.压强p1、p2、p3由小到大的顺序为p1<p2<p3 |
| D.高温、高压一定有利于提高CO2的平衡转化率 |
您最近一年使用:0次
2021-02-15更新
|
519次组卷
|
3卷引用:江苏省连云港市赣榆智贤中学2020-2021学年高二3月月考化学试题
名校
9 . 一定条件下,通过下列反应可实现燃煤烟气中硫的回收:2CO(g)+SO2(g)  2CO2(g)+S(l) ∆H
2CO2(g)+S(l) ∆H
(1)已知:2CO(g)+O2(g)=2CO2(g) ∆H1= -566kJ/mol;S(l)+O2(g)=SO2(g) ∆H2= -296kJ/mol,则反应热∆H=______ kJ/mol。
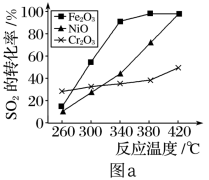
(2)其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图a所示。260℃时_______ (填“Fe2O3”、“NiO”或“Cr2O3”)作催化剂反应速率最快。Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑价格因素,选择Fe2O3的主要优点是___________ 。
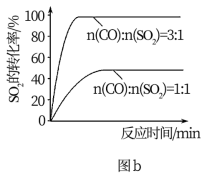
(3)科研小组在380℃、Fe2O3作催化剂时,研究了不同投料比[n(CO):n(SO2)] 对SO2转化率的影响,结果如图b所示。请分析当n(CO):n(SO2)=1:1时,SO2转化率接近50%的原因___________
(4)工业上还可用Na2SO3溶液吸收烟气中SO2:Na2SO3+SO2+H2O=2NaHSO3。某温度下用1.0mol/Na2SO3溶液吸收纯净的SO2,当溶液中c(SO )降至0.2mol/L时,吸收能力显著下降,应更换吸收剂。此时溶液中c(HSO
)降至0.2mol/L时,吸收能力显著下降,应更换吸收剂。此时溶液中c(HSO )约为
)约为_________ mol/L,溶液的pH=___________ 。(已知该温度下亚硫酸的平衡常数Ka1=1.75×10-2,Ka2=1.25×10-7)
(5)利用硫酸钠溶液吸收SO2,再用惰性电极电解处理SO2.将阴极区溶液导出,经过滤分离出硫磺后,可循环吸收利用,装置如图所示。
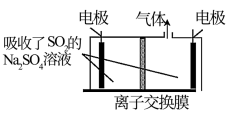
①该离子交换膜为___________ (填“阳离子交换膜”或“阴离子交换膜”)。
②阴极的电极反应式为___________ 。
 2CO2(g)+S(l) ∆H
2CO2(g)+S(l) ∆H (1)已知:2CO(g)+O2(g)=2CO2(g) ∆H1= -566kJ/mol;S(l)+O2(g)=SO2(g) ∆H2= -296kJ/mol,则反应热∆H=
(2)其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图a所示。260℃时

(3)科研小组在380℃、Fe2O3作催化剂时,研究了不同投料比[n(CO):n(SO2)] 对SO2转化率的影响,结果如图b所示。请分析当n(CO):n(SO2)=1:1时,SO2转化率接近50%的原因

(4)工业上还可用Na2SO3溶液吸收烟气中SO2:Na2SO3+SO2+H2O=2NaHSO3。某温度下用1.0mol/Na2SO3溶液吸收纯净的SO2,当溶液中c(SO
 )降至0.2mol/L时,吸收能力显著下降,应更换吸收剂。此时溶液中c(HSO
)降至0.2mol/L时,吸收能力显著下降,应更换吸收剂。此时溶液中c(HSO )约为
)约为(5)利用硫酸钠溶液吸收SO2,再用惰性电极电解处理SO2.将阴极区溶液导出,经过滤分离出硫磺后,可循环吸收利用,装置如图所示。

①该离子交换膜为
②阴极的电极反应式为
您最近一年使用:0次
2021-01-14更新
|
223次组卷
|
2卷引用:江苏省连云港市2021届高三1月适应性演练模拟考试化学试题
10 . 氢能是一种极具发展潜力的清洁能源,甲烷水蒸气催化重整是制备氢气的方法之一,涉及的主要反应为
反应①: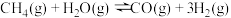
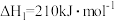
反应②:
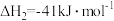
(1)反应 的
的
________  。
。
(2)用 可以吸收催化重整过程中产生的
可以吸收催化重整过程中产生的 。
。
①实验发现, 体积分数和
体积分数和 消耗率随时间变化关系如下图1所示。
消耗率随时间变化关系如下图1所示。
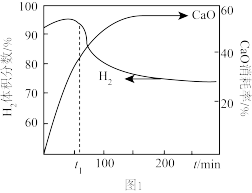
从 时开始,
时开始, 体积分数显著降低,此时
体积分数显著降低,此时 消耗率约为35%,但已失效,结合化学方程式解释原因:
消耗率约为35%,但已失效,结合化学方程式解释原因:________ 。
②其他条件不变,相同时间内,向催化重整体系中投入等质量粒径不同的 可以提高
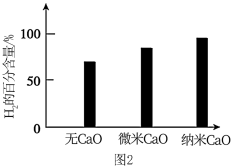
可以提高 的百分含量。对比实验的结果如图2所示。投入纳米
的百分含量。对比实验的结果如图2所示。投入纳米 时
时 百分含量比投入微米
百分含量比投入微米 时的大,原因是
时的大,原因是________ 。
(3)催化重整过程中,催化剂活性会因积碳反应而降低,相关数据如下表:
①研究发现,如果反应Ⅰ不发生积碳过程,则反应Ⅱ也不会发生积碳过程。为了抑制积碳反应的发生,应采取的措施是________ 。
②如果Ⅰ、Ⅱ均发生了积碳反应,通入过量水蒸气能有效清除积碳,反应的化学方程式为________ 。
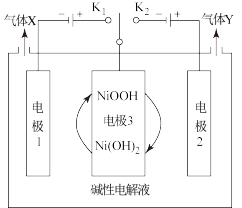
(4)利用太阳能光伏电池可电解水制高纯氢,工作示意图如下图所示。连接 时,电极Ⅲ发生的电极反应式为
时,电极Ⅲ发生的电极反应式为__________ 。
反应①:
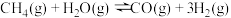
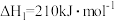
反应②:

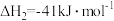
(1)反应
 的
的
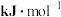 。
。(2)用
 可以吸收催化重整过程中产生的
可以吸收催化重整过程中产生的 。
。①实验发现,
 体积分数和
体积分数和 消耗率随时间变化关系如下图1所示。
消耗率随时间变化关系如下图1所示。

从
 时开始,
时开始, 体积分数显著降低,此时
体积分数显著降低,此时 消耗率约为35%,但已失效,结合化学方程式解释原因:
消耗率约为35%,但已失效,结合化学方程式解释原因:②其他条件不变,相同时间内,向催化重整体系中投入等质量粒径不同的
 可以提高
可以提高 的百分含量。对比实验的结果如图2所示。投入纳米
的百分含量。对比实验的结果如图2所示。投入纳米 时
时 百分含量比投入微米
百分含量比投入微米 时的大,原因是
时的大,原因是(3)催化重整过程中,催化剂活性会因积碳反应而降低,相关数据如下表:
| 反应 | Ⅰ | Ⅱ |
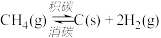 | 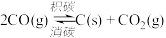 | |
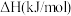 | 75 |  |
②如果Ⅰ、Ⅱ均发生了积碳反应,通入过量水蒸气能有效清除积碳,反应的化学方程式为
(4)利用太阳能光伏电池可电解水制高纯氢,工作示意图如下图所示。连接
 时,电极Ⅲ发生的电极反应式为
时,电极Ⅲ发生的电极反应式为
您最近一年使用:0次



