名校
1 . 金属矿物常以硫化物形式存在,如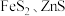 等。
等。
Ⅰ.掺烧 和
和 ,用于制铁精粉和硫酸
,用于制铁精粉和硫酸
(1)已知: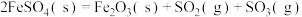 为吸热反应。
为吸热反应。 时,
时, 固体在
固体在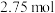 氧气中完全燃烧生成气态
氧气中完全燃烧生成气态 和
和 固体,放出
固体,放出 热量。
热量。
① 与
与 反应的热化学方程式为
反应的热化学方程式为_________ 。
②将 与
与 掺烧(混合燃烧),其目的包括
掺烧(混合燃烧),其目的包括_________ (填字母)。
 节约燃料和能量
节约燃料和能量  为制备硫酸提供原料
为制备硫酸提供原料  减少空气污染
减少空气污染
(2) 常带一定量的结晶水。
常带一定量的结晶水。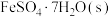 分解脱水反应的能量变化如图所示。
分解脱水反应的能量变化如图所示。
_________  。
。
②为维持炉内温度基本不变, 所带结晶水越多,掺烧比
所带结晶水越多,掺烧比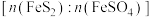 应
应_________ 。(填“增大”“减小”或“不变”)。
Ⅱ.浸出法处理
(3) 难溶于水,处理
难溶于水,处理 常使用酸浸法,两步反应依次为:
常使用酸浸法,两步反应依次为:
ⅰ.
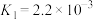
ⅱ.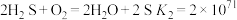
①平衡常数 的表达式为
的表达式为_________ 。
②仅发生反应ⅰ时, 酸浸效果不好,结合平衡常数说明原因:
酸浸效果不好,结合平衡常数说明原因:_________ 。
(4)从平衡移动角度解释通入 在
在 酸浸过程中的作用:
酸浸过程中的作用:_________ 。
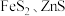 等。
等。Ⅰ.掺烧
 和
和 ,用于制铁精粉和硫酸
,用于制铁精粉和硫酸(1)已知:
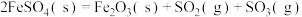 为吸热反应。
为吸热反应。 时,
时, 固体在
固体在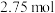 氧气中完全燃烧生成气态
氧气中完全燃烧生成气态 和
和 固体,放出
固体,放出 热量。
热量。①
 与
与 反应的热化学方程式为
反应的热化学方程式为②将
 与
与 掺烧(混合燃烧),其目的包括
掺烧(混合燃烧),其目的包括 节约燃料和能量
节约燃料和能量  为制备硫酸提供原料
为制备硫酸提供原料  减少空气污染
减少空气污染(2)
 常带一定量的结晶水。
常带一定量的结晶水。 分解脱水反应的能量变化如图所示。
分解脱水反应的能量变化如图所示。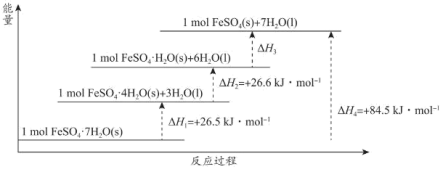

 。
。②为维持炉内温度基本不变,
 所带结晶水越多,掺烧比
所带结晶水越多,掺烧比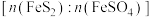 应
应Ⅱ.浸出法处理

(3)
 难溶于水,处理
难溶于水,处理 常使用酸浸法,两步反应依次为:
常使用酸浸法,两步反应依次为:ⅰ.

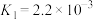
ⅱ.
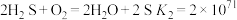
①平衡常数
 的表达式为
的表达式为②仅发生反应ⅰ时,
 酸浸效果不好,结合平衡常数说明原因:
酸浸效果不好,结合平衡常数说明原因:(4)从平衡移动角度解释通入
 在
在 酸浸过程中的作用:
酸浸过程中的作用:
您最近一年使用:0次
名校
解题方法
2 . 用甲烷制高纯氢气是目前研究热点之一、
(1)一定条件下,CH4(g) C(s) + 2H2(g) 反应历程如图1所示,其中化学反应速率最慢的反应过程为
C(s) + 2H2(g) 反应历程如图1所示,其中化学反应速率最慢的反应过程为___________ 。

(2)甲烷水蒸气催化重整可制得较高纯度的氢气,相关反应如下。
反应Ⅰ CH4(g) + H2O(g) CO(g) + 3H2(g) ∆H1 = +206 kJ·mol-1
CO(g) + 3H2(g) ∆H1 = +206 kJ·mol-1
反应Ⅱ CO(g) + H2O(g) CO2(g) + H2(g) ΔH2= -41 kJ·mol-1
CO2(g) + H2(g) ΔH2= -41 kJ·mol-1
① 总反应:CH4(g) + 2H2O(g) CO2(g) + 4H2(g) ΔH =
CO2(g) + 4H2(g) ΔH = ___________
② 1000 ℃恒容密闭容器(2L)中发生反应Ⅰ,已知1000 ℃时,反应I的平衡常数K=2,请结合K、Q关系判断:若容器中 n(CH4) =n(H2O)= n(H2)= 1 mol 、n(CO)=2 mol 时,反应处于___________ 状态(正向进行、逆向进行、平衡)。
③ 已知830 ℃时,反应II的平衡常数K=1。在容积不变的密闭容器中,将2 mol CO与8 mol H2O混合加热到830 ℃,反应达平衡时CO的转化率为___________ 。
④ 在常压、600 ℃条件下,甲烷制备氢气的总反应中H2平衡产率为82%。若加入适量生石灰后H2的产率可提高到95%,应用化学平衡移动原理解释原因___________ 。
(3)科学家研究将CH4、H2O与CH4、CO2联合重整制备氢气:
反应Ⅰ:CH4(g) + H2O(g) CO(g) + 3H2(g) ∆H1 = +206 kJ·mol-1
CO(g) + 3H2(g) ∆H1 = +206 kJ·mol-1
反应Ⅲ:CH4(g) + CO2(g) 2CO(g) + 2H2(g) ΔH3= +247 kJ·mol-1
2CO(g) + 2H2(g) ΔH3= +247 kJ·mol-1
常压下,将CH4、H2O和CO2按一定比例混合置于密闭容器中,相同时间不同温度下测得体系中n(H2): n(CO)变化如图2所示。
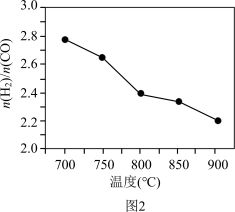
① 已知700℃、NiO催化剂条件下,向反应体系中加入少量O2可增加H2产率,此条件下还原性CO___________ H2(填“>”“<”或“=”)。
② 随着温度升高n(H2) : n(CO)变小的原因可能是___________ 。
(1)一定条件下,CH4(g)
 C(s) + 2H2(g) 反应历程如图1所示,其中化学反应速率最慢的反应过程为
C(s) + 2H2(g) 反应历程如图1所示,其中化学反应速率最慢的反应过程为
(2)甲烷水蒸气催化重整可制得较高纯度的氢气,相关反应如下。
反应Ⅰ CH4(g) + H2O(g)
 CO(g) + 3H2(g) ∆H1 = +206 kJ·mol-1
CO(g) + 3H2(g) ∆H1 = +206 kJ·mol-1反应Ⅱ CO(g) + H2O(g)
 CO2(g) + H2(g) ΔH2= -41 kJ·mol-1
CO2(g) + H2(g) ΔH2= -41 kJ·mol-1① 总反应:CH4(g) + 2H2O(g)
 CO2(g) + 4H2(g) ΔH =
CO2(g) + 4H2(g) ΔH = ② 1000 ℃恒容密闭容器(2L)中发生反应Ⅰ,已知1000 ℃时,反应I的平衡常数K=2,请结合K、Q关系判断:若容器中 n(CH4) =n(H2O)= n(H2)= 1 mol 、n(CO)=2 mol 时,反应处于
③ 已知830 ℃时,反应II的平衡常数K=1。在容积不变的密闭容器中,将2 mol CO与8 mol H2O混合加热到830 ℃,反应达平衡时CO的转化率为
④ 在常压、600 ℃条件下,甲烷制备氢气的总反应中H2平衡产率为82%。若加入适量生石灰后H2的产率可提高到95%,应用化学平衡移动原理解释原因
(3)科学家研究将CH4、H2O与CH4、CO2联合重整制备氢气:
反应Ⅰ:CH4(g) + H2O(g)
 CO(g) + 3H2(g) ∆H1 = +206 kJ·mol-1
CO(g) + 3H2(g) ∆H1 = +206 kJ·mol-1反应Ⅲ:CH4(g) + CO2(g)
 2CO(g) + 2H2(g) ΔH3= +247 kJ·mol-1
2CO(g) + 2H2(g) ΔH3= +247 kJ·mol-1常压下,将CH4、H2O和CO2按一定比例混合置于密闭容器中,相同时间不同温度下测得体系中n(H2): n(CO)变化如图2所示。

① 已知700℃、NiO催化剂条件下,向反应体系中加入少量O2可增加H2产率,此条件下还原性CO
② 随着温度升高n(H2) : n(CO)变小的原因可能是
您最近一年使用:0次
3 . 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
I.制取氢气
(1)甲醇和水蒸气制取氢气的过程中有下列反应:
CH3OH(g) CO(g)+2H2(g) △H=+91 kJ·mol-1
CO(g)+2H2(g) △H=+91 kJ·mol-1
CO(g)+H2O(g) CO2(g)+H2 (g) △H=-4lkJ·mol-1
CO2(g)+H2 (g) △H=-4lkJ·mol-1
写出以甲醇为原料制取氢气的热化学方程式___________ 。
(2)理论上,能提高H2平衡产率的措施有___________ (写出一条即可)。
II.储存氢气
硼氢化钠(NaBH4) 是研究最广泛的储氢材料之一;
已知: i.B的电负性为2.0 H的电负性为2.1
ii.25℃下NaBH4 在水中的溶解度为55g,NaBO2在水中的溶解度为0.28g
(3)向NaBH4 水溶液中加入催化剂Ru/NGR后,能够迅速反应,生成偏硼酸钠(NaBO2) 和氢气。写出该反应的化学方程式___________ 。
(4)在研究浓度对催化剂Ru/NGR 活性的影响时,发现B 点后(见下图)增加NaBH4的浓度,制氢速率反而下降,推断可能的原因是___________ 。

(5)用惰性电极电解NaBO2 溶液可制得NaBH4, 实现物质的循环使用,制备装置如图所示。
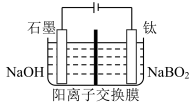
①钛电极的电极反应式是___________ ;
②电解过程中,阴极区溶液pH___________ 。(填“增大”“减小”或“不变”)
I.制取氢气
(1)甲醇和水蒸气制取氢气的过程中有下列反应:
CH3OH(g)
 CO(g)+2H2(g) △H=+91 kJ·mol-1
CO(g)+2H2(g) △H=+91 kJ·mol-1CO(g)+H2O(g)
 CO2(g)+H2 (g) △H=-4lkJ·mol-1
CO2(g)+H2 (g) △H=-4lkJ·mol-1写出以甲醇为原料制取氢气的热化学方程式
(2)理论上,能提高H2平衡产率的措施有
II.储存氢气
硼氢化钠(NaBH4) 是研究最广泛的储氢材料之一;
已知: i.B的电负性为2.0 H的电负性为2.1
ii.25℃下NaBH4 在水中的溶解度为55g,NaBO2在水中的溶解度为0.28g
(3)向NaBH4 水溶液中加入催化剂Ru/NGR后,能够迅速反应,生成偏硼酸钠(NaBO2) 和氢气。写出该反应的化学方程式
(4)在研究浓度对催化剂Ru/NGR 活性的影响时,发现B 点后(见下图)增加NaBH4的浓度,制氢速率反而下降,推断可能的原因是

(5)用惰性电极电解NaBO2 溶液可制得NaBH4, 实现物质的循环使用,制备装置如图所示。

①钛电极的电极反应式是
②电解过程中,阴极区溶液pH
您最近一年使用:0次
名校
解题方法
4 . 工业上利用 和
和 反应生成甲醇,也是减少
反应生成甲醇,也是减少 的一种方法。在容积为1L的恒温密闭容器中充入
的一种方法。在容积为1L的恒温密闭容器中充入 和
和 ,一定条件下发生反应:
,一定条件下发生反应: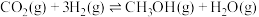
 ,测得
,测得 和
和 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。
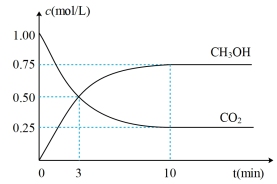
(1)达到平衡的时刻是_______ min(填“3”或“10”)。在前10min内,用 浓度的变化表示的反应速率
浓度的变化表示的反应速率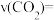
_______ mol/(L•min)。
(2)能判断该反应达到化学平衡状态的依据是_______。
(3)达平衡后, 的转化率是
的转化率是_______ 。平衡常数K=_______ (计算结果保留一位小数)。
(4)工业上也可用CO和 合成甲醇
合成甲醇
已知:①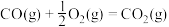

②

③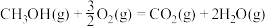

则反应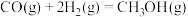

_______ kJ/mol
 和
和 反应生成甲醇,也是减少
反应生成甲醇,也是减少 的一种方法。在容积为1L的恒温密闭容器中充入
的一种方法。在容积为1L的恒温密闭容器中充入 和
和 ,一定条件下发生反应:
,一定条件下发生反应: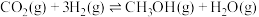
 ,测得
,测得 和
和 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。
(1)达到平衡的时刻是
 浓度的变化表示的反应速率
浓度的变化表示的反应速率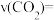
(2)能判断该反应达到化学平衡状态的依据是_______。
| A.容器内压强不变 | B.混合气体中 不变 不变 |
C. | D.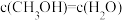 |
(3)达平衡后,
 的转化率是
的转化率是(4)工业上也可用CO和
 合成甲醇
合成甲醇已知:①
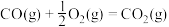

②


③
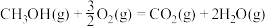

则反应
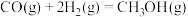

您最近一年使用:0次
名校
5 . 化学链燃烧(CLC)是利用载氧体将空气中的氧传输至燃料的新技术,与传统燃烧方式相比,避免了空气和燃料的直接接触,有利于高效捕集 。基于
。基于 载氧体的甲烷化学链燃烧技术示意图如图。
载氧体的甲烷化学链燃烧技术示意图如图。
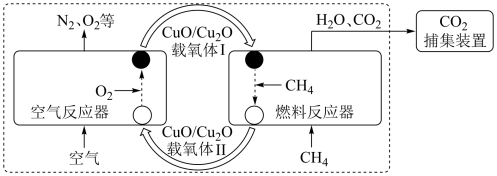
空气反应器与燃料反应器中发生的反应分别为:
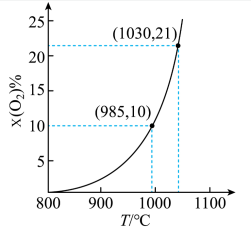
①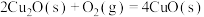
 kJ⋅mol
kJ⋅mol
②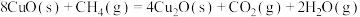
 kJ⋅mol
kJ⋅mol
(1)甲烷完全燃烧生成气态水的热化学方程式为_____ 。
(2)反应②的平衡常数表达式
_____ 。
(3)氧的质量分数:载氧体Ⅰ_____ (填“>”、“=“或“<”)载氧体Ⅱ.
(4)往盛有 载氧体的刚性密闭容器中充入空气[氧气的物质的量分数
载氧体的刚性密闭容器中充入空气[氧气的物质的量分数 为21%],发生反应①。平衡时
为21%],发生反应①。平衡时 随反应温度T变化的曲线如图所示。985℃时
随反应温度T变化的曲线如图所示。985℃时 的平衡转化率
的平衡转化率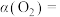
_____ 。(保留2位有效数字)。
(5)根据如图, 随温度升高而增大的原因是
随温度升高而增大的原因是_____ 。反应温度必须控制在1030℃以下,原因是_____ 。
(6)载氧体掺杂改性,可加快化学链燃烧速率,使用不同掺杂的 载氧体,反应②活化能如下表所示。
载氧体,反应②活化能如下表所示。
由表中数据判断:使用_____ (填“氧化铝”或“膨润土”)掺杂的载氧体反应较快;使用氧化铝或者膨润土掺杂的载氧体,单位时间内燃料反应器释放的热量分别为akJ、bkJ,则a_____ b(填“>”“=”或“<”)
 。基于
。基于 载氧体的甲烷化学链燃烧技术示意图如图。
载氧体的甲烷化学链燃烧技术示意图如图。
空气反应器与燃料反应器中发生的反应分别为:
①
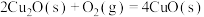
 kJ⋅mol
kJ⋅mol
②
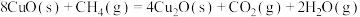
 kJ⋅mol
kJ⋅mol
(1)甲烷完全燃烧生成气态水的热化学方程式为
(2)反应②的平衡常数表达式

(3)氧的质量分数:载氧体Ⅰ
(4)往盛有
 载氧体的刚性密闭容器中充入空气[氧气的物质的量分数
载氧体的刚性密闭容器中充入空气[氧气的物质的量分数 为21%],发生反应①。平衡时
为21%],发生反应①。平衡时 随反应温度T变化的曲线如图所示。985℃时
随反应温度T变化的曲线如图所示。985℃时 的平衡转化率
的平衡转化率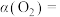
(5)根据如图,
 随温度升高而增大的原因是
随温度升高而增大的原因是
(6)载氧体掺杂改性,可加快化学链燃烧速率,使用不同掺杂的
 载氧体,反应②活化能如下表所示。
载氧体,反应②活化能如下表所示。| 载氧体掺杂物质 | 氧化铝 | 膨润土 |
活化能//kJ·mol |  | 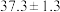 |
您最近一年使用:0次
名校
解题方法
6 . CO2减排能有效降低温室效应,同时,CO2也是一种重要的资源,因此CO2捕集与转化技术研究备受关注。
I.CO2催化加氢制甲醇
(1)已知:
①CO2(g)+H2(g)=CO(g)+H2O(g) △H1=+41kJ•mol-1
②CO(g)+2H2(g)=CH3OH(g) △H2=-90kJ•mol-1
则CO2催化加氢制甲醇的热化学方程式为_______ 。若反应①为慢反应(活化能高),下列图中能体现上述能量变化的是_______ 。
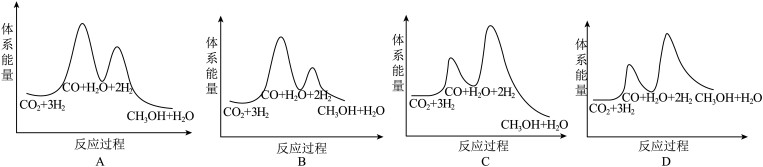
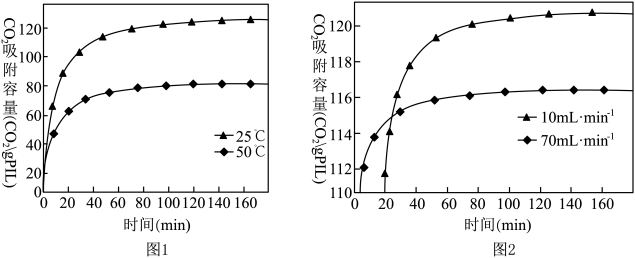
(2)已知离子液体聚合物在不同温度和不同CO2流速下,CO2吸附容量随时间的变化如图1和图2。
①离子液体聚合物捕集CO2的反应为_______ (填“吸热”或“放热”)反应。
②离子液体聚合物捕集CO2的有利条件是_______ 。
Ⅲ:Me-CO2电池捕集CO2
图3是一种基于Na超离子导体固体电解质的钠-二氧化碳电池,该电池以饱和氯化钠溶液作为水系电解液,以氮掺杂单壁碳纳米角(N-SWCNH)为催化剂,其主要放电产物为NaHCO3和C。_______ (填“正”或“负”)。
(4)B极的电极反应为_______ 。
I.CO2催化加氢制甲醇
(1)已知:
①CO2(g)+H2(g)=CO(g)+H2O(g) △H1=+41kJ•mol-1
②CO(g)+2H2(g)=CH3OH(g) △H2=-90kJ•mol-1
则CO2催化加氢制甲醇的热化学方程式为
(2)已知离子液体聚合物在不同温度和不同CO2流速下,CO2吸附容量随时间的变化如图1和图2。
①离子液体聚合物捕集CO2的反应为
②离子液体聚合物捕集CO2的有利条件是
Ⅲ:Me-CO2电池捕集CO2
图3是一种基于Na超离子导体固体电解质的钠-二氧化碳电池,该电池以饱和氯化钠溶液作为水系电解液,以氮掺杂单壁碳纳米角(N-SWCNH)为催化剂,其主要放电产物为NaHCO3和C。
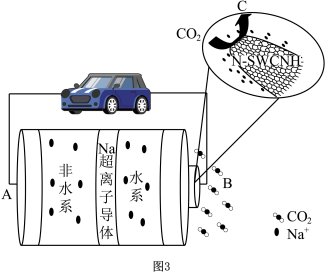
(4)B极的电极反应为
您最近一年使用:0次
名校
解题方法
7 . I.近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
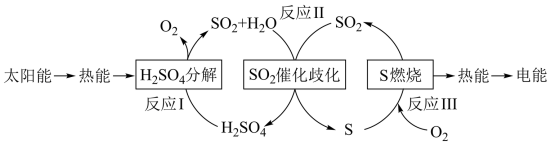
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:___________ 。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

p2___________ p 1(填“>”或“<”),得出该结论的理由是___________ 。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.________
I2+2H2O+___________=___________+___________+2 I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
①B是A的对比实验,则a=___________ 。
②比较A、B、C,可得出的结论是___________ 。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:___________
(5)一定温度下,反应I2(g)+H2(g)⇌2Hl(g)在密闭容器中达到平衡时,测得c(I2)=0.11mmol•L-1,c(H2)=0.11mmol•L-1,c(HI)=0.78mmol•L-1.相同度温下,按下列4组初始浓度进行实验,反应逆向进行的是___________ 。
(注:1mmol•L-1=10-3mol•L-1)
Ⅱ.以银锰精矿(主要含Ag2S、MnS、FeS2)和氧化锰矿(主要含MnO2)为原料联合提取银和锰的一种流程示意图如下。
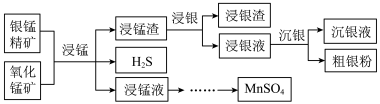
已知:酸性条件下,MnO2的氧化性强于Fe3+。
“浸银”时,使用过量FeCl3、HCl和CaCl2的混合液作为浸出剂,将Ag2S中的银以[AgCl2]-形式浸出。
(6)将“浸银”反应的离子方程式补充完整:_______
□Fe3+ + Ag2S + □ ___________ □ ___________ + 2[AgCl2]- + S
□ ___________ + 2[AgCl2]- + S
(7)结合平衡移动原理,解释浸出剂中Cl-、H+的作用:___________ 。

(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

p2
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.
I2+2H2O+___________=___________+___________+2 I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
| 序号 | A | B | C | D |
| 试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
②比较A、B、C,可得出的结论是
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:
(5)一定温度下,反应I2(g)+H2(g)⇌2Hl(g)在密闭容器中达到平衡时,测得c(I2)=0.11mmol•L-1,c(H2)=0.11mmol•L-1,c(HI)=0.78mmol•L-1.相同度温下,按下列4组初始浓度进行实验,反应逆向进行的是
| A | B | C | D | |
| c(I2)/mmol•L-1 | 1.00 | 0.22 | 0.44 | 0.11 |
| c(H2)/mmol•L-1 | 1.00 | 0.22 | 0.44 | 0.44 |
| c(HI)/mmol•L-1 | 1.00 | 1.56 | 4.00 | 1.56 |
Ⅱ.以银锰精矿(主要含Ag2S、MnS、FeS2)和氧化锰矿(主要含MnO2)为原料联合提取银和锰的一种流程示意图如下。

已知:酸性条件下,MnO2的氧化性强于Fe3+。
“浸银”时,使用过量FeCl3、HCl和CaCl2的混合液作为浸出剂,将Ag2S中的银以[AgCl2]-形式浸出。
(6)将“浸银”反应的离子方程式补充完整:
□Fe3+ + Ag2S + □ ___________
 □ ___________ + 2[AgCl2]- + S
□ ___________ + 2[AgCl2]- + S(7)结合平衡移动原理,解释浸出剂中Cl-、H+的作用:
您最近一年使用:0次
名校
8 . 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
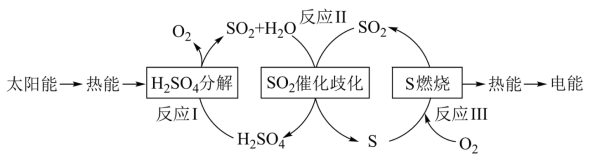
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
写出反应Ⅱ的化学方程式:___________ ,该步反应的ΔH2=___________ kJ·mol-1。
(2)对反应Ⅱ,在某一投料比时,一定压强 (p1)下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

H2SO4在平衡体系中物质的量分数随温度的升高而下降,原因是___________ 。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+____=____+____+2I-,__________
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
①B是A的对比实验,则a=___________ 。
②比较A、B、C,可得出的结论是___________ 。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:___________ 。

(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
写出反应Ⅱ的化学方程式:
(2)对反应Ⅱ,在某一投料比时,一定压强 (p1)下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

H2SO4在平衡体系中物质的量分数随温度的升高而下降,原因是
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+____=____+____+2I-,
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
| A | B | C | D | |
| 试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI与0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI与0.0002 mol I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
②比较A、B、C,可得出的结论是
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:
您最近一年使用:0次
名校
解题方法
9 . 我国科学家研发的“液态阳光”计划通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢制备甲醇。
已知: 产率
产率
(1)制备甲醇的主反应:
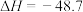 kJ·mol
kJ·mol 。该过程中还存在一个生成CO的副反应,结合反应:
。该过程中还存在一个生成CO的副反应,结合反应:
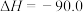 kJ·mol
kJ·mol ,写出该副反应的热化学方程式:
,写出该副反应的热化学方程式:____ 。
(2)为同时提高 的平衡转化率和
的平衡转化率和 的平衡产率,反应条件应选择
的平衡产率,反应条件应选择____ 。
将 和
和 按物质的量比1∶3混合,以固定流速通过盛放Cu/Zn/Al/Zr催化剂的反应器,在相同时间内,不同温度下的实验数据如图所示。
按物质的量比1∶3混合,以固定流速通过盛放Cu/Zn/Al/Zr催化剂的反应器,在相同时间内,不同温度下的实验数据如图所示。
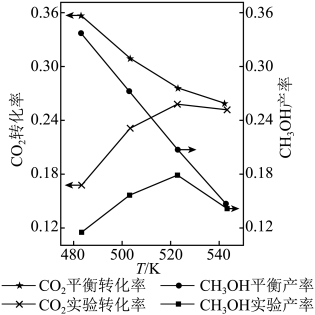
(3)①催化剂活性最好的温度为_____ (填字母序号)。
a.483K b.503K c.523K d.543K
②温度由483K升到523K,_____ (填“主反应”或“副反应”)的反应速率受温度影响更大。
③温度由523K升到543K, 的平衡转化率和
的平衡转化率和 的实验产率均降低,解释原因:
的实验产率均降低,解释原因:_____ 。
④如图,a点对应的坐标为(523K,0.26),b点对应的坐标为(523K,0.18),在523K温度下,b点对应的 的百分含量为
的百分含量为_____ 。
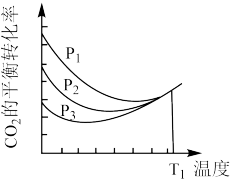
(4)不同压强下,按照 投料,
投料, 平衡转化率随温度变化关系如图所示。
平衡转化率随温度变化关系如图所示。 时曲线出现拐点的温度高于
时曲线出现拐点的温度高于 时的原因是
时的原因是_____ 。
已知:
 产率
产率
(1)制备甲醇的主反应:

 kJ·mol
kJ·mol 。该过程中还存在一个生成CO的副反应,结合反应:
。该过程中还存在一个生成CO的副反应,结合反应:
 kJ·mol
kJ·mol ,写出该副反应的热化学方程式:
,写出该副反应的热化学方程式:(2)为同时提高
 的平衡转化率和
的平衡转化率和 的平衡产率,反应条件应选择
的平衡产率,反应条件应选择将
 和
和 按物质的量比1∶3混合,以固定流速通过盛放Cu/Zn/Al/Zr催化剂的反应器,在相同时间内,不同温度下的实验数据如图所示。
按物质的量比1∶3混合,以固定流速通过盛放Cu/Zn/Al/Zr催化剂的反应器,在相同时间内,不同温度下的实验数据如图所示。
(3)①催化剂活性最好的温度为
a.483K b.503K c.523K d.543K
②温度由483K升到523K,
③温度由523K升到543K,
 的平衡转化率和
的平衡转化率和 的实验产率均降低,解释原因:
的实验产率均降低,解释原因:④如图,a点对应的坐标为(523K,0.26),b点对应的坐标为(523K,0.18),在523K温度下,b点对应的
 的百分含量为
的百分含量为(4)不同压强下,按照
 投料,
投料, 平衡转化率随温度变化关系如图所示。
平衡转化率随温度变化关系如图所示。 时曲线出现拐点的温度高于
时曲线出现拐点的温度高于 时的原因是
时的原因是
您最近一年使用:0次
名校
10 . CH4—CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4—CO2催化重整反应为 。
。
已知: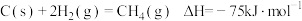
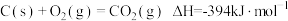
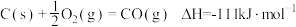
①该催化重整反应的
___________  ,有利于提高CH4平衡转化率的条件是
,有利于提高CH4平衡转化率的条件是___________ (填标号)。
A.高温低压 B低温高压 C.高温高压 D.低温低压
②某温度下,在体积为2L的容器中加入2molCH4、1molCO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为___________ 。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
①由上表判断,催化剂X___________ Y(填“优于”或“劣于”),理由是___________ 。
②在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如下图所示,升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是___________ (填标号)。
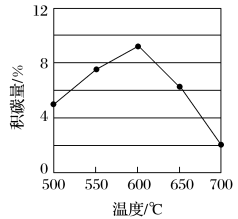
A.K积、K消均增加 B.v积减小、v消增加
C.K积减小、K消增加 D.v消增加的倍数比v积增加的倍数大
(1)CH4—CO2催化重整反应为
 。
。已知:
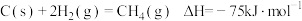
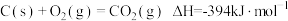
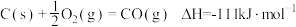
①该催化重整反应的

 ,有利于提高CH4平衡转化率的条件是
,有利于提高CH4平衡转化率的条件是A.高温低压 B低温高压 C.高温高压 D.低温低压
②某温度下,在体积为2L的容器中加入2molCH4、1molCO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
积碳反应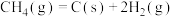 | 消碳反应 | ||
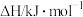 | 75 | 172 | |
| 活化能/kJ·mol﹣1 | 催化剂X | 33 | 91 |
| 催化剂Y | 43 | 72 | |
②在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如下图所示,升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是

A.K积、K消均增加 B.v积减小、v消增加
C.K积减小、K消增加 D.v消增加的倍数比v积增加的倍数大
您最近一年使用:0次



