名校
1 . 尿素[CO(NH2)2]的生产具有重要意义。
(1)尿素的催化合成
已知:2H2(g)+O2(g)=2H2O(l) ΔH1=-286.0 kJ·mol-1
N2(g)+3H2(g)=2NH3(g) ΔH2=-92.2 kJ·mol-1
2NH3(g)+CO2(g)=CO(NH2)2(aq)+H2O(l) ΔH3=-101.5 kJ·mol-1
则反应2CO2+2N2+4H2O=2CO(NH2)2+3O2的 ΔH=___________ kJ·mol-1
(2)尿素的电化学合成
①电催化CO2和 合成尿素的装置如下图所示,生成尿素的电极反应式为
合成尿素的装置如下图所示,生成尿素的电极反应式为___________ 。
已知:CO2在阴极还能被还原为CH4,其生成CH4的趋势比生成CO的趋势更大。但实验数据说明,一定时间内,阴极产物中CO的物质的量大于CH4,可能的原因为___________ 。
(3)尿素的应用
尿素将烟气中氮氧化物还原为N2以达到消除污染的目的。控制其他条件相同,将混有NO、NO2、SO2、N2和O2的模拟烟气匀速通过装有尿素溶液的装置,在装置出口处检测NO、NO2的脱除率α(α= ×100%)。
×100%)。
①当烟气中有少量SO2时,有利于NO2脱除,其可能的原因是___________ 。
②当烟气中无SO2存在时,且 超过一定数值时,测得α(NO)变为负值,其可能的原因是
超过一定数值时,测得α(NO)变为负值,其可能的原因是___________ 。
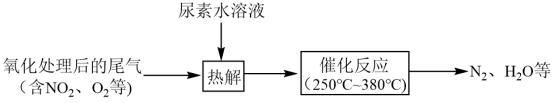
③尿素水溶液热解产生的NH3可去除尾气中的NOx,流程如下:___________ 。
(1)尿素的催化合成
已知:2H2(g)+O2(g)=2H2O(l) ΔH1=-286.0 kJ·mol-1
N2(g)+3H2(g)=2NH3(g) ΔH2=-92.2 kJ·mol-1
2NH3(g)+CO2(g)=CO(NH2)2(aq)+H2O(l) ΔH3=-101.5 kJ·mol-1
则反应2CO2+2N2+4H2O=2CO(NH2)2+3O2的 ΔH=
(2)尿素的电化学合成
①电催化CO2和
 合成尿素的装置如下图所示,生成尿素的电极反应式为
合成尿素的装置如下图所示,生成尿素的电极反应式为
已知:CO2在阴极还能被还原为CH4,其生成CH4的趋势比生成CO的趋势更大。但实验数据说明,一定时间内,阴极产物中CO的物质的量大于CH4,可能的原因为
(3)尿素的应用
尿素将烟气中氮氧化物还原为N2以达到消除污染的目的。控制其他条件相同,将混有NO、NO2、SO2、N2和O2的模拟烟气匀速通过装有尿素溶液的装置,在装置出口处检测NO、NO2的脱除率α(α=
 ×100%)。
×100%)。①当烟气中有少量SO2时,有利于NO2脱除,其可能的原因是
②当烟气中无SO2存在时,且
 超过一定数值时,测得α(NO)变为负值,其可能的原因是
超过一定数值时,测得α(NO)变为负值,其可能的原因是③尿素水溶液热解产生的NH3可去除尾气中的NOx,流程如下:
您最近半年使用:0次
名校
解题方法
2 . 乙烯作为现代有机合成的重要原料,研究其制备方法具有重要的意义。
回答下列问题:
I.乙烷制备乙烯
(1)某温度、 下,向反应器中充入
下,向反应器中充入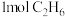 只发生反应
只发生反应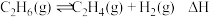 ,
, 的平衡转化率为
的平衡转化率为 ;保持温度和压强不变,向反应器中再充入水蒸气,
;保持温度和压强不变,向反应器中再充入水蒸气, 后达到平衡,此时
后达到平衡,此时 的平衡转化率为
的平衡转化率为 ,需要向反应器中充入
,需要向反应器中充入___________  水蒸气;用压强变化表示的
水蒸气;用压强变化表示的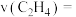
___________  ;此时该反应的
;此时该反应的
___________ ( 指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压
指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压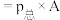 的物质的量分数)。
的物质的量分数)。
(2) 为一种选择性交换膜,其结构如图所示,其中第二周期组成元素的第二电离能与第一电离能差值最大的是
为一种选择性交换膜,其结构如图所示,其中第二周期组成元素的第二电离能与第一电离能差值最大的是___________ (填元素符号),结构中1处 的键角
的键角___________ (填“大于”“小于”或“等于”)2处 的键角。
的键角。
在催化剂作用下,二氧化碳可制取乙烯,发生以下反应:
①
②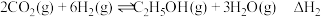
③
(3)
___________  。
。
(4)若将 和
和 按物质的量之比
按物质的量之比 混合,在
混合,在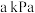 恒压反应器中连续反应,测得
恒压反应器中连续反应,测得 的转化率与
的转化率与 、
、 的选择性随温度变化如图所示。
的选择性随温度变化如图所示。 的转化率曲线是
的转化率曲线是___________ (填“X”“Y”或“Z”,下同), 的选择性曲线是
的选择性曲线是___________ ,说明判断依据:___________ 。
回答下列问题:
I.乙烷制备乙烯
(1)某温度、
 下,向反应器中充入
下,向反应器中充入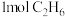 只发生反应
只发生反应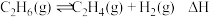 ,
, 的平衡转化率为
的平衡转化率为 ;保持温度和压强不变,向反应器中再充入水蒸气,
;保持温度和压强不变,向反应器中再充入水蒸气, 后达到平衡,此时
后达到平衡,此时 的平衡转化率为
的平衡转化率为 ,需要向反应器中充入
,需要向反应器中充入 水蒸气;用压强变化表示的
水蒸气;用压强变化表示的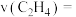
 ;此时该反应的
;此时该反应的
 指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压
指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压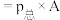 的物质的量分数)。
的物质的量分数)。(2)
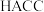 为一种选择性交换膜,其结构如图所示,其中第二周期组成元素的第二电离能与第一电离能差值最大的是
为一种选择性交换膜,其结构如图所示,其中第二周期组成元素的第二电离能与第一电离能差值最大的是 的键角
的键角 的键角。
的键角。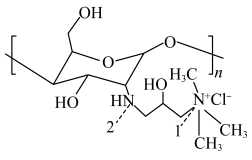
在催化剂作用下,二氧化碳可制取乙烯,发生以下反应:
①

②
③

(3)

 。
。(4)若将
 和
和 按物质的量之比
按物质的量之比 混合,在
混合,在 恒压反应器中连续反应,测得
恒压反应器中连续反应,测得 的转化率与
的转化率与 、
、 的选择性随温度变化如图所示。
的选择性随温度变化如图所示。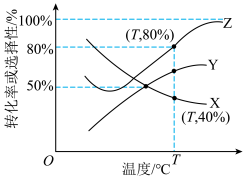
 的转化率曲线是
的转化率曲线是 的选择性曲线是
的选择性曲线是
您最近半年使用:0次
3 . 应对雾霾污染、改善空气质量需要从多方面入手,如开发利用清洁能源。甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景。
(1)已知反应:①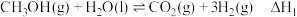
 ;
;
②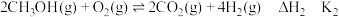 。
。
则③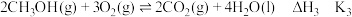 中的
中的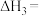
_______ (用含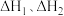 的式子表示),
的式子表示),
_______ (用含 的式子表示),该反应中每消耗
的式子表示),该反应中每消耗 ,此时转移的电子数为
,此时转移的电子数为_______  。
。
(2)一定条件下用 和
和 合成
合成 。在
。在 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,在催化剂作用下充分反应,平衡时混合物中
,在催化剂作用下充分反应,平衡时混合物中 的体积分数随温度变化的曲线如图所示:
的体积分数随温度变化的曲线如图所示: 的说法正确的是
的说法正确的是_______ (填标号)。
A.该反应的反应物的键能总和小于生成物的键能总和
B.当混合气体的密度不再随时间改变时,该反应达到平衡
C.升高温度,有利于增大 的平衡转化率
的平衡转化率
D.无论反应进行到何种程度, 为某一定值
为某一定值
②平衡常数 由大到小的顺序为
由大到小的顺序为_______ 。
③反应速率: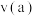
_______ (填“>”“<”或“=”)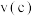 。
。
④ ,b点的平衡常数
,b点的平衡常数
_______ 。
(1)已知反应:①
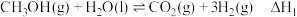
 ;
;②
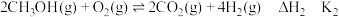 。
。则③
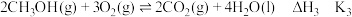 中的
中的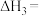
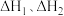 的式子表示),
的式子表示),
 的式子表示),该反应中每消耗
的式子表示),该反应中每消耗 ,此时转移的电子数为
,此时转移的电子数为 。
。(2)一定条件下用
 和
和 合成
合成 。在
。在 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,在催化剂作用下充分反应,平衡时混合物中
,在催化剂作用下充分反应,平衡时混合物中 的体积分数随温度变化的曲线如图所示:
的体积分数随温度变化的曲线如图所示:
 的说法正确的是
的说法正确的是A.该反应的反应物的键能总和小于生成物的键能总和
B.当混合气体的密度不再随时间改变时,该反应达到平衡
C.升高温度,有利于增大
 的平衡转化率
的平衡转化率D.无论反应进行到何种程度,
 为某一定值
为某一定值②平衡常数
 由大到小的顺序为
由大到小的顺序为③反应速率:
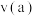
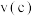 。
。④
 ,b点的平衡常数
,b点的平衡常数
您最近半年使用:0次
解题方法
4 . 积极发展清洁能源,推动经济社会绿色低碳转型,已经成为国际社会应对全球气候变化的普遍共识。已知:
①某些常见化学键的键能(指常温常压下,气态分子中 化学键解离成气态原子所吸收的能量)数据如下:
化学键解离成气态原子所吸收的能量)数据如下:
②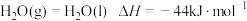 ;
;
③在 和
和 下,
下, 的燃烧热
的燃烧热 。
。
(1)氢能是理想的绿色能源。已知 。
。
①断开1molH—〇需要吸收___________  能量。
能量。
②与天然气相比,氢能的优点是___________ (任写1点)。
(2)CH3OH是一种重要的清洁燃料, 在
在 和
和 下完全燃烧生成
下完全燃烧生成 和
和 时,放出
时,放出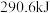 热量。
热量。
①表示 (1)燃烧热的热化学方程式为
(1)燃烧热的热化学方程式为___________ ,该反应中反应物的总键能___________ (填“大于”“小于”或“等于”)生成物的总键能。
②由 催化加氢可制备
催化加氢可制备 ,则
,则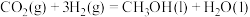

___________  ,若生成气态水,则
,若生成气态水,则
___________ (填“大于”“小于”或“等于”)该计算值。
(3)在 和
和 下,
下, 和
和 的混合气体
的混合气体 完全燃烧生成
完全燃烧生成 和
和 时,放出
时,放出 热量,则该混合气体中
热量,则该混合气体中 的物质的量分数为
的物质的量分数为___________  。
。
①某些常见化学键的键能(指常温常压下,气态分子中
 化学键解离成气态原子所吸收的能量)数据如下:
化学键解离成气态原子所吸收的能量)数据如下:| 化学键 |  |  |
键能 | 436 | 496 |
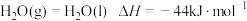 ;
;③在
 和
和 下,
下, 的燃烧热
的燃烧热 。
。(1)氢能是理想的绿色能源。已知
 。
。①断开1molH—〇需要吸收
 能量。
能量。②与天然气相比,氢能的优点是
(2)CH3OH是一种重要的清洁燃料,
 在
在 和
和 下完全燃烧生成
下完全燃烧生成 和
和 时,放出
时,放出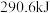 热量。
热量。①表示
 (1)燃烧热的热化学方程式为
(1)燃烧热的热化学方程式为②由
 催化加氢可制备
催化加氢可制备 ,则
,则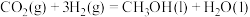

 ,若生成气态水,则
,若生成气态水,则
(3)在
 和
和 下,
下, 和
和 的混合气体
的混合气体 完全燃烧生成
完全燃烧生成 和
和 时,放出
时,放出 热量,则该混合气体中
热量,则该混合气体中 的物质的量分数为
的物质的量分数为 。
。
您最近半年使用:0次
5 . 研究含氮化合物对消除环境污染,能源结构的改变,食品添加剂的研究等有重要意义。
(1)甘氨酸锌常用于食品的添加剂,也可代替甘油作烟丝的加香、防冻。一水合甘氨酸锌结构简式如图所示。___________ 。
②N、O、C、Zn元素的第一电离能由大到小的顺序为___________ 。
(2)“中国制造2025”是中国政府实施制造强国战略第一个十年行动领。氮化铬在现代工业中发挥了重要作用。
①基态N原子的价层电子排布图为___________ 。
②基态Cr原子的价层电子排布式为___________ 。
(3)NO在空气中存在如下反应: ,该反应分两步完成,其反应历程如图所示。决定总反应速率的这一步反应的热化学方程式为
,该反应分两步完成,其反应历程如图所示。决定总反应速率的这一步反应的热化学方程式为___________ 。 、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。发生以下反应:
、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。发生以下反应:
I.

Ⅱ.

若CO的燃烧热为283.5kJ/mol,则反应I的
___________ kJ/mol。
(5)室温下,用氨水将 转化为
转化为 ,实验测得
,实验测得 溶液中
溶液中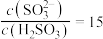 ,则溶液的pH为
,则溶液的pH为___________ 。(已知: 的
的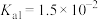 ,
,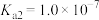 )
)
(6)若T℃时,pH=2的醋酸溶液中由水电离出的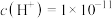 ,将此温度下
,将此温度下 的HCl溶液与
的HCl溶液与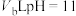 的NaOH溶液混合后pH=3,则
的NaOH溶液混合后pH=3,则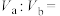
___________ 。
(1)甘氨酸锌常用于食品的添加剂,也可代替甘油作烟丝的加香、防冻。一水合甘氨酸锌结构简式如图所示。
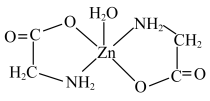
②N、O、C、Zn元素的第一电离能由大到小的顺序为
(2)“中国制造2025”是中国政府实施制造强国战略第一个十年行动领。氮化铬在现代工业中发挥了重要作用。
①基态N原子的价层电子排布图为
②基态Cr原子的价层电子排布式为
(3)NO在空气中存在如下反应:
 ,该反应分两步完成,其反应历程如图所示。决定总反应速率的这一步反应的热化学方程式为
,该反应分两步完成,其反应历程如图所示。决定总反应速率的这一步反应的热化学方程式为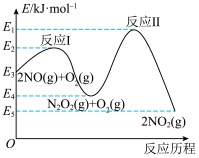
 、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。发生以下反应:
、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。发生以下反应:I.


Ⅱ.


若CO的燃烧热为283.5kJ/mol,则反应I的

(5)室温下,用氨水将
 转化为
转化为 ,实验测得
,实验测得 溶液中
溶液中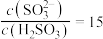 ,则溶液的pH为
,则溶液的pH为 的
的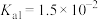 ,
,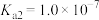 )
)(6)若T℃时,pH=2的醋酸溶液中由水电离出的
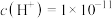 ,将此温度下
,将此温度下 的HCl溶液与
的HCl溶液与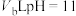 的NaOH溶液混合后pH=3,则
的NaOH溶液混合后pH=3,则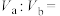
您最近半年使用:0次
名校
6 . 甲基叔戊基醚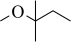 (TAME,简写为T)常用作汽油添加剂。在催化剂作用下,通过甲醇
(TAME,简写为T)常用作汽油添加剂。在催化剂作用下,通过甲醇 (简写为M)与2-甲基-2-丁烯(简写为A)的液相反应制得。通过控制条件,体系中主要发生如下反应(B为2-甲基-1-丁烯的简写,不考虑其他副反应):
(简写为M)与2-甲基-2-丁烯(简写为A)的液相反应制得。通过控制条件,体系中主要发生如下反应(B为2-甲基-1-丁烯的简写,不考虑其他副反应):


反应ⅱ:
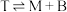

反应ⅲ:

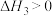
(1)磷钼酸(
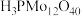 )可作为制备TAME反应催化剂的浸渍试剂。已知钼元素位于第五周期第ⅥB族,核外电子排布与Cr相似。基态钼原子的价层电子排布式为
)可作为制备TAME反应催化剂的浸渍试剂。已知钼元素位于第五周期第ⅥB族,核外电子排布与Cr相似。基态钼原子的价层电子排布式为(2)比较

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(3)我国学者团队对制备TAME反应的催化剂进行了研究。研究表明:用不同浓度(1~3%)的磷钼酸浸渍催化剂,浓度越大催化剂催化活性越好。用浓度分别为1%、2%、3%的磷钼酸浸渍催化剂进行了三组实验,得到
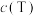 随时间的变化曲线如图所示。
随时间的变化曲线如图所示。
②下列说法正确的有
A.三组实验中,反应速率都随反应进程一直增大
B.平衡后加入惰性溶剂四氢呋喃稀释,
 减小
减小C.催化剂可加快化学反应速率,提高甲醇的平衡转化率
D.降低温度,反应ⅰ和ⅱ的正、逆反应速率都减小
E.达到平衡后,加入M,
 不变
不变(4)研究团队继续研究其他条件不变时,不同醇烯比
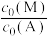 (甲醇M与烯烃A的起始物质的量浓度之比)对平衡的影响,当A起始浓度
(甲醇M与烯烃A的起始物质的量浓度之比)对平衡的影响,当A起始浓度 时,测得平衡时B和T的
时,测得平衡时B和T的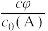 随
随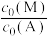 的变化曲线如图。
的变化曲线如图。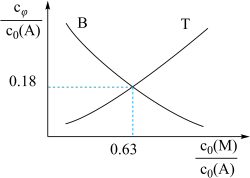
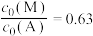 时,计算反应i的平衡常数
时,计算反应i的平衡常数
您最近半年使用:0次
7 . 随着“碳达峰”、“碳中和”战略的提出,大气中 含量的控制和回收利用已成为当今化学研究的主题,其过程包括
含量的控制和回收利用已成为当今化学研究的主题,其过程包括 的富集、
的富集、 的合成气
的合成气 化、
化、 的甲醇
的甲醇 化、
化、 的甲烷化等。回答下列问题:
的甲烷化等。回答下列问题:
(1) 的富集:
的富集: 含量较高的空气叫富碳空气,捕集其中的
含量较高的空气叫富碳空气,捕集其中的 可通过如下途径实现。
可通过如下途径实现。___________ (用文字叙述)。
(2) 的合成气化:反应原理为
的合成气化:反应原理为
 。已知有关反应的热化学方程式:
。已知有关反应的热化学方程式:
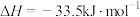 ,
,
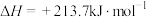 。
。
①
___________  。
。
②利于该反应自发进行的条件为___________ (填“高温”“低温”或“任意条件”)。
(3) 的甲醇化:利用光解海水产生的
的甲醇化:利用光解海水产生的 将
将 转化为甲醇
转化为甲醇
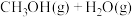
 ],其转化过程如图1所示。
],其转化过程如图1所示。___________ 。
②一定温度下,向体积为 的密闭容器中充入
的密闭容器中充入 和
和 ,发生反应
,发生反应 后到达平衡,此时
后到达平衡,此时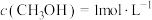 。前
。前 内,
内,
___________  ,该温度下反应的平衡常数
,该温度下反应的平衡常数
___________ (用分数表示)。
③一定温度下,在一个固定体积的密闭容器中仅发生反应ii,下列不能说明反应达到平衡状态的是___________ (填字母)。
A.容器内气体的压强不变
B.容器内混合气体的总物质的量不变
C. 和
和 物质的量之比不变
物质的量之比不变
D.单位时间内,每有 键断裂,同时有
键断裂,同时有 键形成
键形成
(4) 的甲烷化:科学家利用吸收
的甲烷化:科学家利用吸收 后的纯碱水溶液
后的纯碱水溶液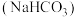 ,通过电解转化为
,通过电解转化为 及
及 及
及 的产率随电解电压变化曲线如图2所示。
的产率随电解电压变化曲线如图2所示。 转化为
转化为 的电极反应式为
的电极反应式为___________ 。
②工业生产上常采用较高电压,其目的为___________ 。
 含量的控制和回收利用已成为当今化学研究的主题,其过程包括
含量的控制和回收利用已成为当今化学研究的主题,其过程包括 的富集、
的富集、 的合成气
的合成气 化、
化、 的甲醇
的甲醇 化、
化、 的甲烷化等。回答下列问题:
的甲烷化等。回答下列问题:(1)
 的富集:
的富集: 含量较高的空气叫富碳空气,捕集其中的
含量较高的空气叫富碳空气,捕集其中的 可通过如下途径实现。
可通过如下途径实现。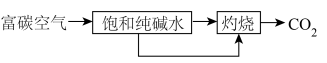
(2)
 的合成气化:反应原理为
的合成气化:反应原理为
 。已知有关反应的热化学方程式:
。已知有关反应的热化学方程式:
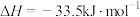 ,
,
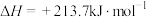 。
。①

 。
。②利于该反应自发进行的条件为
(3)
 的甲醇化:利用光解海水产生的
的甲醇化:利用光解海水产生的 将
将 转化为甲醇
转化为甲醇
 ],其转化过程如图1所示。
],其转化过程如图1所示。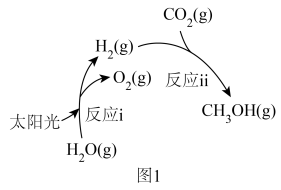
②一定温度下,向体积为
 的密闭容器中充入
的密闭容器中充入 和
和 ,发生反应
,发生反应 后到达平衡,此时
后到达平衡,此时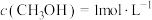 。前
。前 内,
内,
 ,该温度下反应的平衡常数
,该温度下反应的平衡常数
③一定温度下,在一个固定体积的密闭容器中仅发生反应ii,下列不能说明反应达到平衡状态的是
A.容器内气体的压强不变
B.容器内混合气体的总物质的量不变
C.
 和
和 物质的量之比不变
物质的量之比不变D.单位时间内,每有
 键断裂,同时有
键断裂,同时有 键形成
键形成(4)
 的甲烷化:科学家利用吸收
的甲烷化:科学家利用吸收 后的纯碱水溶液
后的纯碱水溶液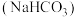 ,通过电解转化为
,通过电解转化为 及
及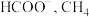 及
及 的产率随电解电压变化曲线如图2所示。
的产率随电解电压变化曲线如图2所示。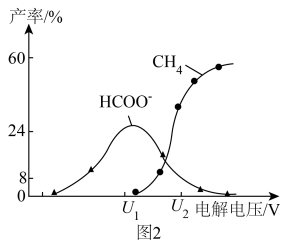
 转化为
转化为 的电极反应式为
的电极反应式为②工业生产上常采用较高电压,其目的为
您最近半年使用:0次
解题方法
8 . 硫、氮和磷是生物必须的营养元素,含硫、氮和磷的化合物在自然界中广泛存在。
(1)火山喷发产生H2S在大气中发生如下反应:
①
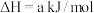
②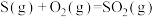
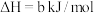
写出H2S(g)完全燃烧的热化学方程式_______ 。
(2)工业上可用NaClO碱性溶液吸收SO2.为了提高吸收效率,常用Ni2O3作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如下图所示。Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是_______ 。_______ ;
②若无能量损失,相同条件下,SO2和NO的体积比为_______ 时,两种气体都能被完全处理。
(4)某含磷废水的主要成分是H3PO3.25℃时,向一定体积的亚磷酸(H3PO3,二元弱酸)溶液中滴加等物质的量浓度的NaOH溶液,混合液中含磷粒子的物质的量分数( )与溶液pH的关系如下图所示。
)与溶液pH的关系如下图所示。_______ 7(填“<”或“>”或“=”)。
②Na2HPO3其水解平衡常数
_______ (填数值)。
(5)太阳能光电催化——化学耦合分解H2S的装置如图所示。该太阳能光电催化——化学耦合分解H2S的过程可描述为_______ 。
(1)火山喷发产生H2S在大气中发生如下反应:
①

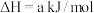
②
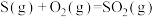
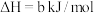
写出H2S(g)完全燃烧的热化学方程式
(2)工业上可用NaClO碱性溶液吸收SO2.为了提高吸收效率,常用Ni2O3作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如下图所示。Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是


②若无能量损失,相同条件下,SO2和NO的体积比为
(4)某含磷废水的主要成分是H3PO3.25℃时,向一定体积的亚磷酸(H3PO3,二元弱酸)溶液中滴加等物质的量浓度的NaOH溶液,混合液中含磷粒子的物质的量分数(
 )与溶液pH的关系如下图所示。
)与溶液pH的关系如下图所示。
②Na2HPO3其水解平衡常数

(5)太阳能光电催化——化学耦合分解H2S的装置如图所示。该太阳能光电催化——化学耦合分解H2S的过程可描述为
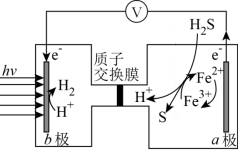
您最近半年使用:0次
解题方法
9 . 在催化剂的作用下,利用合成气(主要成分为CO、 和
和 )合成甲醇时涉及了如下反应:
)合成甲醇时涉及了如下反应:
反应Ⅰ.
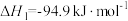
反应Ⅱ.
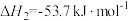
反应Ⅲ.
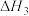
回答下列问题:
(1)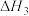 =
=______  。
。
某温度下,盛有1mol CO的密闭容器通入 发生反应Ⅰ,测得平衡时
发生反应Ⅰ,测得平衡时 (g)的体积分数变化如图所示。
(g)的体积分数变化如图所示。 转化率最大的是
转化率最大的是_______ (填字母)。
(3)图中,n=______ mol,此时CO的转化率为50%,反应体系总压为pPa,则该温度下反应Ⅰ的平衡常数Kp=____ Pa-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
一定条件下,某密闭容器中投入1mol 和3mol
和3mol 发生反应Ⅱ和Ⅲ。
发生反应Ⅱ和Ⅲ。
(4)升高反应体系温度,合成甲醇的反应速率______ (填“增大”“减小”或“不变”)。
(5)加入少量CO,平衡时甲醇的量____ (填“增多”“减少”或“不变”)。
(6)达到平衡后,缩小容器体积,反应Ⅲ的平衡______ (填“正向”“逆向”或“不”)移动。
改变温度和投气比[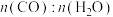 ]发生反应:
]发生反应: ,测得CO平衡转化率如表所示(其他反应条件相同)。
,测得CO平衡转化率如表所示(其他反应条件相同)。
(7)a、b、c三点对应的反应温度由高到低顺序是_____ 。
研究表明,反应 的速率方程为
的速率方程为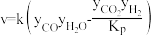 ,式中yCO、yH2O、yCO2、yH2分别表示相应的物质的量分数,Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。
,式中yCO、yH2O、yCO2、yH2分别表示相应的物质的量分数,Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。 时v逐渐减小的原因是
时v逐渐减小的原因是________ 。
 和
和 )合成甲醇时涉及了如下反应:
)合成甲醇时涉及了如下反应:反应Ⅰ.

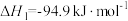
反应Ⅱ.

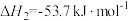
反应Ⅲ.

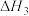
回答下列问题:
(1)
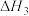 =
= 。
。某温度下,盛有1mol CO的密闭容器通入
 发生反应Ⅰ,测得平衡时
发生反应Ⅰ,测得平衡时 (g)的体积分数变化如图所示。
(g)的体积分数变化如图所示。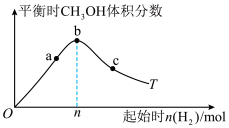
 转化率最大的是
转化率最大的是(3)图中,n=
一定条件下,某密闭容器中投入1mol
 和3mol
和3mol 发生反应Ⅱ和Ⅲ。
发生反应Ⅱ和Ⅲ。(4)升高反应体系温度,合成甲醇的反应速率
(5)加入少量CO,平衡时甲醇的量
(6)达到平衡后,缩小容器体积,反应Ⅲ的平衡
改变温度和投气比[
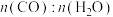 ]发生反应:
]发生反应: ,测得CO平衡转化率如表所示(其他反应条件相同)。
,测得CO平衡转化率如表所示(其他反应条件相同)。| 平衡点 | a | b | c |
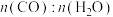 | 0.5 | 0.5 | 1 |
| CO平衡转化率 | 50 | 33.3 | 50 |
(7)a、b、c三点对应的反应温度由高到低顺序是
研究表明,反应
 的速率方程为
的速率方程为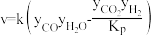 ,式中yCO、yH2O、yCO2、yH2分别表示相应的物质的量分数,Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。
,式中yCO、yH2O、yCO2、yH2分别表示相应的物质的量分数,Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。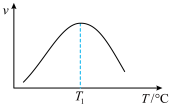
 时v逐渐减小的原因是
时v逐渐减小的原因是
您最近半年使用:0次
名校
解题方法
10 . 尿素作为主要的化肥种类之一,也是一种重要的化工原料。合成尿素的反应为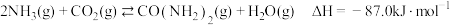 。
。
(1) 时,将一定量
时,将一定量 与
与 在恒温恒容密闭容器中发生上述反应,下列不能说明该反应达到平衡状态的是
在恒温恒容密闭容器中发生上述反应,下列不能说明该反应达到平衡状态的是___________ (填标号)。
A.反应体系中气体分子的平均摩尔质量保持不变
B.反应体系中气体的密度保持不变
C.反应消耗 同时生成
同时生成
D.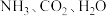 三种气体的物质的量之比为
三种气体的物质的量之比为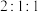
E. 的质量保持不变
的质量保持不变
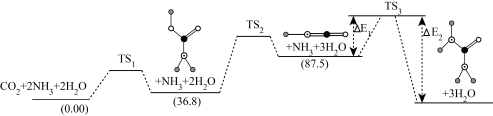
(2)如图是上述反应合成尿素的机理及能量变化(单位: ),
), 表示过渡态。
表示过渡态。
①尿素分子中C原子的杂化方式为___________ 。
②该反应历程中,起决速步骤的方程式为___________ 。
若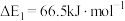 ,则
,则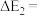
___________  。
。 ,在液相中,
,在液相中, 的平衡转化率与温度,初始氨碳比[用L表示,
的平衡转化率与温度,初始氨碳比[用L表示, ]、初始水碳比[用W表示,
]、初始水碳比[用W表示, ]关系如图所示。
]关系如图所示。 中,
中,___________ (填“A”或“B”)的W较小,判断依据是___________ 。
②对于液相反应,常用某组分M达到平衡时的物质的量分数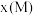 代替平衡浓度来计算平衡常数(记作
代替平衡浓度来计算平衡常数(记作 )。
)。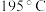 时,
时,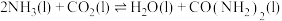 的
的 的值为
的值为___________ 。
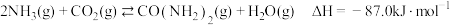 。
。(1)
 时,将一定量
时,将一定量 与
与 在恒温恒容密闭容器中发生上述反应,下列不能说明该反应达到平衡状态的是
在恒温恒容密闭容器中发生上述反应,下列不能说明该反应达到平衡状态的是A.反应体系中气体分子的平均摩尔质量保持不变
B.反应体系中气体的密度保持不变
C.反应消耗
 同时生成
同时生成
D.
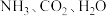 三种气体的物质的量之比为
三种气体的物质的量之比为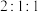
E.
 的质量保持不变
的质量保持不变(2)如图是上述反应合成尿素的机理及能量变化(单位:
 ),
), 表示过渡态。
表示过渡态。①尿素分子中C原子的杂化方式为
②该反应历程中,起决速步骤的方程式为
若
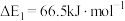 ,则
,则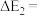
 。
。
 ,在液相中,
,在液相中, 的平衡转化率与温度,初始氨碳比[用L表示,
的平衡转化率与温度,初始氨碳比[用L表示, ]、初始水碳比[用W表示,
]、初始水碳比[用W表示, ]关系如图所示。
]关系如图所示。
 中,
中,②对于液相反应,常用某组分M达到平衡时的物质的量分数
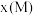 代替平衡浓度来计算平衡常数(记作
代替平衡浓度来计算平衡常数(记作 )。
)。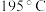 时,
时,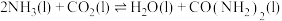 的
的 的值为
的值为
您最近半年使用:0次



