解题方法
1 . 以 、
、 为原料合成
为原料合成 可有效降低空气中二氧化碳的含量,其中涉及的主要反应如下:
可有效降低空气中二氧化碳的含量,其中涉及的主要反应如下:
Ⅰ.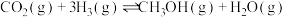

Ⅱ.
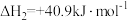
回答下列问题:
(1)已知
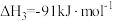 ;则
;则
___________ 
(2)某小组在温度为T℃下,将1mol 和3mol
和3mol 充入容积为5L的恒容密闭容器中。同时发生反应Ⅰ和反应Ⅱ,体系中各组分分压(各组分分压=总压×各组分物质的量分数)随时间的变化情况如图所示。
充入容积为5L的恒容密闭容器中。同时发生反应Ⅰ和反应Ⅱ,体系中各组分分压(各组分分压=总压×各组分物质的量分数)随时间的变化情况如图所示。
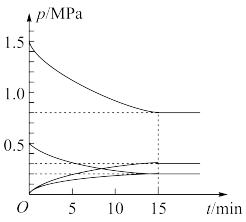
①图中缺少了一种组分的分压变化,该组分是___________ (填化学式),该组分平衡时的分压为___________ MPa。
②0~15min内,反应Ⅰ的反应速率
___________  ;达到平衡后,
;达到平衡后,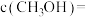
___________  。
。
③反应开始时,容器的总压为___________ MPa,T℃时,反应Ⅱ的平衡常数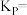
___________ (用分压代替浓度)。
 、
、 为原料合成
为原料合成 可有效降低空气中二氧化碳的含量,其中涉及的主要反应如下:
可有效降低空气中二氧化碳的含量,其中涉及的主要反应如下:Ⅰ.
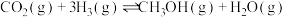

Ⅱ.

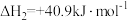
回答下列问题:
(1)已知

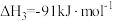 ;则
;则

(2)某小组在温度为T℃下,将1mol
 和3mol
和3mol 充入容积为5L的恒容密闭容器中。同时发生反应Ⅰ和反应Ⅱ,体系中各组分分压(各组分分压=总压×各组分物质的量分数)随时间的变化情况如图所示。
充入容积为5L的恒容密闭容器中。同时发生反应Ⅰ和反应Ⅱ,体系中各组分分压(各组分分压=总压×各组分物质的量分数)随时间的变化情况如图所示。
①图中缺少了一种组分的分压变化,该组分是
②0~15min内,反应Ⅰ的反应速率

 ;达到平衡后,
;达到平衡后,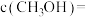
 。
。③反应开始时,容器的总压为
您最近一年使用:0次
2022-02-12更新
|
300次组卷
|
2卷引用:福建省闽粤名校联盟2021-2022学年高三下学期2月联考化学试题
解题方法
2 . “一碳化学”是指以含一个碳原子的化合物(如CO2、CO、CH4、CH3OH等)为初始反应物,合成一系列重要的化工原料和燃料的化学。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g) NH2COONH4(s) ∆H1
NH2COONH4(s) ∆H1
反应II:NH2COONH4(s) CO(NH2)2(s)+H2O(g) ∆H2=+72.49kJ/mol
CO(NH2)2(s)+H2O(g) ∆H2=+72.49kJ/mol
总反应:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ∆H3=-86.98kJ/mol
CO(NH2)2(s)+H2O(g) ∆H3=-86.98kJ/mol
请回答下列问题:
①反应I的∆H1=__ kJ/mol。
②反应II一般在__ (填“高温或“低温")条件下有利于该反应的进行。
③一定温度下,在体积固定的密闭容器中按计量比投料进行反应I,下列能说明反应达到了平衡状态的是__ (填字母序号)。
A.混合气体的平均相对分子质量不再变化
B.容器内气体总压强不再变化
C.2v正(NH3)=v逆(CO2)
D.容器内混合气体的密度不再变化
(2)将CO2和H2按物质的量之比为1:3充入一定体积的密闭容器中,发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ∆H。测得CH3OH的物质的量在不同温度下随时间的变化关系如图所示。

①根据图示判断∆H__ 0(填“>”或“<”)。
②一定温度下,在容积均为2L的两个密闭容器中,按如下方式加入反应物,10min后达到平衡。
若甲容器平衡后气体的压强为开始时的0.8倍,则反应10min内甲容器中以CH3OH(g)表示的化学反应速率为__ ,此温度下的化学平衡常数为__ (保留两位小数);要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为__ 。
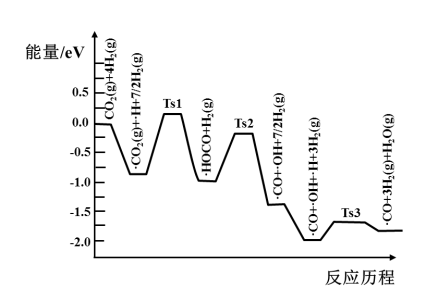
(3)氢气可将CO2还原为甲烷,反应为CO2(g)+4H2(g) CH4(g)+2H2O(g)。ShyamKattel等结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示其中吸附在Pt/SiO2催化剂表面用“·”标注,Ts表示过渡态。物质吸附在催化剂表面,形成过渡态的过程会
CH4(g)+2H2O(g)。ShyamKattel等结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示其中吸附在Pt/SiO2催化剂表面用“·”标注,Ts表示过渡态。物质吸附在催化剂表面,形成过渡态的过程会__ (填“放出热量”或“吸收热量”);反应历程中最小能垒(活化能)步骤的化学方程式为__ 。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)
 NH2COONH4(s) ∆H1
NH2COONH4(s) ∆H1反应II:NH2COONH4(s)
 CO(NH2)2(s)+H2O(g) ∆H2=+72.49kJ/mol
CO(NH2)2(s)+H2O(g) ∆H2=+72.49kJ/mol总反应:2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) ∆H3=-86.98kJ/mol
CO(NH2)2(s)+H2O(g) ∆H3=-86.98kJ/mol请回答下列问题:
①反应I的∆H1=
②反应II一般在
③一定温度下,在体积固定的密闭容器中按计量比投料进行反应I,下列能说明反应达到了平衡状态的是
A.混合气体的平均相对分子质量不再变化
B.容器内气体总压强不再变化
C.2v正(NH3)=v逆(CO2)
D.容器内混合气体的密度不再变化
(2)将CO2和H2按物质的量之比为1:3充入一定体积的密闭容器中,发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ∆H。测得CH3OH的物质的量在不同温度下随时间的变化关系如图所示。

①根据图示判断∆H
②一定温度下,在容积均为2L的两个密闭容器中,按如下方式加入反应物,10min后达到平衡。
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | amolCO2、bmolH2 cmolCH3OH(g)、cmolH2O(g)(a、b、c均不为零) |
若甲容器平衡后气体的压强为开始时的0.8倍,则反应10min内甲容器中以CH3OH(g)表示的化学反应速率为
(3)氢气可将CO2还原为甲烷,反应为CO2(g)+4H2(g)
 CH4(g)+2H2O(g)。ShyamKattel等结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示其中吸附在Pt/SiO2催化剂表面用“·”标注,Ts表示过渡态。物质吸附在催化剂表面,形成过渡态的过程会
CH4(g)+2H2O(g)。ShyamKattel等结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示其中吸附在Pt/SiO2催化剂表面用“·”标注,Ts表示过渡态。物质吸附在催化剂表面,形成过渡态的过程会
您最近一年使用:0次
名校
解题方法
3 . CO2作为未来的重要碳源,其选择性加氢合成CH3OH一直是研究热点。在CO2加氢合成CH3OH的体系中,同时发生以下反应:
反应ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1<0
CH3OH(g)+H2O(g) △H1<0
反应ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H2>0
CO(g)+H2O(g) △H2>0
(1)原料CO2可通过捕获技术从空气或工业尾气中获取,下列物质能作为CO2捕获剂的是__ (填标号)。
A. Na2CO3溶液 B. NaOH溶液 C. CH3CH2OH D. NH4Cl溶液
(2)在特定温度下,由稳定态单质生成1mol化合物的焓变叫该物质在此温度下的标准生成焓(△fH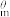 )。下表为几种物质在298K的标准生成焓,则反应ⅱ的△H2=
)。下表为几种物质在298K的标准生成焓,则反应ⅱ的△H2=__ kJ•mol-1。
(3)在CO2加氢合成CH3OH的体系中,下列说法错误 的是__ (填标号)。
A. 增大H2浓度有利于提高CO2的转化率
B. 若气体的平均相对分子质量保持不变,说明反应体系已达平衡
C. 体系达平衡后,若压缩体积,则反应ⅰ平衡正向移动,反应ⅱ平衡不移动
D. 选用合适的催化剂可以提高CH3OH在单位时间内的产量
(4)某温度下,向容积为1L的密闭容器中通入1molCO2(g)和5molH2(g),10min后体系达到平衡,此时CO2的转化率为20%,CH3OH的选择性为50%。
已知:CH3OH的选择性χ= ×100%
×100%
①用CO2表示0~10min内平均反应速率v(CO2)=___ 。
②反应ⅰ的平衡常数K=___ (写出计算式即可)。
(5)维持压强和投料不变,将CO2和H2按一定流速通过反应器,二氧化碳的转化率α(CO2)和甲醇的选择性χ(CH3OH)随温度变化的关系如图所示:
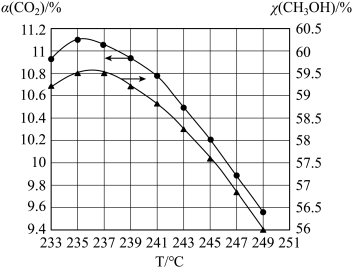
已知催化剂活性受温度影响变化不大。结合反应ⅰ和反应ⅱ,分析235℃后曲线变化的原因。
①甲醇的选择性随温度升高而下降的原因是___ ;
②二氧化碳的转化率随温度升高也在下降的可能原因是___ 。
反应ⅰ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1<0
CH3OH(g)+H2O(g) △H1<0反应ⅱ:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2>0
CO(g)+H2O(g) △H2>0(1)原料CO2可通过捕获技术从空气或工业尾气中获取,下列物质能作为CO2捕获剂的是
A. Na2CO3溶液 B. NaOH溶液 C. CH3CH2OH D. NH4Cl溶液
(2)在特定温度下,由稳定态单质生成1mol化合物的焓变叫该物质在此温度下的标准生成焓(△fH
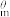 )。下表为几种物质在298K的标准生成焓,则反应ⅱ的△H2=
)。下表为几种物质在298K的标准生成焓,则反应ⅱ的△H2=| 物质 | H2(g) | CO2(g) | CO(g) | H2O(g) |
△fH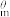 (kJ•mol-1) (kJ•mol-1) | 0 | -394 | -111 | -242 |
A. 增大H2浓度有利于提高CO2的转化率
B. 若气体的平均相对分子质量保持不变,说明反应体系已达平衡
C. 体系达平衡后,若压缩体积,则反应ⅰ平衡正向移动,反应ⅱ平衡不移动
D. 选用合适的催化剂可以提高CH3OH在单位时间内的产量
(4)某温度下,向容积为1L的密闭容器中通入1molCO2(g)和5molH2(g),10min后体系达到平衡,此时CO2的转化率为20%,CH3OH的选择性为50%。
已知:CH3OH的选择性χ=
 ×100%
×100%①用CO2表示0~10min内平均反应速率v(CO2)=
②反应ⅰ的平衡常数K=
(5)维持压强和投料不变,将CO2和H2按一定流速通过反应器,二氧化碳的转化率α(CO2)和甲醇的选择性χ(CH3OH)随温度变化的关系如图所示:

已知催化剂活性受温度影响变化不大。结合反应ⅰ和反应ⅱ,分析235℃后曲线变化的原因。
①甲醇的选择性随温度升高而下降的原因是
②二氧化碳的转化率随温度升高也在下降的可能原因是
您最近一年使用:0次
2021-03-19更新
|
1247次组卷
|
3卷引用:福建省莆田一中2021届高三模拟质量检测化学试题
4 . 氮、磷及其化合物在生产、生活中有重要的用途。回答下列问题:
Ⅰ.(1)氮的固定是几百年来科学家一直研究的课题。
下表列举了不同温度下大气固氮和工业固氮的部分K值。
①分析数据可知:大气固氮反应属于_____ (填“吸热”或“放热”)反应。
②分析数据可知;人类不适合大规模模拟大气固氮的原因_____ 。
(2)NaNO2是一种食品添加剂(有毒性,市场上常误与食盐混淆)。可用酸性KMnO4溶液检验,完成其反应的离子方程式。MnO +NO
+NO +
+_____ =Mn2++NO +H2O。
+H2O。
(3)工业生产以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为: 2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l) △H<0。T1℃时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比)
CO(NH2)2(l)+H2O(l) △H<0。T1℃时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比) = x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。
= x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。
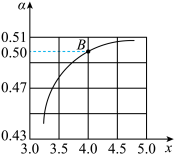
其它条件不变时,α随着x增大而增大的原因是____ ;图中的B点处NH3的平衡转化率为____ 。
II.(4)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和 PCl5(g),反应过程如下。
2P(s) + 3Cl2(g)=2PCl3(g) △H1=-612 kJ· mol-1
2P(s) + 5Cl2(g)=2PCl5(g) △H2=-798 kJ· mol-1
气态PCl5生成气态PCl3和Cl2的热化学方程式为________ 。
(5)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵。直链低聚磷酸铵的化学式可表示为(NH4)(n+2)PnOx,x=___ (用n表示)。
(6)一定温度下,向浓度均为0.20 mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成__ 沉淀(填化学式);当测得溶液中钙离子沉淀完全(浓度小于10-5 mol·L-1)时,溶液中的另一种金属阳离子的物质的量浓度c = ______ mol·L-1。(已知:Ksp[Mg3(PO4)2] =6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。)
Ⅰ.(1)氮的固定是几百年来科学家一直研究的课题。
下表列举了不同温度下大气固氮和工业固氮的部分K值。
| 反应 | 大气固氮 N2(g)+O2(g)  2NO(g) 2NO(g) | 工业固氮 N2(g)+3H2(g)  2NH3(g) 2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②分析数据可知;人类不适合大规模模拟大气固氮的原因
(2)NaNO2是一种食品添加剂(有毒性,市场上常误与食盐混淆)。可用酸性KMnO4溶液检验,完成其反应的离子方程式。MnO
 +NO
+NO +
+ +H2O。
+H2O。(3)工业生产以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为: 2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(l) △H<0。T1℃时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比)
CO(NH2)2(l)+H2O(l) △H<0。T1℃时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比) = x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。
= x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。
其它条件不变时,α随着x增大而增大的原因是
II.(4)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和 PCl5(g),反应过程如下。
2P(s) + 3Cl2(g)=2PCl3(g) △H1=-612 kJ· mol-1
2P(s) + 5Cl2(g)=2PCl5(g) △H2=-798 kJ· mol-1
气态PCl5生成气态PCl3和Cl2的热化学方程式为
(5)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵。直链低聚磷酸铵的化学式可表示为(NH4)(n+2)PnOx,x=
(6)一定温度下,向浓度均为0.20 mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成
您最近一年使用:0次
5 . 硫化碳又称氧硫化碳(化学式为COS),是农药、医药和其它有机合成的重要原料。COS的合成方法之一是在无溶剂的条件下用CO与硫蒸气反应制得,该法流程简单、收效高,但含有CO2、SO2等杂质。
(1)COS的电子式为_________ 。
(2)已知CO2催化加氢合成乙醇的反应原理是: 2CO2(g)+6H2(g) C2H5OH+3H2O(g) △H=-173.6 kJ/mol
C2H5OH+3H2O(g) △H=-173.6 kJ/mol
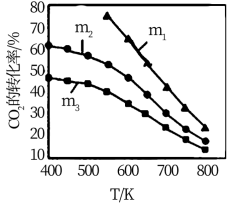
下图是不同起始投料时,CO2的平衡转化率随温度变化的关系,图中m=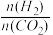 ,为起始时的投料比,则 m1、m2、m3从大到小的顺序为
,为起始时的投料比,则 m1、m2、m3从大到小的顺序为_______ ,理由是____________ 。
(3)天然气部分氧化制取的化工原料气中,常含有COS。目前COS水解是脱除COS的常见方法,即COS在催化剂作用下与水蒸气反应生成硫化氢,生成的硫化氢可用氧化锌等脱硫剂脱除。
①COS 水解的化学方程式为_________________ 。
②常温下,实验测得脱硫(脱除硫化氢)反应过程中,每消耗4.05gZnO,放出3.83 kJ热量。该脱硫反应的热化学方程式为_________________ 。
③近年来,电化学间接氧化法处理硫化氢的技术得到较快发展。该方法是利用Fe3+在酸性条件下与H2S反应生成硫单质,反应后的溶液再用电解的方法“再生”,实现循环利用。电解法使Fe3+“再生”的离子方程式为___________ ,该反应的阳极材料是______ 。
④常温下,HCl和CuCl2的混合溶液中,c(H+) =0.30mol/L,c(Cu2+) =0.10mol/L,往该溶液中通入H2S 至饱和(H2S的近似浓度为0.10mol/L),_____ (填“能”或“不能”)出现沉淀,用必要的计算过程和文字说明理由。
(已知Ka1(H2S)= 1.3×10-7,Ka2(H2S)= 7.0×10-5,Ksp(CuS) = 1.4×10-36)
(1)COS的电子式为
(2)已知CO2催化加氢合成乙醇的反应原理是: 2CO2(g)+6H2(g)
 C2H5OH+3H2O(g) △H=-173.6 kJ/mol
C2H5OH+3H2O(g) △H=-173.6 kJ/mol下图是不同起始投料时,CO2的平衡转化率随温度变化的关系,图中m=
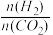 ,为起始时的投料比,则 m1、m2、m3从大到小的顺序为
,为起始时的投料比,则 m1、m2、m3从大到小的顺序为
(3)天然气部分氧化制取的化工原料气中,常含有COS。目前COS水解是脱除COS的常见方法,即COS在催化剂作用下与水蒸气反应生成硫化氢,生成的硫化氢可用氧化锌等脱硫剂脱除。
①COS 水解的化学方程式为
②常温下,实验测得脱硫(脱除硫化氢)反应过程中,每消耗4.05gZnO,放出3.83 kJ热量。该脱硫反应的热化学方程式为
③近年来,电化学间接氧化法处理硫化氢的技术得到较快发展。该方法是利用Fe3+在酸性条件下与H2S反应生成硫单质,反应后的溶液再用电解的方法“再生”,实现循环利用。电解法使Fe3+“再生”的离子方程式为
④常温下,HCl和CuCl2的混合溶液中,c(H+) =0.30mol/L,c(Cu2+) =0.10mol/L,往该溶液中通入H2S 至饱和(H2S的近似浓度为0.10mol/L),
(已知Ka1(H2S)= 1.3×10-7,Ka2(H2S)= 7.0×10-5,Ksp(CuS) = 1.4×10-36)
您最近一年使用:0次
6 . 氢氰酸(HCN)是一种具有苦杏仁气味的无色液体,易溶于水。回答下列问题:
(1)一定的温度和催化剂作用下,利用甲烷、氨气为原料氧化合成氢氰酸。
①氨气的电子式为______________ 。
②合成氢氰酸的化学方程式为________ 。
(2)已知25℃时HCN和H2CO3的电离常数(Ka)如下表:
25 ℃时,物质的量浓度均为0.1 mol • L-1的NaCN、NaHCO3和Na2CO3三种溶液,其pH最大的是________ (填化学式)。
(3)—定条件下,HCN与H2和H2O反应如下:
I. HCN(g)+3H2(g)⇌NH3(g)+CH4(g) △H1
Ⅱ.HCN(g) + H2O(g)⇌NH3(g)+CO(g) △H2
①反应Ⅲ,CO(g)+3H2(g)⇌CH4(g)+H2O(g)的△H=__________ (用△H1、△H2表示)。
②对于反应Ⅱ,减小压强,HCN的转化率______ (填“提高”、“不变”或“降低”)。
③反应I、Ⅱ的平衡常数对数值(lgK)与温度的关系如图甲所示,则T1K时,反应Ⅲ的平衡常数对数值lgK=_________ 。
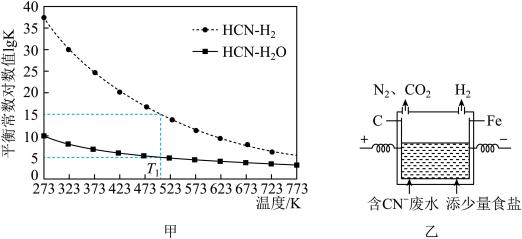
(4)电解法处理含氰废水的原理如图乙所示,阳极CN-先发生电极反应:CN-+2OH--2e-= CNO-+H2O,CNO-在阳极上进一步氧化的电极反应式为________________ 。
(1)一定的温度和催化剂作用下,利用甲烷、氨气为原料氧化合成氢氰酸。
①氨气的电子式为
②合成氢氰酸的化学方程式为
(2)已知25℃时HCN和H2CO3的电离常数(Ka)如下表:
| 物质 | 电离常数(Ka) |
| HCN | Ka=5×10-10 |
| H2CO3 | Ka1=4. 5×10-7 Ka2=4.7×10-11 |
(3)—定条件下,HCN与H2和H2O反应如下:
I. HCN(g)+3H2(g)⇌NH3(g)+CH4(g) △H1
Ⅱ.HCN(g) + H2O(g)⇌NH3(g)+CO(g) △H2
①反应Ⅲ,CO(g)+3H2(g)⇌CH4(g)+H2O(g)的△H=
②对于反应Ⅱ,减小压强,HCN的转化率
③反应I、Ⅱ的平衡常数对数值(lgK)与温度的关系如图甲所示,则T1K时,反应Ⅲ的平衡常数对数值lgK=

(4)电解法处理含氰废水的原理如图乙所示,阳极CN-先发生电极反应:CN-+2OH--2e-= CNO-+H2O,CNO-在阳极上进一步氧化的电极反应式为
您最近一年使用:0次



