名校
1 . 完成下列填空:
(1) 气态高能燃料乙硼烷
气态高能燃料乙硼烷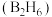 在氧气中燃烧,生成固态三氧化二硼和液态水放出
在氧气中燃烧,生成固态三氧化二硼和液态水放出 热量,其热化学方程式为:
热量,其热化学方程式为:___________ ;
(2)甲烷还原方法是在催化剂作用下可消除氮氧化物(主要为 和
和 )污染,
)污染, 和
和 的混合物反应体系主要发生如下反应:
的混合物反应体系主要发生如下反应:
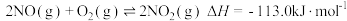 ①
①
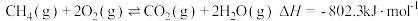 ②
②
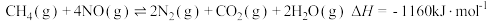 ③
③
则反应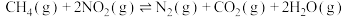 的
的
___________ 。
(3)天然气的一个重要用途是制取 ,其原理为:
,其原理为: 。
。
①该反应的平衡常数表达式为___________ 。
②在密闭容器中通入物质的量浓度均为 的
的 与
与 ,在一定条件下发生反应,测得
,在一定条件下发生反应,测得 的平衡转化率与温度及压强的关系如下图所示,则压强P1
的平衡转化率与温度及压强的关系如下图所示,则压强P1_______ P2(填"大于”或“小于”);压强为 时,在
时,在 点:v(正)
点:v(正)______ v(逆)(填“大于”、“小于”或“等于”)。 可以去除烟气中的
可以去除烟气中的 ,其反应原理如下:
,其反应原理如下: ;其他条件相同,以
;其他条件相同,以 (一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,研究表明,
(一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,研究表明, 在240℃以上发挥催化作用。反应相同的时间,
在240℃以上发挥催化作用。反应相同的时间, 的去除率随反应温度的变化如下图所示。240℃以前,随着温度的升高,
的去除率随反应温度的变化如下图所示。240℃以前,随着温度的升高, 去除率降低的原因是
去除率降低的原因是___________ 。240℃以后,随着温度的升高, 去除率迅速增大的主要原因是
去除率迅速增大的主要原因是___________ 。 的资源化利用能有效减少
的资源化利用能有效减少 排放,实现自然界中的碳循环。
排放,实现自然界中的碳循环。 催化加氢合成甲烷过程中发生下列反应:
催化加氢合成甲烷过程中发生下列反应:
Ⅰ:
Ⅱ:
当 时,
时, 平衡转化率与温度和压强的关系如图所示。800℃时,不同压强下的
平衡转化率与温度和压强的关系如图所示。800℃时,不同压强下的 平衡转化率趋向于相等的原因是
平衡转化率趋向于相等的原因是___________ 。
(1)
 气态高能燃料乙硼烷
气态高能燃料乙硼烷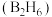 在氧气中燃烧,生成固态三氧化二硼和液态水放出
在氧气中燃烧,生成固态三氧化二硼和液态水放出 热量,其热化学方程式为:
热量,其热化学方程式为:(2)甲烷还原方法是在催化剂作用下可消除氮氧化物(主要为
 和
和 )污染,
)污染, 和
和 的混合物反应体系主要发生如下反应:
的混合物反应体系主要发生如下反应: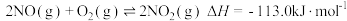 ①
①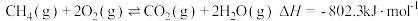 ②
② ③
③则反应
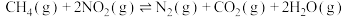 的
的
(3)天然气的一个重要用途是制取
 ,其原理为:
,其原理为: 。
。①该反应的平衡常数表达式为
②在密闭容器中通入物质的量浓度均为
 的
的 与
与 ,在一定条件下发生反应,测得
,在一定条件下发生反应,测得 的平衡转化率与温度及压强的关系如下图所示,则压强P1
的平衡转化率与温度及压强的关系如下图所示,则压强P1 时,在
时,在 点:v(正)
点:v(正)
 可以去除烟气中的
可以去除烟气中的 ,其反应原理如下:
,其反应原理如下: ;其他条件相同,以
;其他条件相同,以 (一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,研究表明,
(一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,研究表明, 在240℃以上发挥催化作用。反应相同的时间,
在240℃以上发挥催化作用。反应相同的时间, 的去除率随反应温度的变化如下图所示。240℃以前,随着温度的升高,
的去除率随反应温度的变化如下图所示。240℃以前,随着温度的升高, 去除率降低的原因是
去除率降低的原因是 去除率迅速增大的主要原因是
去除率迅速增大的主要原因是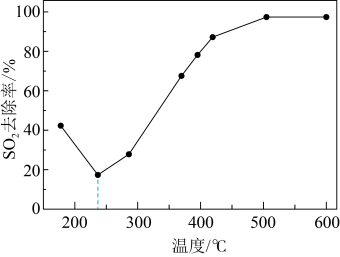
 的资源化利用能有效减少
的资源化利用能有效减少 排放,实现自然界中的碳循环。
排放,实现自然界中的碳循环。 催化加氢合成甲烷过程中发生下列反应:
催化加氢合成甲烷过程中发生下列反应:Ⅰ:

Ⅱ:

当
 时,
时, 平衡转化率与温度和压强的关系如图所示。800℃时,不同压强下的
平衡转化率与温度和压强的关系如图所示。800℃时,不同压强下的 平衡转化率趋向于相等的原因是
平衡转化率趋向于相等的原因是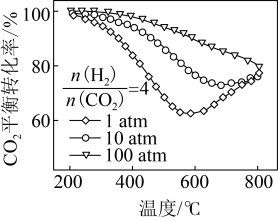
您最近一年使用:0次
2 . NOx、CO是重要污染物,处理NOx、CO等污染物对建设美丽中国具有重要意义。回答下列问题。
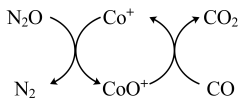
(1)已知CO(g)还原 的反应机理如图所示
的反应机理如图所示
已知:


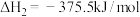
CO(g)与 反应的热化学方程式为
反应的热化学方程式为___________ 。
(2)温度T℃,在恒容密闭容器中充入1:1的NO(g)和CO(g),测得此时压强为 ,发生反应
,发生反应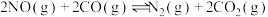 ,达到平衡时NO(g)和
,达到平衡时NO(g)和 的物质的量之比为1:1,则平衡时CO的转化率为
的物质的量之比为1:1,则平衡时CO的转化率为___________ (结果保留一位小数),该反应的化学平衡常数Kp=___________ 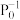 (
( 表示以分压表示的平衡常数,
表示以分压表示的平衡常数,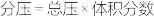 )。若T℃时,向某容器中同时充入NO、CO、
)。若T℃时,向某容器中同时充入NO、CO、 、
、 各1mol,则
各1mol,则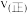
___________ 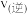 (填“>”“<”或“=”)
(填“>”“<”或“=”)
(3)对于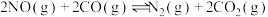 ,反应的活化能Ea,速率常数k满足Arrhenius公式
,反应的活化能Ea,速率常数k满足Arrhenius公式 ,其中R、C为常数,且
,其中R、C为常数,且 ,T为温度。上述反应的实验数据如图所示
,T为温度。上述反应的实验数据如图所示
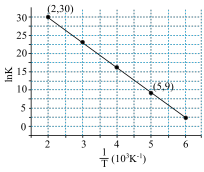
则该反应的活化能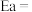
___________  。
。
(4)电解法转化 是实现可再生能源有效利用的关键手段之一,其装置原理如图所示。
是实现可再生能源有效利用的关键手段之一,其装置原理如图所示。
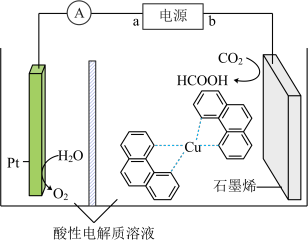
①a为电源的___________ (填“正极”或“负极”),该装置的阴极的电极反应式为___________ 。
②若电解开始前两极室溶液质量相等,当电解过程转移了2mol电子,则阴阳极室溶液质量差为___________ g。

(1)已知CO(g)还原
 的反应机理如图所示
的反应机理如图所示已知:



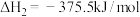
CO(g)与
 反应的热化学方程式为
反应的热化学方程式为(2)温度T℃,在恒容密闭容器中充入1:1的NO(g)和CO(g),测得此时压强为
 ,发生反应
,发生反应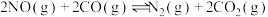 ,达到平衡时NO(g)和
,达到平衡时NO(g)和 的物质的量之比为1:1,则平衡时CO的转化率为
的物质的量之比为1:1,则平衡时CO的转化率为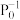 (
( 表示以分压表示的平衡常数,
表示以分压表示的平衡常数, )。若T℃时,向某容器中同时充入NO、CO、
)。若T℃时,向某容器中同时充入NO、CO、 、
、 各1mol,则
各1mol,则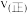
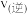 (填“>”“<”或“=”)
(填“>”“<”或“=”)(3)对于
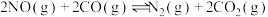 ,反应的活化能Ea,速率常数k满足Arrhenius公式
,反应的活化能Ea,速率常数k满足Arrhenius公式 ,其中R、C为常数,且
,其中R、C为常数,且 ,T为温度。上述反应的实验数据如图所示
,T为温度。上述反应的实验数据如图所示
则该反应的活化能
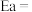
 。
。(4)电解法转化
 是实现可再生能源有效利用的关键手段之一,其装置原理如图所示。
是实现可再生能源有效利用的关键手段之一,其装置原理如图所示。
①a为电源的
②若电解开始前两极室溶液质量相等,当电解过程转移了2mol电子,则阴阳极室溶液质量差为
您最近一年使用:0次
2023-08-15更新
|
500次组卷
|
2卷引用:江苏省淮安市高中校协作体2023-2024学年高三上学期期中联考化学试题
解题方法
3 . 肼(N2H4)是一种无色油状液体,沸点113.5℃,具有强还原性。能与NaClO剧烈反应生成N2。
(1)N2H4分子中N的化合价为___________
(2)N2H4与O2的相对分子质量相近,但N2H4的熔点(2℃)、沸点(114℃)分别远高于O2的熔点(-218℃)、沸点(-183℃),原因是___________ 。
(3)由碱性NaClO溶液和尿素 反应可获得
反应可获得 ,反应原理为:
,反应原理为: 。实验中反应物的加料方式为
。实验中反应物的加料方式为___________ (填序号)。
A.将尿素滴加到碱性NaClO溶液中 B.将碱性NaClO溶液滴加到尿素中
(4)发射火箭时,肼为燃料,双氧水为氧化剂,两者反应生成氮气与水蒸气。已知32g液态肼在上述反应中放出64.22kJ的热量,该反应的热化学方程式为___________ 。
(5)肼-空气燃料电池是一种新型环保电池,(用KOH溶液作电解液),该电池负极的电极反应式为___________ 。
(6)H2是一种理想的绿色清洁能源,N2H4催化分解制氢是能源利用领域的研究热点。在温和条件下,负载型双金属合金M催化N2H4迅速分解,并且制氢选择性可达100%,可能机理如图所示(图中“虚线”表示吸附在催化剂上)。请将N2H4催化分解制氢的机理补充完整:N2H4吸附在(催化剂)M表面,连续断裂___________ 键,形成N2H3、___________ 和N2H等中间产物,直至H原子全部脱去,最终生成___________ 。
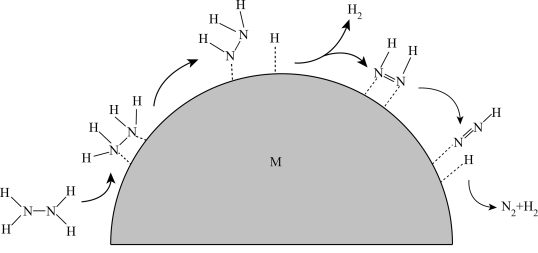
(1)N2H4分子中N的化合价为
(2)N2H4与O2的相对分子质量相近,但N2H4的熔点(2℃)、沸点(114℃)分别远高于O2的熔点(-218℃)、沸点(-183℃),原因是
(3)由碱性NaClO溶液和尿素
 反应可获得
反应可获得 ,反应原理为:
,反应原理为: 。实验中反应物的加料方式为
。实验中反应物的加料方式为A.将尿素滴加到碱性NaClO溶液中 B.将碱性NaClO溶液滴加到尿素中
(4)发射火箭时,肼为燃料,双氧水为氧化剂,两者反应生成氮气与水蒸气。已知32g液态肼在上述反应中放出64.22kJ的热量,该反应的热化学方程式为
(5)肼-空气燃料电池是一种新型环保电池,(用KOH溶液作电解液),该电池负极的电极反应式为
(6)H2是一种理想的绿色清洁能源,N2H4催化分解制氢是能源利用领域的研究热点。在温和条件下,负载型双金属合金M催化N2H4迅速分解,并且制氢选择性可达100%,可能机理如图所示(图中“虚线”表示吸附在催化剂上)。请将N2H4催化分解制氢的机理补充完整:N2H4吸附在(催化剂)M表面,连续断裂

您最近一年使用:0次
4 . 硫和氮是生物必须的营养元素,含硫和氮的化合物在自然界中广泛存在。
(1)火山喷发产生H2S在大气中发生如下反应:
①2H2S(g)+O2(g)=2S(g)+2H2O(l) △H=akJ•mol-1
②S(g)+O2(g)=SO2(g) △H=bkJ•mol-1
写出H2S(g)燃烧的热化学方程式_____ 。
(2)工业上可用NaClO碱性溶液吸收SO2。为了提高吸收效率,常用Ni2O3作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如图所示。Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是______ 。

(3)氮的氧化物脱除可以利用电化学原理处理,利用如图所示装置可同时吸收SO2和NO。
已知:H2S2O4是一种弱酸。

①阴极的电极反应式为_____ 。
②若无能量损失,相同条件下,SO2和NO的体积比为_____ 时,两种气体都能被完全处理。
(4)已知2NO(g)+O2(g) 2NO2(g)的反应历程分两步。
2NO2(g)的反应历程分两步。
第一步:2NO(g)+ N2O2(g)(快反应)
N2O2(g)(快反应)
第二步:N2O2(g)+O2(g) 2NO2(g)(慢反应)
2NO2(g)(慢反应)
用O2表示的速率方程为v(O2)=k1c2(NO)•c(O2);用NO2表示的速率方程为v(NO2)=k2c2(NO)•c(O2),k1与k2分别表示速率常数,则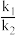 =
=_____ 。(填数值)
(5)太阳能光电催化—化学耦合分解H2S的装置如图所示。

①该太阳能光电催化—化学耦合分解H2S的过程可描述为______ 。
②从能源利用和资源综合利用角度分析该方法优点是______ 。
(1)火山喷发产生H2S在大气中发生如下反应:
①2H2S(g)+O2(g)=2S(g)+2H2O(l) △H=akJ•mol-1
②S(g)+O2(g)=SO2(g) △H=bkJ•mol-1
写出H2S(g)燃烧的热化学方程式
(2)工业上可用NaClO碱性溶液吸收SO2。为了提高吸收效率,常用Ni2O3作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如图所示。Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是

(3)氮的氧化物脱除可以利用电化学原理处理,利用如图所示装置可同时吸收SO2和NO。
已知:H2S2O4是一种弱酸。

①阴极的电极反应式为
②若无能量损失,相同条件下,SO2和NO的体积比为
(4)已知2NO(g)+O2(g)
 2NO2(g)的反应历程分两步。
2NO2(g)的反应历程分两步。第一步:2NO(g)+
 N2O2(g)(快反应)
N2O2(g)(快反应)第二步:N2O2(g)+O2(g)
 2NO2(g)(慢反应)
2NO2(g)(慢反应)用O2表示的速率方程为v(O2)=k1c2(NO)•c(O2);用NO2表示的速率方程为v(NO2)=k2c2(NO)•c(O2),k1与k2分别表示速率常数,则
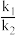 =
=(5)太阳能光电催化—化学耦合分解H2S的装置如图所示。

①该太阳能光电催化—化学耦合分解H2S的过程可描述为
②从能源利用和资源综合利用角度分析该方法优点是
您最近一年使用:0次
5 . 研究化学反应中的能量变化有利于更好的开发和使用化学能源。
(1)已知H2、CO、CH4的燃烧热分别为285.8kJ·mol-1、283.0kJ·mol-1、890.3kJ·mol-1。
①相同条件下,等质量的H2、CO、CH4分别完全燃烧,放出热量最多的是___________ 。
②2CH4(g)+3O2(g)=2CO(g)+4H2O(l) ΔH=___________ kJ·mol-1。
③等质量的甲烷按a、b两种途径完全转化,放出的热量:途径a___________ 途径b(填“>”、“<”或“=”)
途径a:CH4 CO+H2
CO+H2 CO2+H2O
CO2+H2O
途径b:CH4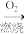 CO2+H2O
CO2+H2O
(2)已知白磷(P4)和P4O6的分子结构和部分化学键的键能分别如下图、表所示:

①写出白磷与氧气反应生成P4O6固体的热化学方程式:___________ 。
②已知P4(白磷,s)=4P(红磷,s)ΔH=-16.7kJ·mol-1。白磷和红磷互为___________ (填“同系物”、“同位素”、“同素异形体”或“同分异构体”),比较稳定的是___________ 。等质量的白磷、红磷分别完全燃烧,放出热量更多的是___________ 。
(1)已知H2、CO、CH4的燃烧热分别为285.8kJ·mol-1、283.0kJ·mol-1、890.3kJ·mol-1。
①相同条件下,等质量的H2、CO、CH4分别完全燃烧,放出热量最多的是
②2CH4(g)+3O2(g)=2CO(g)+4H2O(l) ΔH=
③等质量的甲烷按a、b两种途径完全转化,放出的热量:途径a
途径a:CH4
 CO+H2
CO+H2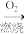 CO2+H2O
CO2+H2O途径b:CH4
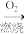 CO2+H2O
CO2+H2O(2)已知白磷(P4)和P4O6的分子结构和部分化学键的键能分别如下图、表所示:

| 化学键 | P-P | O=O | P-O |
| 键能(kJ·mol-1) | a | b | c |
②已知P4(白磷,s)=4P(红磷,s)ΔH=-16.7kJ·mol-1。白磷和红磷互为
您最近一年使用:0次
6 . 化学反应过程中既有物质变化,又有能量变化。释放或吸收热量是化学反应中能量变化的主要形式之一
(1)甲烷具有较大的燃烧热( ),是常见燃料。请写出甲烷燃烧的热化学反应方程式
),是常见燃料。请写出甲烷燃烧的热化学反应方程式_______ 。
(2)①工业上高纯硅可通过下列反应制取: 该反应的反应热
该反应的反应热
_______  。
。
已知:
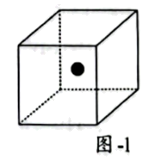
②硅晶体结构与金刚石类似。题图-1所示立方体体心的“●”表示晶体中的一个Si原子,请在立方体的顶点用“●”表示出与之紧邻的所有硅原子。________
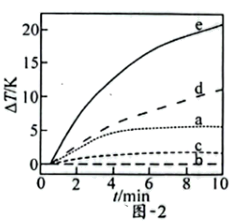
(3)自发热材料在生活中的应用日益广泛。某实验小组为探究“CaO-Al- ”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值(
”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值( )随时间(t)的变化曲线,如图-2所示。
)随时间(t)的变化曲线,如图-2所示。
已知:I.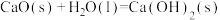
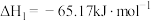
II.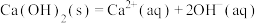
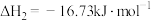
III.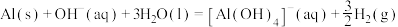
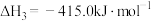
①实验b中, 的变化说明Al粉与
的变化说明Al粉与 在该条件下
在该条件下_______ (填“反应”或“不反应”)。
②实验c中,前3min的 有变化,其原因是
有变化,其原因是_______ ;3min后 基本不变,其原因是
基本不变,其原因是_______ 。
③实验d在10min内温度持续升高的原因是_______ 。
④实验e中发生的总反应可表示为: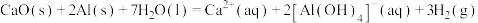 ,其
,其
_______ 。
五组实验对比,e放热效果最好。
(1)甲烷具有较大的燃烧热(
 ),是常见燃料。请写出甲烷燃烧的热化学反应方程式
),是常见燃料。请写出甲烷燃烧的热化学反应方程式(2)①工业上高纯硅可通过下列反应制取:
 该反应的反应热
该反应的反应热
 。
。已知:
| 化学键 | Si-Cl | H-H | H-Cl | Si-Si |
键能/ | 360 | 436 | 431 | 176 |
②硅晶体结构与金刚石类似。题图-1所示立方体体心的“●”表示晶体中的一个Si原子,请在立方体的顶点用“●”表示出与之紧邻的所有硅原子。

(3)自发热材料在生活中的应用日益广泛。某实验小组为探究“CaO-Al-
 ”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值(
”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值( )随时间(t)的变化曲线,如图-2所示。
)随时间(t)的变化曲线,如图-2所示。| 实验编号 | 反应物组成 |
| a | 0.20gCaO粉末、5.0mL |
| b | 0.15gAl粉、5.0mL |
| c | 0.15gAl粉、5.0mL饱和石灰水 |
| d | 0.15gAl粉、5.0mL石灰乳 |
| e | 0.15gAl粉、0.20gCaO粉末 5.0mL |

已知:I.
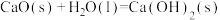
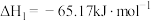
II.
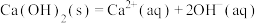
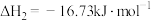
III.
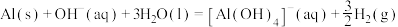
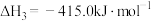
①实验b中,
 的变化说明Al粉与
的变化说明Al粉与 在该条件下
在该条件下②实验c中,前3min的
 有变化,其原因是
有变化,其原因是 基本不变,其原因是
基本不变,其原因是③实验d在10min内温度持续升高的原因是
④实验e中发生的总反应可表示为:
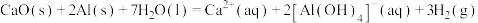 ,其
,其
五组实验对比,e放热效果最好。
您最近一年使用:0次
7 . 有效利用二氧化碳对实现“碳中和”意义重大。
(1)现代工业技术可从空气或工业尾气中捕获 ,可作为
,可作为 捕获剂的有
捕获剂的有_______ 。
a. 溶液 b.氨水 c.
溶液 b.氨水 c. 溶液
溶液
(2)科研人员利用 催化剂,将
催化剂,将 与
与 合成
合成 ,主要反应的热化学方程式如下。
,主要反应的热化学方程式如下。
反应Ⅰ:
反应Ⅱ:
反应Ⅲ: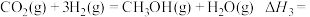
_______ 。
(3)使用惰性电极电解 制取甲醇的反应装置如图所示:电极a接电源
制取甲醇的反应装置如图所示:电极a接电源_______ 极(填“正”或“负”):生成甲醇的电极反应式为_______ 。

(4) 可催化加氢生成
可催化加氢生成 ,其过程为:向
,其过程为:向 溶液中通入
溶液中通入 转化为
转化为 ,一定条件下再通入
,一定条件下再通入 可反应生成
可反应生成 ,进一步生产
,进一步生产 。
。 产率
产率 曲线见图。当温度高于
曲线见图。当温度高于 时,
时, 的产率下降,可能的原因是
的产率下降,可能的原因是_______ 。

(5)中国科学院于2021年首次实现 到淀粉的合成。部分反应历程见图所示,该历程可描述为
到淀粉的合成。部分反应历程见图所示,该历程可描述为_______ 。

(1)现代工业技术可从空气或工业尾气中捕获
 ,可作为
,可作为 捕获剂的有
捕获剂的有a.
 溶液 b.氨水 c.
溶液 b.氨水 c. 溶液
溶液(2)科研人员利用
 催化剂,将
催化剂,将 与
与 合成
合成 ,主要反应的热化学方程式如下。
,主要反应的热化学方程式如下。反应Ⅰ:

反应Ⅱ:

反应Ⅲ:
(3)使用惰性电极电解
 制取甲醇的反应装置如图所示:电极a接电源
制取甲醇的反应装置如图所示:电极a接电源
(4)
 可催化加氢生成
可催化加氢生成 ,其过程为:向
,其过程为:向 溶液中通入
溶液中通入 转化为
转化为 ,一定条件下再通入
,一定条件下再通入 可反应生成
可反应生成 ,进一步生产
,进一步生产 。
。 产率
产率 曲线见图。当温度高于
曲线见图。当温度高于 时,
时, 的产率下降,可能的原因是
的产率下降,可能的原因是
(5)中国科学院于2021年首次实现
 到淀粉的合成。部分反应历程见图所示,该历程可描述为
到淀粉的合成。部分反应历程见图所示,该历程可描述为
您最近一年使用:0次
名校
8 . 2022年6月5日10时44分,搭载神舟十四号载人飞船的长征二号F遥十四运载火箭在酒泉卫星发射中心点火发射,成功将飞船运送到预定轨道。肼(N2H4)是一种良好的火箭推进剂,其与适当的氧化剂(如过氧化氢、氧气等)配合,可组成比冲最高的可贮存液体推进剂。


(1)液态肼和液态过氧化氢混合反应时,即产生大量氮气和水蒸气,并放出大量热。若每生成1molN2,放出642kJ的热量,则该反应的热化学方程式为_______ ;消耗16g液态肼放出的热量为_______ 。
(2)已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-544kJ/mol,用如下图示表示该反应时:
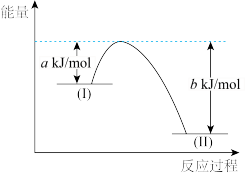
N2H4(g)+O2(g)表示图中_______ (填“I”或“II”)处物质,(b-a)kJ/mol表示该反应的_______ 。使用合适的催化剂,_______ (填“能"或“不能")改变该反应的焓变。
(3)已知:N2(g)+2O2(g)=2NO2(g) ΔH=+68kJ·mol-1,则肼(g)和二氧化氮(g)反应生成氮气和水蒸气的热化学方程式为_______ 。
(4)火箭如果用压缩NO2作氧化剂,发射时尾部有大量的红棕色气体产生,此颜色比压缩NO2颜色更深,原因是_______ (用化学方程式表示)。


(1)液态肼和液态过氧化氢混合反应时,即产生大量氮气和水蒸气,并放出大量热。若每生成1molN2,放出642kJ的热量,则该反应的热化学方程式为
(2)已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-544kJ/mol,用如下图示表示该反应时:

N2H4(g)+O2(g)表示图中
(3)已知:N2(g)+2O2(g)=2NO2(g) ΔH=+68kJ·mol-1,则肼(g)和二氧化氮(g)反应生成氮气和水蒸气的热化学方程式为
(4)火箭如果用压缩NO2作氧化剂,发射时尾部有大量的红棕色气体产生,此颜色比压缩NO2颜色更深,原因是
您最近一年使用:0次
9 . 1.已知存在下列热化学方程式:
①氢气燃烧H2(g)+ O2(g)= H2O(g) ΔH1=-241.8 kJ·mol-1
O2(g)= H2O(g) ΔH1=-241.8 kJ·mol-1
②太阳光分解水制氢气2H2O(l)=2H2(g)+O2(g) ΔH2=571.6 kJ·mol-1
③液态水转化为水蒸气H2O(l)= H2O(g) ΔH3=___ kJ·mol-1
(1)从能量转化角度分析,反应①为_______ 反应。(填“吸热”或“放热”)
(2)反应②中主要能量转化形式为_______ 能转化为_______ 能。
(3)若在反应②中使用催化剂,ΔH2_______ 。(填“增大”“减小”或“不变”)
(4)写出反应③的热化学方程式_______ 。
(5)根据下表内容及你所学知识列举氢气被称为“绿色能源”的原因_______ 。
热值是指某种燃料完全燃烧放出的热量与其质量之比,其单位是kJ/ g (气体)。
①氢气燃烧H2(g)+
 O2(g)= H2O(g) ΔH1=-241.8 kJ·mol-1
O2(g)= H2O(g) ΔH1=-241.8 kJ·mol-1②太阳光分解水制氢气2H2O(l)=2H2(g)+O2(g) ΔH2=571.6 kJ·mol-1
③液态水转化为水蒸气H2O(l)= H2O(g) ΔH3=
(1)从能量转化角度分析,反应①为
(2)反应②中主要能量转化形式为
(3)若在反应②中使用催化剂,ΔH2
(4)写出反应③的热化学方程式
(5)根据下表内容及你所学知识列举氢气被称为“绿色能源”的原因
| 燃料名称 | 热值(kJ/g) |
| 氢气 | 142.9 |
| 一氧化碳 | 10.11 |
| 甲烷 | 55.64 |
您最近一年使用:0次
2022-05-31更新
|
523次组卷
|
3卷引用:江苏省淮安市淮安区2021-2022学年高二下学期期中调研测试化学试题
江苏省淮安市淮安区2021-2022学年高二下学期期中调研测试化学试题(已下线)1.2 反应热的计算-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)四川省自贡市第二十二中学校2023-2024学年高二上学期期中考试化学试题
名校
10 . 回答下列问题:
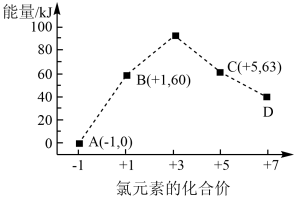
(1)测定稀硫酸和稀氢氧化钠中和热(中和热为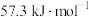 )的实验装置如图所示。
)的实验装置如图所示。
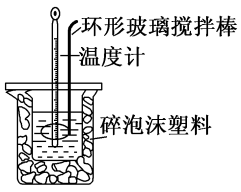
某兴趣小组的实验数值结果小于57.3kJ/mol原因可能是_______ (填字母)。
a.实验装置保温、隔热效果差
b.读取混合液的最高温度记为终点温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后未洗涤,直接测定 溶液的温度
溶液的温度
(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

反应Ⅰ:
 kJ/mol
kJ/mol
反应Ⅲ:
 kJ/mol
kJ/mol
反应Ⅱ的热化学方程式:_______ 。
(3)由气态基态原子形成1 mol化学键释放的最低能量叫做键能。已知下表中所列键能数据,则

_______ kJ/mol
(4)氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。其正极反应方程式为_______ ,若将负极材料改为 ,写出其负极反应方程式
,写出其负极反应方程式_______ 。
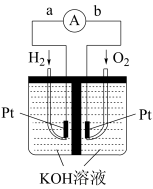
(5)一定条件下,在水溶液中均为1mol的下列离子 、
、 、
、 、
、 、
、 的能量(kJ)相对大小如图所示,则
的能量(kJ)相对大小如图所示,则 的
的
_______ kJ/mol。
(1)测定稀硫酸和稀氢氧化钠中和热(中和热为
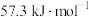 )的实验装置如图所示。
)的实验装置如图所示。
某兴趣小组的实验数值结果小于57.3kJ/mol原因可能是
a.实验装置保温、隔热效果差
b.读取混合液的最高温度记为终点温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后未洗涤,直接测定
 溶液的温度
溶液的温度(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

反应Ⅰ:

 kJ/mol
kJ/mol反应Ⅲ:

 kJ/mol
kJ/mol反应Ⅱ的热化学方程式:
(3)由气态基态原子形成1 mol化学键释放的最低能量叫做键能。已知下表中所列键能数据,则


| 化学键 |  |  |  |
| 键能/kJ/mol | a | b | c |
(4)氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。其正极反应方程式为
 ,写出其负极反应方程式
,写出其负极反应方程式
(5)一定条件下,在水溶液中均为1mol的下列离子
 、
、 、
、 、
、 、
、 的能量(kJ)相对大小如图所示,则
的能量(kJ)相对大小如图所示,则 的
的

您最近一年使用:0次
2022-05-04更新
|
206次组卷
|
2卷引用:江苏省南京市金中集团人民中学2021-2022学年高一6月月考化学试题



