名校
1 . 工业及汽车尾气已成为城市空气的主要污染源,研究其反应机理对于环境治理有重要意义。
(1)硝酸厂尾气可以回收制备硝酸。已知:
①2NO(g)+O2(g)=2NO2(g) △H1=-113.0 kJ/mol
②3NO2(g)+H2O(g)=2HNO3(g)+NO(g) △H2=-138.0 kJ/mol
4NO2(g)+O2(g)+2H2O(g)=4HNO3(g) △H=___________ kJ/mol。
(2)液氨催化还原NO是重要的烟气脱硝技术。使用Fe2O3为催化剂,可能的反应过程如图所示。___________ 。
②反应过程图中,虚线方框里的过程可描述为___________ 。
③氨氮比会直接影响该方法的脱硝率。350℃时只改变氨气的投放量,NO的百分含量与氨氮比的关系如图所示。当 >1.0时,烟气中NO含量反而增大,主要原因是
>1.0时,烟气中NO含量反而增大,主要原因是___________ 。
NO2被Na2CO3溶液吸收生成的三种盐分别是NaNO2、NaNO3和___________ 。(填化学式)
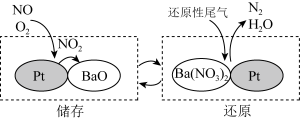
(4)NSR (NOX储存还原)可有效减少氮氧化物排放。工作原理:通过BaO和Ba(NO3)2的相互转化实现NOX的储存和还原,如图所示。___________ 。
(1)硝酸厂尾气可以回收制备硝酸。已知:
①2NO(g)+O2(g)=2NO2(g) △H1=-113.0 kJ/mol
②3NO2(g)+H2O(g)=2HNO3(g)+NO(g) △H2=-138.0 kJ/mol
4NO2(g)+O2(g)+2H2O(g)=4HNO3(g) △H=
(2)液氨催化还原NO是重要的烟气脱硝技术。使用Fe2O3为催化剂,可能的反应过程如图所示。
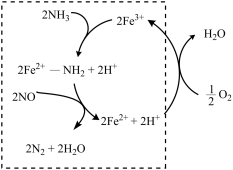
②反应过程图中,虚线方框里的过程可描述为
③氨氮比会直接影响该方法的脱硝率。350℃时只改变氨气的投放量,NO的百分含量与氨氮比的关系如图所示。当
 >1.0时,烟气中NO含量反而增大,主要原因是
>1.0时,烟气中NO含量反而增大,主要原因是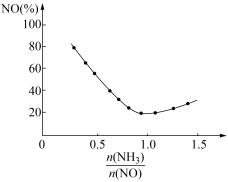
NO2被Na2CO3溶液吸收生成的三种盐分别是NaNO2、NaNO3和
(4)NSR (NOX储存还原)可有效减少氮氧化物排放。工作原理:通过BaO和Ba(NO3)2的相互转化实现NOX的储存和还原,如图所示。
您最近一年使用:0次
名校
解题方法
2 . 反应速率与化学平衡均是化工生产中关注的重要问题。
(1)平衡常数K能为化学工作者提供许多信息。
实验测得下列3个反应的平衡常数K与温度T的函数关系如下:
则在该实验条件下,反应Ⅰ的活化能Ea(正) ___________ Ea(逆)(填“>”或“<”), 的数值范围是
的数值范围是___________ 。
A.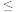 2 B.-2~0 C.0~2 D.>2
2 B.-2~0 C.0~2 D.>2
(2)工业上利用CO2氧化乙苯制苯乙烯的反应为:

①催化剂MxOy作用下,该反应可能存在如下图所示反应机理:

写出该机理表示的两个基元反应:
ⅰ:___________ 。
ⅱ:___________ 。
②常压下,乙苯和CO2在催化剂MxOy作用下反应。控制投料比[n(CO2):n(乙苯)]分别为1:1、5:1和10:1,乙苯平衡转化率与反应温度的关系如下图所示:

乙苯平衡转化率相同时,投料比越高,对应的反应温度越___________ (填“高”或“低”)。相同温度下,投料比远大于10:1时,乙苯的消耗速率明显下降,可能的原因是___________ 。
③700K时,向恒容密闭容器中加入过量CaCO3和一定量乙苯,初始和平衡时容器内压强分别为p1kPa和p2kPa,则平衡时苯乙烯的分压为___________ kPa(以含有p1、p2、p3的代数式表示)。[已知:CaCO3(s) CaO(s)+CO2(g) Kp=p3kPa]
CaO(s)+CO2(g) Kp=p3kPa]
(1)平衡常数K能为化学工作者提供许多信息。
实验测得下列3个反应的平衡常数K与温度T的函数关系如下:
| 序号 | 化学反应 | K与T的关系(c1、c2、c3为常数) |
| Ⅰ | 2O3(g) 3O2(g) △H1 3O2(g) △H1 | 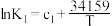 |
| Ⅱ | 4NO2(g)+O2(g) 2N2O5(g) △H2 2N2O5(g) △H2 | 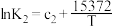 |
| Ⅲ | 2NO2(g)+O3(g) N2O5(g)+O2(g) △H3 N2O5(g)+O2(g) △H3 | 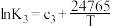 |
 的数值范围是
的数值范围是A.
 2 B.-2~0 C.0~2 D.>2
2 B.-2~0 C.0~2 D.>2(2)工业上利用CO2氧化乙苯制苯乙烯的反应为:

①催化剂MxOy作用下,该反应可能存在如下图所示反应机理:

写出该机理表示的两个基元反应:
ⅰ:
ⅱ:
②常压下,乙苯和CO2在催化剂MxOy作用下反应。控制投料比[n(CO2):n(乙苯)]分别为1:1、5:1和10:1,乙苯平衡转化率与反应温度的关系如下图所示:

乙苯平衡转化率相同时,投料比越高,对应的反应温度越
③700K时,向恒容密闭容器中加入过量CaCO3和一定量乙苯,初始和平衡时容器内压强分别为p1kPa和p2kPa,则平衡时苯乙烯的分压为
 CaO(s)+CO2(g) Kp=p3kPa]
CaO(s)+CO2(g) Kp=p3kPa]
您最近一年使用:0次
解题方法
3 . 空气中有丰富的氮气,科学家展开了向空气要氨气的系列研究。
(1)已知: 2H2(g)+O2(g)=2H2O(l) ΔH=a kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=c kJ·mol-1
工业上合成氨反应N2(g)+3H2(g)⇌2NH3(g) ΔH=_______ kJ·mol-1
(2)脱除烟气中的氮氧化物(主要是指NO和NO2)可净化空气、改善环境,是环境保护的主要课题。
①NO2的消除。
可以用碳酸钠溶液来进行吸收,在产生CO2的同时,会生成NaNO2,NaNO2是工业盐的主要成分,在漂白、电镀等方面应用广泛。
a.写出碳酸钠溶液消除NO2的化学方程式:_______ 。
b.经过一系列后续操作可以得到产品NaNO2,但一般会混有一定量_______ 的杂质。
②NO的消除。
HClO可有效脱除NO,但HClO不稳定,实际应用中常用其盐。 次氯酸盐脱除NO的主要过程如下:a.NO+HClO=NO2+HCl b.NO+NO2+H2O=2HNO2 c.HClO+HNO2=HNO3+HCl
下列分析不正确的是_______ 。
A.烟气中含有的少量O2能提高NO的脱除率
B.NO2单独存在时不能被脱除
C.脱除过程中,次氯酸盐溶液的pH下降
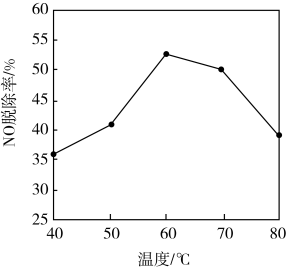
(3)研究不同温度下Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。脱除过程中往往有Cl2产生,原因是_______ (用离子方程式表示);60~80℃NO脱除率下降的原因是_______ 。
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如下图所示。当NO2与NO的物质的量之比为1∶1时,与足量氨气在一定条件下发生脱氮反应。该反应的化学方程式为_______ 。

(1)已知: 2H2(g)+O2(g)=2H2O(l) ΔH=a kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=c kJ·mol-1
工业上合成氨反应N2(g)+3H2(g)⇌2NH3(g) ΔH=
(2)脱除烟气中的氮氧化物(主要是指NO和NO2)可净化空气、改善环境,是环境保护的主要课题。
①NO2的消除。
可以用碳酸钠溶液来进行吸收,在产生CO2的同时,会生成NaNO2,NaNO2是工业盐的主要成分,在漂白、电镀等方面应用广泛。
a.写出碳酸钠溶液消除NO2的化学方程式:
b.经过一系列后续操作可以得到产品NaNO2,但一般会混有一定量
②NO的消除。
HClO可有效脱除NO,但HClO不稳定,实际应用中常用其盐。 次氯酸盐脱除NO的主要过程如下:a.NO+HClO=NO2+HCl b.NO+NO2+H2O=2HNO2 c.HClO+HNO2=HNO3+HCl
下列分析不正确的是
A.烟气中含有的少量O2能提高NO的脱除率
B.NO2单独存在时不能被脱除
C.脱除过程中,次氯酸盐溶液的pH下降
(3)研究不同温度下Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。脱除过程中往往有Cl2产生,原因是

(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如下图所示。当NO2与NO的物质的量之比为1∶1时,与足量氨气在一定条件下发生脱氮反应。该反应的化学方程式为

您最近一年使用:0次
2023-03-30更新
|
609次组卷
|
3卷引用:江苏省南京市田家炳高级中学2022-2023学年高一下学期期中考试化学试题
名校
4 . 甲烷是一种重要的化工原料,常用于制H2和CO。
(1)CH4和H2O(g) 在一定条件下可制得H2和CO,反应原理如下:
①CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH1=-165 kJ·mol-1
②CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41 kJ·mol-1
③CH4(g)+H2O(g) =CO(g)+3H2(g) ΔH3
反应③的ΔH3=_______ 。
(2)甲烷裂解制氢的反应为CH4(g)=C(s)+2H2(g) ΔH=+75 kJ·mol-1,Ni和活性炭均可作该反应催化剂。CH4在催化剂孔道表面反应,若孔道堵塞会导致催化剂失活。
①Ni催化剂可用NiC2O4·2H2O晶体在氩气环境中受热分解制备,该反应方程式为_______ 。
②向反应系统中通入水蒸气可有效减少催化剂失活,其原因是_______ 。
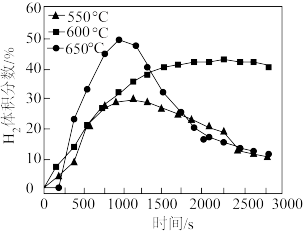
③使用Ni催化剂,且其他条件相同时,随时间增加,温度对Ni催化剂催化效果的影响如图所示。使用催化剂的最佳温度为_______ 。
④650℃条件下,1 000 s后,氢气的体积分数快速下降的原因为_______ 。
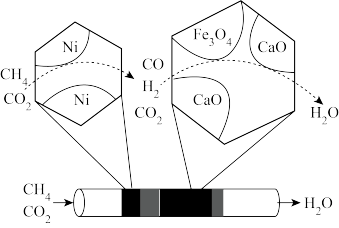
(3)甲烷、二氧化碳重整制CO经历过程I、Ⅱ。过程I如图所示,可描述为_______ ;过程Ⅱ保持温度不变,再通入惰性气体,CaCO3分解产生CO2,Fe 将CO2还原得到CO和Fe3O4。
(1)CH4和H2O(g) 在一定条件下可制得H2和CO,反应原理如下:
①CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH1=-165 kJ·mol-1
②CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41 kJ·mol-1
③CH4(g)+H2O(g) =CO(g)+3H2(g) ΔH3
反应③的ΔH3=
(2)甲烷裂解制氢的反应为CH4(g)=C(s)+2H2(g) ΔH=+75 kJ·mol-1,Ni和活性炭均可作该反应催化剂。CH4在催化剂孔道表面反应,若孔道堵塞会导致催化剂失活。
①Ni催化剂可用NiC2O4·2H2O晶体在氩气环境中受热分解制备,该反应方程式为
②向反应系统中通入水蒸气可有效减少催化剂失活,其原因是
③使用Ni催化剂,且其他条件相同时,随时间增加,温度对Ni催化剂催化效果的影响如图所示。使用催化剂的最佳温度为
④650℃条件下,1 000 s后,氢气的体积分数快速下降的原因为

(3)甲烷、二氧化碳重整制CO经历过程I、Ⅱ。过程I如图所示,可描述为

您最近一年使用:0次
2023-03-15更新
|
470次组卷
|
3卷引用:江苏省南京市六校2022-2023学年高二下学期3月联合调研考试化学试题
江苏省南京市六校2022-2023学年高二下学期3月联合调研考试化学试题江苏省南京市江浦高级中学等5校2022-2023学年高二下学期3月月考化学试题(已下线)专题02 盖斯定律、反应热的计算【考点清单】(讲+练)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)
名校
5 . 2022年6月5日10时44分,搭载神舟十四号载人飞船的长征二号F遥十四运载火箭在酒泉卫星发射中心点火发射,成功将飞船运送到预定轨道。肼(N2H4)是一种良好的火箭推进剂,其与适当的氧化剂(如过氧化氢、氧气等)配合,可组成比冲最高的可贮存液体推进剂。


(1)液态肼和液态过氧化氢混合反应时,即产生大量氮气和水蒸气,并放出大量热。若每生成1molN2,放出642kJ的热量,则该反应的热化学方程式为_______ ;消耗16g液态肼放出的热量为_______ 。
(2)已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-544kJ/mol,用如下图示表示该反应时:
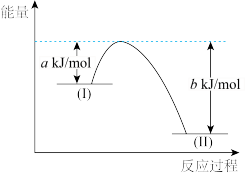
N2H4(g)+O2(g)表示图中_______ (填“I”或“II”)处物质,(b-a)kJ/mol表示该反应的_______ 。使用合适的催化剂,_______ (填“能"或“不能")改变该反应的焓变。
(3)已知:N2(g)+2O2(g)=2NO2(g) ΔH=+68kJ·mol-1,则肼(g)和二氧化氮(g)反应生成氮气和水蒸气的热化学方程式为_______ 。
(4)火箭如果用压缩NO2作氧化剂,发射时尾部有大量的红棕色气体产生,此颜色比压缩NO2颜色更深,原因是_______ (用化学方程式表示)。


(1)液态肼和液态过氧化氢混合反应时,即产生大量氮气和水蒸气,并放出大量热。若每生成1molN2,放出642kJ的热量,则该反应的热化学方程式为
(2)已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-544kJ/mol,用如下图示表示该反应时:

N2H4(g)+O2(g)表示图中
(3)已知:N2(g)+2O2(g)=2NO2(g) ΔH=+68kJ·mol-1,则肼(g)和二氧化氮(g)反应生成氮气和水蒸气的热化学方程式为
(4)火箭如果用压缩NO2作氧化剂,发射时尾部有大量的红棕色气体产生,此颜色比压缩NO2颜色更深,原因是
您最近一年使用:0次
名校
6 . 回答下列问题:
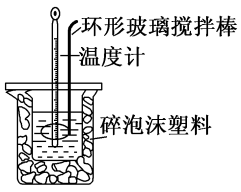
(1)测定稀硫酸和稀氢氧化钠中和热(中和热为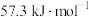 )的实验装置如图所示。
)的实验装置如图所示。
某兴趣小组的实验数值结果小于57.3kJ/mol原因可能是_______ (填字母)。
a.实验装置保温、隔热效果差
b.读取混合液的最高温度记为终点温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后未洗涤,直接测定 溶液的温度
溶液的温度
(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

反应Ⅰ:
 kJ/mol
kJ/mol
反应Ⅲ:
 kJ/mol
kJ/mol
反应Ⅱ的热化学方程式:_______ 。
(3)由气态基态原子形成1 mol化学键释放的最低能量叫做键能。已知下表中所列键能数据,则

_______ kJ/mol
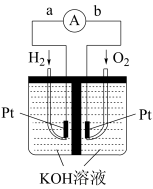
(4)氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。其正极反应方程式为_______ ,若将负极材料改为 ,写出其负极反应方程式
,写出其负极反应方程式_______ 。
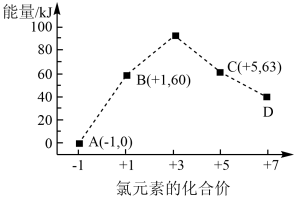
(5)一定条件下,在水溶液中均为1mol的下列离子 、
、 、
、 、
、 、
、 的能量(kJ)相对大小如图所示,则
的能量(kJ)相对大小如图所示,则 的
的
_______ kJ/mol。
(1)测定稀硫酸和稀氢氧化钠中和热(中和热为
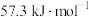 )的实验装置如图所示。
)的实验装置如图所示。
某兴趣小组的实验数值结果小于57.3kJ/mol原因可能是
a.实验装置保温、隔热效果差
b.读取混合液的最高温度记为终点温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后未洗涤,直接测定
 溶液的温度
溶液的温度(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

反应Ⅰ:

 kJ/mol
kJ/mol反应Ⅲ:

 kJ/mol
kJ/mol反应Ⅱ的热化学方程式:
(3)由气态基态原子形成1 mol化学键释放的最低能量叫做键能。已知下表中所列键能数据,则


| 化学键 |  |  |  |
| 键能/kJ/mol | a | b | c |
(4)氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。其正极反应方程式为
 ,写出其负极反应方程式
,写出其负极反应方程式
(5)一定条件下,在水溶液中均为1mol的下列离子
 、
、 、
、 、
、 、
、 的能量(kJ)相对大小如图所示,则
的能量(kJ)相对大小如图所示,则 的
的

您最近一年使用:0次
2022-05-04更新
|
206次组卷
|
2卷引用:江苏省南京市金中集团人民中学2021-2022学年高一6月月考化学试题
7 . 燃煤烟气中SO2和NOx是大气污染物的主要来源,脱硫脱硝技术是烟气治理技术的研究热点。
(1)尿素/H2O2溶液脱硫脱硝。尿素[CO(NH2)2]是一种强还原剂。60℃时在一定浓度的尿素/H2O2溶液中通入含有SO2和NO的烟气,烟气中有毒气体被一定程度吸收。尿素/H2O2溶液对SO2具有很高的去除效率,写出尿素和H2O2溶液吸收SO2,生成硫酸铵和CO2的化学方程式为____ 。
(2)除去烟气中的NOx,利用氢气选择性催化还原(H2—SCR)是目前消除NO的理想方法。H2—SCR法的主反应:2NO(g)+2H2(g)=N2(g)+2H2O(g) △H1
副反应:2NO(g)+H2(g)=N2O(g)+H2O(g) △H2<0
①已知H2(g)+ O2(g)=H2O(g) △H3=-241.5kJ·mol-1
O2(g)=H2O(g) △H3=-241.5kJ·mol-1
N2(g)+O2(g)=2NO(g) △H4=+180.5kJ·mol-1
则△H1=____ kJ·mol-1。
②H2—SCR在Pt—HY催化剂表面的反应机理如图所示:
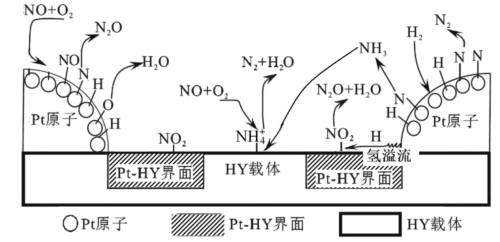
已知在HY载体表面发生反应的NO、O2物质的量之比为4∶1,反应中每生成1molN2,转移的电子的物质的量为___ mol。
(3)V2O5/炭基材料(活性炭、活性焦、活炭纤维)也可以脱硫脱硝。V2O5/炭基材料脱硫原理是:SO2在炭表面被吸附,吸附态SO2在炭表面被催化氧化为SO3,SO3再转化为硫酸盐等。
①V2O5/炭基材料脱硫时,通过红外光谱发现,脱硫开始后催化剂表面出现了VOSO4的吸收峰,再通入O2后VOSO4吸收峰消失,该脱硫反应过程可描述为____ 。
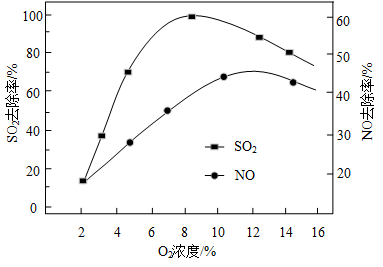
②V2O5/炭基材料脱硫时,控制一定气体流速和温度,考察了烟气中O2的存在对V2O5/炭基材料催化剂脱硫脱硝活性的影响,结果如图所示,当O2浓度过高时,去除率下降,其可能原因是_____ 。
(1)尿素/H2O2溶液脱硫脱硝。尿素[CO(NH2)2]是一种强还原剂。60℃时在一定浓度的尿素/H2O2溶液中通入含有SO2和NO的烟气,烟气中有毒气体被一定程度吸收。尿素/H2O2溶液对SO2具有很高的去除效率,写出尿素和H2O2溶液吸收SO2,生成硫酸铵和CO2的化学方程式为
(2)除去烟气中的NOx,利用氢气选择性催化还原(H2—SCR)是目前消除NO的理想方法。H2—SCR法的主反应:2NO(g)+2H2(g)=N2(g)+2H2O(g) △H1
副反应:2NO(g)+H2(g)=N2O(g)+H2O(g) △H2<0
①已知H2(g)+
 O2(g)=H2O(g) △H3=-241.5kJ·mol-1
O2(g)=H2O(g) △H3=-241.5kJ·mol-1N2(g)+O2(g)=2NO(g) △H4=+180.5kJ·mol-1
则△H1=
②H2—SCR在Pt—HY催化剂表面的反应机理如图所示:

已知在HY载体表面发生反应的NO、O2物质的量之比为4∶1,反应中每生成1molN2,转移的电子的物质的量为
(3)V2O5/炭基材料(活性炭、活性焦、活炭纤维)也可以脱硫脱硝。V2O5/炭基材料脱硫原理是:SO2在炭表面被吸附,吸附态SO2在炭表面被催化氧化为SO3,SO3再转化为硫酸盐等。
①V2O5/炭基材料脱硫时,通过红外光谱发现,脱硫开始后催化剂表面出现了VOSO4的吸收峰,再通入O2后VOSO4吸收峰消失,该脱硫反应过程可描述为
②V2O5/炭基材料脱硫时,控制一定气体流速和温度,考察了烟气中O2的存在对V2O5/炭基材料催化剂脱硫脱硝活性的影响,结果如图所示,当O2浓度过高时,去除率下降,其可能原因是

您最近一年使用:0次
2022-03-05更新
|
1516次组卷
|
7卷引用:江苏南京师范大学附属中学2022-2023学年高三一模适应性考试化学试题
江苏南京师范大学附属中学2022-2023学年高三一模适应性考试化学试题江苏省六校2021-2022学年高三下学期期初联合调研考试化学试题(已下线)黄金卷7-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(江苏卷)(已下线)必刷卷02-2022年高考化学考前信息必刷卷(江苏专用)(已下线)秘籍15 反应热、盖斯定律应用及图象分析-备战2022年高考化学抢分秘籍(全国通用)(已下线)专题17 原理综合题(已下线)化学-2023年高考押题预测卷03(江苏卷)(含考试版、全解全析、参考答案、答题卡)
名校
8 . 有机物催化脱氢制备氢气和化工原料是当前石化工业研究的重要课题之一、
(1)以甲烷、水蒸气为原料进行催化重整是制氢的常见方法之一,过程可能涉及反应:
CH4(g)+H2O(g)=CO(g)+3H2(g) △H1=+206.2 kJ∙mol−1
CO(g)+H2O(g)=CO2(g)+H2(g) △H2=−41.1 kJ∙mol−1
CH4(g)=C(g)+2H2(g) △H3=+74.8 kJ∙mol−1
①反应C(g)+2H2O(g)=CO2(g)+2H2(g) △H4=___________ kJ·mol-1
②向原料中添加正硅酸锂Li4SiO4作为CO2的吸附剂,除产生氢气外还生成两种盐,写出该反应的方程式___________ 。
(2)甲基环己烷催化脱氢(

 +3H2)是石油工业制氢常见方法,以Ni−Cu为催化剂,固定反应温度为650K,以氮气为载气,在不同载气流速情况下,甲基环己烷脱氢转化率如图1所示,b点转化率能与a点保持相当的原因是
+3H2)是石油工业制氢常见方法,以Ni−Cu为催化剂,固定反应温度为650K,以氮气为载气,在不同载气流速情况下,甲基环己烷脱氢转化率如图1所示,b点转化率能与a点保持相当的原因是___________ 。

(3)以H2O、CaBr2、Fe3O4为原料进行气固相反应可以实现水的分解制得氢气,其反应原理如图2所示。反应“①”中生成3molHBr,生成氢气的物质的量为_______ ,从原料到O2的生成过程可描述为_______ 。
(1)以甲烷、水蒸气为原料进行催化重整是制氢的常见方法之一,过程可能涉及反应:
CH4(g)+H2O(g)=CO(g)+3H2(g) △H1=+206.2 kJ∙mol−1
CO(g)+H2O(g)=CO2(g)+H2(g) △H2=−41.1 kJ∙mol−1
CH4(g)=C(g)+2H2(g) △H3=+74.8 kJ∙mol−1
①反应C(g)+2H2O(g)=CO2(g)+2H2(g) △H4=
②向原料中添加正硅酸锂Li4SiO4作为CO2的吸附剂,除产生氢气外还生成两种盐,写出该反应的方程式
(2)甲基环己烷催化脱氢(


 +3H2)是石油工业制氢常见方法,以Ni−Cu为催化剂,固定反应温度为650K,以氮气为载气,在不同载气流速情况下,甲基环己烷脱氢转化率如图1所示,b点转化率能与a点保持相当的原因是
+3H2)是石油工业制氢常见方法,以Ni−Cu为催化剂,固定反应温度为650K,以氮气为载气,在不同载气流速情况下,甲基环己烷脱氢转化率如图1所示,b点转化率能与a点保持相当的原因是
(3)以H2O、CaBr2、Fe3O4为原料进行气固相反应可以实现水的分解制得氢气,其反应原理如图2所示。反应“①”中生成3molHBr,生成氢气的物质的量为
您最近一年使用:0次
2021-12-14更新
|
970次组卷
|
4卷引用:江苏省南京市第九中学2023-2024学年高二上学期期末化学试卷
江苏省南京市第九中学2023-2024学年高二上学期期末化学试卷江苏省南通市海门区2021-2022学年高三第二次诊断测试化学试题(已下线)黄金卷6-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(江苏卷)(已下线)秘籍15 反应热、盖斯定律应用及图象分析-备战2022年高考化学抢分秘籍(全国通用)
名校
9 . (1)已知:25℃,101kP下,CO的燃烧热为283kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1
写出CO(g)和H2O(g)作用生成CO2和H2的热化学方程式:_______ 。
(2)CuCl2溶液显酸性,原因是_______ (用离子方程式回答);某温度下的CuCl2饱和溶液,升高温度,溶液中Cu2+浓度将_______ ,Cl-浓度将_______ ;若饱和溶液降温,析出固体的化学式为_______ ;若将溶液蒸干、灼烧得到固体的化学式为_______ 。
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1
写出CO(g)和H2O(g)作用生成CO2和H2的热化学方程式:
(2)CuCl2溶液显酸性,原因是
您最近一年使用:0次
名校
解题方法
10 . (1)一定量氢气与氯气反应生成氯化氢气体,当生成1 mol氢氯键时放出91.5 kJ的热量,写出该反应的热化学方程式______ 。
(2)已知1 mol C(石墨,s)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3 kJ热量,请写出该反应的热化学方程式:______ 。
(3)某反应的平衡常数K= ,如果有1 mol N2完全反应,要吸收热量68 kJ。写出该反应的热化学方程式
,如果有1 mol N2完全反应,要吸收热量68 kJ。写出该反应的热化学方程式______ 。
(4)实验中不能直接测出石墨和氢气生成甲烷反应的反应热,但可测出甲烷、石墨、氢气燃烧的反应热:
CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H1=-890.3 kJ/mol
C(石墨,s)+O2(g)=CO2(g) ;ΔH2=-393.5 kJ/mol
H2(g)+ O2(g)=H2O(l) ;△H3=-285.8 kJ/mol
O2(g)=H2O(l) ;△H3=-285.8 kJ/mol
则由石墨与氢气反应生成甲烷的热化学反应方程式为______ 。
(2)已知1 mol C(石墨,s)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3 kJ热量,请写出该反应的热化学方程式:
(3)某反应的平衡常数K=
 ,如果有1 mol N2完全反应,要吸收热量68 kJ。写出该反应的热化学方程式
,如果有1 mol N2完全反应,要吸收热量68 kJ。写出该反应的热化学方程式(4)实验中不能直接测出石墨和氢气生成甲烷反应的反应热,但可测出甲烷、石墨、氢气燃烧的反应热:
CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H1=-890.3 kJ/mol
C(石墨,s)+O2(g)=CO2(g) ;ΔH2=-393.5 kJ/mol
H2(g)+
 O2(g)=H2O(l) ;△H3=-285.8 kJ/mol
O2(g)=H2O(l) ;△H3=-285.8 kJ/mol则由石墨与氢气反应生成甲烷的热化学反应方程式为
您最近一年使用:0次



