解题方法
1 . (1)已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为
C(金刚石·s)+O2(g)=CO2(g)ΔH1=-395.41kJ/mol-1,
C(石墨·s)+O2(g)=CO2(g)ΔH2=-393.51kJ/mol-1,则金刚石转化为石墨时的热化学方程式:____ ,由此看来更稳定的碳的同素异形体为_____ 。
(2)某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。
已知:N2(g)+2O2(g)=2NO2(g)△H=+67.2kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式:_______
C(金刚石·s)+O2(g)=CO2(g)ΔH1=-395.41kJ/mol-1,
C(石墨·s)+O2(g)=CO2(g)ΔH2=-393.51kJ/mol-1,则金刚石转化为石墨时的热化学方程式:
(2)某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。
已知:N2(g)+2O2(g)=2NO2(g)△H=+67.2kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式:
您最近一年使用:0次
名校
2 . 雾霾主要成分为灰尘、 、
、 、有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一。
、有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一。
(1)以氨气为脱硝剂时,可将 还原为
还原为 。
。
已知:
i.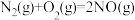 △H= a kJ·
△H= a kJ·
ii. △H= b kJ·
△H= b kJ·
则反应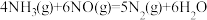 的 △H=
的 △H=______ kJ· 。
。
(2)臭氧也是理想的烟气脱硝剂,其脱硝反应之一为: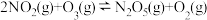 △H <0某温度时,在体积为1L的刚性密闭容器中充入2 mol
△H <0某温度时,在体积为1L的刚性密闭容器中充入2 mol 和1mol
和1mol 发生反应。
发生反应。
①在恒温恒容条件下,下列事实能够证明该反应已经达到平衡的是______ (填标号)。
A.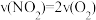 B.混合气体密度不再改变
B.混合气体密度不再改变
C. 的体积分数不再改变 D.
的体积分数不再改变 D. 与
与 的体积比不再改变
的体积比不再改变
②欲增加 的平衡转化率,可采取的措施有
的平衡转化率,可采取的措施有______ (填标号)。
A.充入氦气 B.升高温度
C.充入2 mol D.充入2 mol
D.充入2 mol  和1mol
和1mol 
③达到平衡时,混合气体总压为p, 的浓度为0.5
的浓度为0.5 ,则
,则 的转化率为
的转化率为____ ,平衡常数Kp=______ (以分压表示,分压=总压×物质的量分数)。
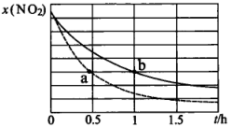
④若在不同压强下进行反应,体系中 物质的量分数x(
物质的量分数x( )与反应时间的关系如图所示,a、b两点的压强商Qp(以分压表示)较大的是
)与反应时间的关系如图所示,a、b两点的压强商Qp(以分压表示)较大的是______ (填“a”或“b”)。
 、
、 、有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一。
、有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一。(1)以氨气为脱硝剂时,可将
 还原为
还原为 。
。已知:
i.
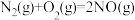 △H= a kJ·
△H= a kJ·
ii.
 △H= b kJ·
△H= b kJ·
则反应
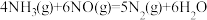 的 △H=
的 △H= 。
。(2)臭氧也是理想的烟气脱硝剂,其脱硝反应之一为:
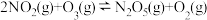 △H <0某温度时,在体积为1L的刚性密闭容器中充入2 mol
△H <0某温度时,在体积为1L的刚性密闭容器中充入2 mol 和1mol
和1mol 发生反应。
发生反应。①在恒温恒容条件下,下列事实能够证明该反应已经达到平衡的是
A.
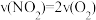 B.混合气体密度不再改变
B.混合气体密度不再改变C.
 的体积分数不再改变 D.
的体积分数不再改变 D. 与
与 的体积比不再改变
的体积比不再改变②欲增加
 的平衡转化率,可采取的措施有
的平衡转化率,可采取的措施有A.充入氦气 B.升高温度
C.充入2 mol
 D.充入2 mol
D.充入2 mol  和1mol
和1mol 
③达到平衡时,混合气体总压为p,
 的浓度为0.5
的浓度为0.5 ,则
,则 的转化率为
的转化率为④若在不同压强下进行反应,体系中
 物质的量分数x(
物质的量分数x( )与反应时间的关系如图所示,a、b两点的压强商Qp(以分压表示)较大的是
)与反应时间的关系如图所示,a、b两点的压强商Qp(以分压表示)较大的是
您最近一年使用:0次
2021-02-01更新
|
1007次组卷
|
3卷引用:福建省龙岩市2020-2021学年高二上学期期末考试化学试题
名校
3 . (1)一种分解海水制氢气的方法为2H2O(l)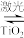 2H2(g)+O2(g)。如图为此反应的能量变化示意图,使用催化剂TiO2后图中A点将
2H2(g)+O2(g)。如图为此反应的能量变化示意图,使用催化剂TiO2后图中A点将___ (填“升高、降低或不变”)。
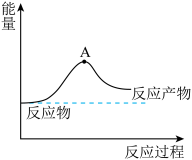
(2)已知:
①2H2(g)+O2(g)=2H2O(g)ΔH1=-483.6kJ·mol-1
②H2O(g)=H2O(l)ΔH2=-44kJ·mol-1
反应①中化学键的键能数据如表:
由此计算a=___ kJ·mol-1;氢气的燃烧热ΔH=___ kJ·mol-1。
(3)1gC(s,石墨)与适量水蒸气反应生成CO和H2,需要吸收10.94kJ热量,此反应的热化学方程式为___ 。
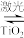 2H2(g)+O2(g)。如图为此反应的能量变化示意图,使用催化剂TiO2后图中A点将
2H2(g)+O2(g)。如图为此反应的能量变化示意图,使用催化剂TiO2后图中A点将
(2)已知:
①2H2(g)+O2(g)=2H2O(g)ΔH1=-483.6kJ·mol-1
②H2O(g)=H2O(l)ΔH2=-44kJ·mol-1
反应①中化学键的键能数据如表:
| 化学键 | H-H | O=O | H-O |
| E/(kJ·mol-1) | a | 498 | 465 |
(3)1gC(s,石墨)与适量水蒸气反应生成CO和H2,需要吸收10.94kJ热量,此反应的热化学方程式为
您最近一年使用:0次
解题方法
4 . 写出下列反应的热化学方程式:
(1)N2(g)和H2(g)反应生成1mol NH3(g),放出46.1kJ热量_____ 。
(2)46g C2H5OH(l)完全燃烧生成CO2(g)和H2O(l)放出1366.8 kJ热量_____ 。
(3)已知断裂1molH2(g)中的H-H键需要吸收436kJ的能量,断裂1molO2(g)中的共价键需要吸收498kJ的能量,生成H2O(g)中1molH-O键能放出463kJ的能量,试着写出O2(g)与H2(g)反应生成H2O(g)的热化学方程式________ 。.
(4)到目前为止,由化学能转变的热能或电能仍然是人类使用的主要的能源。
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);ΔH=-25kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);ΔH=-47kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g);ΔH=+19kJ/mol
请写出CO还原FeO的热化学方程式______ 。
(1)N2(g)和H2(g)反应生成1mol NH3(g),放出46.1kJ热量
(2)46g C2H5OH(l)完全燃烧生成CO2(g)和H2O(l)放出1366.8 kJ热量
(3)已知断裂1molH2(g)中的H-H键需要吸收436kJ的能量,断裂1molO2(g)中的共价键需要吸收498kJ的能量,生成H2O(g)中1molH-O键能放出463kJ的能量,试着写出O2(g)与H2(g)反应生成H2O(g)的热化学方程式
(4)到目前为止,由化学能转变的热能或电能仍然是人类使用的主要的能源。
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);ΔH=-25kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);ΔH=-47kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g);ΔH=+19kJ/mol
请写出CO还原FeO的热化学方程式
您最近一年使用:0次
5 . 请完成下列热化学方程式:
(1)1mol N2(气态)与适量O2(气态)起反应,生成NO2(气态),需吸收68kJ的热量___ ;
(2)卫星发射时可用N2H4为燃料。32gN2H4(气态)在O2(气态)中燃烧,生成N2(气态)和H2O(气态),放出534kJ的热量___ ;
(3)已知氢气和氧气反应生成1mol水蒸气放热241.8kJ,若1g水蒸气转化为液态水放热2.444kJ,写出氢气和氧气反应生成液态水的热化学方程式___ ;
(4)已知:键能(H2—436kJ/mol,N2—946kJ/mol,N-H—391kJ/mol)请写出氮气与氢气合成氨气的热化学方程式___ 。
(1)1mol N2(气态)与适量O2(气态)起反应,生成NO2(气态),需吸收68kJ的热量
(2)卫星发射时可用N2H4为燃料。32gN2H4(气态)在O2(气态)中燃烧,生成N2(气态)和H2O(气态),放出534kJ的热量
(3)已知氢气和氧气反应生成1mol水蒸气放热241.8kJ,若1g水蒸气转化为液态水放热2.444kJ,写出氢气和氧气反应生成液态水的热化学方程式
(4)已知:键能(H2—436kJ/mol,N2—946kJ/mol,N-H—391kJ/mol)请写出氮气与氢气合成氨气的热化学方程式
您最近一年使用:0次
名校
6 . (1)已知:①N2(g)+2O2(g)=N2O4(l)∆H1=-195kJ•mol-1 ②N2H4(l)+O2(g)=N2(g)+2H2O(g)∆H2=-534kJ•mol-1;写出液态肼和N2O4(l)反应生成N2和水蒸气的热化学方程式:______
(2)通常人们把断裂1mol某化学键所吸收的能量或形成1mol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热ΔH。已知部分化学键的键能数据如表所示:
则H2(g)+Cl2(g)=2HCl(g)的反应热ΔH为_______
(3)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
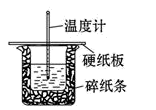
①从实验装置上看,图中尚缺少的一种玻璃用品是______ 。缺少用品不能改为金属(如铜),其原因是_________ 。
②烧杯间填满碎纸条的作用是_________ 。
③用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值 会______ 。(填“偏大”、“偏小”、“无影响”)。
(2)通常人们把断裂1mol某化学键所吸收的能量或形成1mol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热ΔH。已知部分化学键的键能数据如表所示:
| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能/(kJ·mol-1) | 436 | 243 | 431 |
(3)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

①从实验装置上看,图中尚缺少的一种玻璃用品是
②烧杯间填满碎纸条的作用是
③用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的
您最近一年使用:0次
2020-11-28更新
|
138次组卷
|
3卷引用:福建省永安市第一中学2020-2021学年高二上学期期中考试化学试题
名校
解题方法
7 . 近年来,随着聚酯工业的快速发展,将氯化氢转化为氯气的技术成为科学研究的热点。传统的 Deacon 直接氧化法,按下列催化过程进行:
4HCl(g) + O2(g) 2Cl2(g)+2H2O(g)
2Cl2(g)+2H2O(g)
(1)写出上述反应的平衡常数表达式 K=_____ 。
(2)生产过程中可使用CuCl2作催化剂,反应原理如下 :
CuCl2(s)+ O2(g)=CuO(s)+ Cl2(g) ΔH1= + 63 kJ·mol-1
O2(g)=CuO(s)+ Cl2(g) ΔH1= + 63 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH2= - 121 kJ·mol-1
则 4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) 的 ΔH=
2Cl2(g)+2H2O(g) 的 ΔH=_____ kJ·mol-1。
(3)420℃时,将一定量的 O2和 HCl 通入 4L 的恒容密闭容器中,反应过程中氧气的变化量如图所示,则平衡时 O2的转化率为_____ 。

4HCl(g) + O2(g)
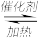 2Cl2(g)+2H2O(g)
2Cl2(g)+2H2O(g)(1)写出上述反应的平衡常数表达式 K=
(2)生产过程中可使用CuCl2作催化剂,反应原理如下 :
CuCl2(s)+
 O2(g)=CuO(s)+ Cl2(g) ΔH1= + 63 kJ·mol-1
O2(g)=CuO(s)+ Cl2(g) ΔH1= + 63 kJ·mol-1CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH2= - 121 kJ·mol-1
则 4HCl(g)+O2(g)
 2Cl2(g)+2H2O(g) 的 ΔH=
2Cl2(g)+2H2O(g) 的 ΔH=(3)420℃时,将一定量的 O2和 HCl 通入 4L 的恒容密闭容器中,反应过程中氧气的变化量如图所示,则平衡时 O2的转化率为

您最近一年使用:0次
2020-11-12更新
|
189次组卷
|
2卷引用:福建省厦门市湖滨中学2021-2022学年高二上学期期中考试化学试题
名校
8 . 用CO与H2反应合成甲醇符合原子经济的绿色化学理念,反应过程中能量变化如图所示。

(1)请写出CO与H2反应合成甲醇的热化学方程式__ ;
(2)该反应中相关的化学键键能数据如表所示:则C=O中的键能为__ kJ/mol;
(3)图中曲线I和II所对应的反应路径,比较容易发生的是__ (填I或II);
(4)工业上可利用CO2和H2生成甲醇,热化学方程式如下:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=Q1kJ/mol
又查资料得知:①CH3OH(l)+ O2(g)=CO2(g)+2H2(g)△H2=Q2kJ/mol
O2(g)=CO2(g)+2H2(g)△H2=Q2kJ/mol
②H2O(g)=2H2O(l)△H=Q3kJ/mol
则表示甲醇的燃烧热的热化学方程式为__ 。

(1)请写出CO与H2反应合成甲醇的热化学方程式
(2)该反应中相关的化学键键能数据如表所示:则C=O中的键能为
| 化学键 | H-H | C-O | H-O | C-H |
| E/(kJ/mol) | 436 | 343 | 465 | 413 |
(4)工业上可利用CO2和H2生成甲醇,热化学方程式如下:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=Q1kJ/mol
又查资料得知:①CH3OH(l)+
 O2(g)=CO2(g)+2H2(g)△H2=Q2kJ/mol
O2(g)=CO2(g)+2H2(g)△H2=Q2kJ/mol②H2O(g)=2H2O(l)△H=Q3kJ/mol
则表示甲醇的燃烧热的热化学方程式为
您最近一年使用:0次
2020-10-24更新
|
256次组卷
|
2卷引用:福建省厦门第一中学2020-2021学年高二10月月考化学试题
名校
解题方法
9 . I.下图表示某反应的能量变化关系
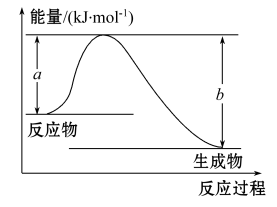
(1)此反应为__________ (填“吸热”或“放热”)反应,
(2)ΔH=_____________ (用含有a、b的关系式表示)。
II.联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。
已知:①2O2(g)+N2(g)==N2O4(l) ΔH1
②N2(g)+2H2(g)==N2H4(l) ΔH2
③O2(g)+2H2(g)==2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)==3N2(g)+4H2O(g) ΔH4
(3)上述反应热效应之间的关系式为ΔH4=__________ 。
III.恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示。
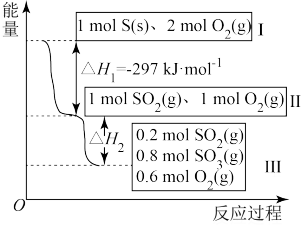
已知:2SO2(g)+O2(g)⇌2SO3(g) ΔH=-196.6 kJ·mol-1
(4)写出硫燃烧的热化学方程式:___________ 。
(5)ΔH2=______ kJ·mol-1。

(1)此反应为
(2)ΔH=
II.联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。
已知:①2O2(g)+N2(g)==N2O4(l) ΔH1
②N2(g)+2H2(g)==N2H4(l) ΔH2
③O2(g)+2H2(g)==2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)==3N2(g)+4H2O(g) ΔH4
(3)上述反应热效应之间的关系式为ΔH4=
III.恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示。
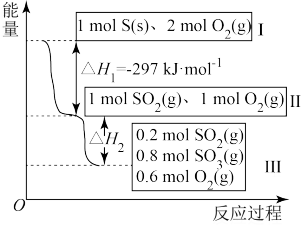
已知:2SO2(g)+O2(g)⇌2SO3(g) ΔH=-196.6 kJ·mol-1
(4)写出硫燃烧的热化学方程式:
(5)ΔH2=
您最近一年使用:0次
2020-10-24更新
|
300次组卷
|
2卷引用:福建省南平市建阳第二中学2022-2023学年高二上学期第一次月考化学试题
解题方法
10 . 为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。
已知:2CO(g)+O2(g)=2CO2(g);ΔH=-566kJ·mol-1
2H2(g)+O2(g)=2H2O(g);ΔH=-483.6KJ·moL-1
(1)CO的燃烧热△H=___ kJ·moL-1。
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式:___ 。
(3)H2是一种理想的绿色能源,可作燃料电池;若电池以20%~30%的KOH溶液为电解质溶液,该氢氧燃料电池放电时:正极的电极反应式是___ ,负极的电极反应式是___ 。
已知:2CO(g)+O2(g)=2CO2(g);ΔH=-566kJ·mol-1
2H2(g)+O2(g)=2H2O(g);ΔH=-483.6KJ·moL-1
(1)CO的燃烧热△H=
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式:
(3)H2是一种理想的绿色能源,可作燃料电池;若电池以20%~30%的KOH溶液为电解质溶液,该氢氧燃料电池放电时:正极的电极反应式是
您最近一年使用:0次



