名校
1 . 研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s) + CO2(g) = 2Fe3O4(s) + C(s) △H= —76.0kJ/mol
C(s) + 2H2O(g) = CO2(g) + 2H2(g) △H= + 113.4kJ/mol
写出FeO(s)和H2O(g)生成Fe3O4(s)和H2(g)的热化学方程式________ 。
(2)如图为1 mol NO2(g)和1 mol CO(g)反应生成NO(g)和CO2(g)过程中的能量变化示意图。已知E1=134 kJ·mol-1,E2=368 kJ·mol-1(E1、E2为反应的活化能)。
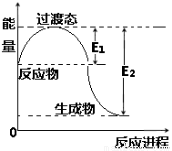
若在反应体系中加入催化剂,反应速率增大,则E1、ΔH的变化分别是________ 、________ (填“增大”、“减小”或“不变”);该反应放出的热量为__________ kJ。
(3)若反应SO2(g)+I2(g)+2H2O(g) ═ H2SO4(l)+2HI(g)在150 ℃下能自发进行,则ΔH____________ 0 (填“大于”、“ 小于”或“大于或小于都可”)。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s) + CO2(g) = 2Fe3O4(s) + C(s) △H= —76.0kJ/mol
C(s) + 2H2O(g) = CO2(g) + 2H2(g) △H= + 113.4kJ/mol
写出FeO(s)和H2O(g)生成Fe3O4(s)和H2(g)的热化学方程式
(2)如图为1 mol NO2(g)和1 mol CO(g)反应生成NO(g)和CO2(g)过程中的能量变化示意图。已知E1=134 kJ·mol-1,E2=368 kJ·mol-1(E1、E2为反应的活化能)。

若在反应体系中加入催化剂,反应速率增大,则E1、ΔH的变化分别是
(3)若反应SO2(g)+I2(g)+2H2O(g) ═ H2SO4(l)+2HI(g)在150 ℃下能自发进行,则ΔH
您最近一年使用:0次
名校
2 . 研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为_____________________
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6kJ·mol-1
2SO3(g) ΔH=-196.6kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g) 的ΔH=
SO3(g)+NO(g) 的ΔH=________ kJ·mol-1
(3)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=________ (保留两位小数)
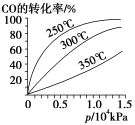
(4)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH________ 0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是____________________
(1)NO2可用水吸收,相应的化学反应方程式为
(2)已知:2SO2(g)+O2(g)
 2SO3(g) ΔH=-196.6kJ·mol-1
2SO3(g) ΔH=-196.6kJ·mol-1 2NO(g)+O2(g)
 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1 则反应NO2(g)+SO2(g)
 SO3(g)+NO(g) 的ΔH=
SO3(g)+NO(g) 的ΔH=(3)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=
(4)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)
 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH
您最近一年使用:0次
2018-11-27更新
|
194次组卷
|
3卷引用:福建省漳州市长泰县第一中学2019-2020学年高二10月月考化学试题
3 . 已知: ①P4(S,白磷)+5O2(g)= P4O10(S)△H = —2983.2kJ•mol-1
②P(S,红磷)+5/4O2(g)=1/4P4O10(s) △H = —738.5kJ•mol-1
(1)写出白磷转化为红磷的热化学方程式:___________________________________ 。
(2)则对应下列化学反应过程中的能量变化图,能正确反映出由白磷转化为红磷的是[选填A~D]________ 。

②P(S,红磷)+5/4O2(g)=1/4P4O10(s) △H = —738.5kJ•mol-1
(1)写出白磷转化为红磷的热化学方程式:
(2)则对应下列化学反应过程中的能量变化图,能正确反映出由白磷转化为红磷的是[选填A~D]

您最近一年使用:0次
名校
4 . 当前能源危机是一个全球性问题,开源节流是应对能源危机的重要举措。
(1)下列做法有利于能源“开源节流”的是________ (填字母)。
A.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
B.大力开采煤、石油和天然气以满足人们日益增长的能源需求
C.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
D.减少资源消耗,加大资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。则在通常状况下,金刚石和石墨相比较,________ (填“金刚石”或“石墨”)更稳定,石墨的燃烧热ΔH=________ 。
(3)已知:N2、O2分子中化学键的键能分别是946 kJ/mol、497kJ/mol。N2(g)+O2(g)=2NO(g) ΔH=+180kJ/mol。NO分子中化学键的键能为__________________ kJ/mol。
(4)综合上述有关信息,请写出用CO除去NO生成无污染气体的热化学方程式:________________ 。
(5)已知Na2SO4·10H2O Na2SO4·nH2O+(10-n)H2O。将装有芒硝(Na2SO4·10H2O)的密闭聚乙烯管安装在房屋的外墙内就能达到白天蓄热,使室内保持较低温度,晚上把白天所蓄的热量放出,使室内保持温暖的目的。则白天和晚上的能量转化方式是白天将
Na2SO4·nH2O+(10-n)H2O。将装有芒硝(Na2SO4·10H2O)的密闭聚乙烯管安装在房屋的外墙内就能达到白天蓄热,使室内保持较低温度,晚上把白天所蓄的热量放出,使室内保持温暖的目的。则白天和晚上的能量转化方式是白天将________ 能转化为________ 能,晚上将________ 能转化为________ 能。
(1)下列做法有利于能源“开源节流”的是
A.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
B.大力开采煤、石油和天然气以满足人们日益增长的能源需求
C.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
D.减少资源消耗,加大资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。则在通常状况下,金刚石和石墨相比较,

(3)已知:N2、O2分子中化学键的键能分别是946 kJ/mol、497kJ/mol。N2(g)+O2(g)=2NO(g) ΔH=+180kJ/mol。NO分子中化学键的键能为
(4)综合上述有关信息,请写出用CO除去NO生成无污染气体的热化学方程式:
(5)已知Na2SO4·10H2O
 Na2SO4·nH2O+(10-n)H2O。将装有芒硝(Na2SO4·10H2O)的密闭聚乙烯管安装在房屋的外墙内就能达到白天蓄热,使室内保持较低温度,晚上把白天所蓄的热量放出,使室内保持温暖的目的。则白天和晚上的能量转化方式是白天将
Na2SO4·nH2O+(10-n)H2O。将装有芒硝(Na2SO4·10H2O)的密闭聚乙烯管安装在房屋的外墙内就能达到白天蓄热,使室内保持较低温度,晚上把白天所蓄的热量放出,使室内保持温暖的目的。则白天和晚上的能量转化方式是白天将
您最近一年使用:0次
名校
解题方法
5 . 一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI(g) H2(g)+I2(g)△H > 0,H2物质的量随时间的变化如图所示。
H2(g)+I2(g)△H > 0,H2物质的量随时间的变化如图所示。
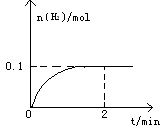
(1)2 min时HI的转化率a(HI)=____________________ 。该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K=
2HI(g)的平衡常数K=________________ 。
(2)下列哪种情况能说明该反应已经达到平衡状态( )
A.气体的密度不再变化了
B.气体的颜色不再变化了
C.气体的总压强不再变化了
D.相同时间内消耗氢气的质量和生成碘的质量相等
E.单位时间内消耗氢气和消耗碘化氢的物质的量相等
F.氢气的质量分数不变了
(3)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g) 2C(g)+D(s)反应,该反应的平衡常数的表达式K=
2C(g)+D(s)反应,该反应的平衡常数的表达式K=____________________ ,按下表数据投料:
反应达到平衡状态,测得体系压强升高。该反应△H____ 0(填“>”、“<” 或者“=”),简述该反应的平衡常数与温度的变化关系:__________________________________________________ 。
(4)该反应如果把D的物质的量增大一倍,逆反应速率________ (填“增大”、“减小” 或者“不变”)。
 H2(g)+I2(g)△H > 0,H2物质的量随时间的变化如图所示。
H2(g)+I2(g)△H > 0,H2物质的量随时间的变化如图所示。
(1)2 min时HI的转化率a(HI)=
 2HI(g)的平衡常数K=
2HI(g)的平衡常数K=(2)下列哪种情况能说明该反应已经达到平衡状态
A.气体的密度不再变化了
B.气体的颜色不再变化了
C.气体的总压强不再变化了
D.相同时间内消耗氢气的质量和生成碘的质量相等
E.单位时间内消耗氢气和消耗碘化氢的物质的量相等
F.氢气的质量分数不变了
(3)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)
 2C(g)+D(s)反应,该反应的平衡常数的表达式K=
2C(g)+D(s)反应,该反应的平衡常数的表达式K=| 物质 | A | B | C | D |
| 起始投料/mol | 2 | 1 | 2 | 0 |
反应达到平衡状态,测得体系压强升高。该反应△H
(4)该反应如果把D的物质的量增大一倍,逆反应速率
您最近一年使用:0次
名校
解题方法
6 . 回答下列问题:
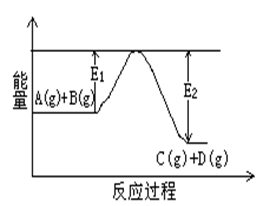
(1)反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图 所示,判断该反应△H
C(g)+D(g)过程中的能量变化如图 所示,判断该反应△H___________ 0 (填“>”、“<”、“无法确定”)。
(2)在Al2O3、Ni催化下气态甲酸发生下列反应:
甲酸(g)= CO (g)+ H2O (g) △H1= + 34.0 kJ/mol
甲酸(g)= CO2 (g)+ H2(g) △H2= —7.0 kJ/mol
则甲酸的分子式为____________ ,在该条件下,气态CO2 和气态H2 生成气态CO和气态H2O的热化学方程式为 __________________________________________________________________ 。
(3)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水(H2O2)。当把0.4mol液态肼和0.8mol 液态H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。反应的热化学方程式为:____________________________________________________________________________ 。
(1)反应A(g)+B(g)
 C(g)+D(g)过程中的能量变化如图 所示,判断该反应△H
C(g)+D(g)过程中的能量变化如图 所示,判断该反应△H
(2)在Al2O3、Ni催化下气态甲酸发生下列反应:
甲酸(g)= CO (g)+ H2O (g) △H1= + 34.0 kJ/mol
甲酸(g)= CO2 (g)+ H2(g) △H2= —7.0 kJ/mol
则甲酸的分子式为
(3)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水(H2O2)。当把0.4mol液态肼和0.8mol 液态H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。反应的热化学方程式为:
您最近一年使用:0次
名校
解题方法
7 . 二氧化碳在石油开采、人工降雨、消防、有机合成等领域有着广泛的应用。
(1)甲醇是重要的化工原料。利用合成气(CO、CO2、H2)在催化剂作用下合成甲醇,已知反应相关的化学键键能数据如下:
写出CO2和H2在催化剂作用下生成CH3OH(g)和H2O(g)的热化学方程式________
(2)CH4超干重整CO2的催化转化原理示意图如图所示:
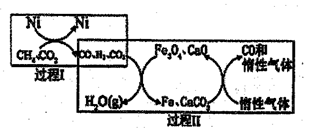
①过程Ⅰ,生成1molH2时吸收123.5kJ热量,其热化学方程式是_______
②过程Ⅱ,实现了含然物种与含碳物种的分离,生成H2O(g)的化学方程式是________
(1)甲醇是重要的化工原料。利用合成气(CO、CO2、H2)在催化剂作用下合成甲醇,已知反应相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| E/(KJ/mol) | 436 | 343 | 803 | 465 | 413 |
写出CO2和H2在催化剂作用下生成CH3OH(g)和H2O(g)的热化学方程式
(2)CH4超干重整CO2的催化转化原理示意图如图所示:

①过程Ⅰ,生成1molH2时吸收123.5kJ热量,其热化学方程式是
②过程Ⅱ,实现了含然物种与含碳物种的分离,生成H2O(g)的化学方程式是
您最近一年使用:0次
名校
8 . 已知氨气在生活、生产、科研中有极广泛用途。
(1)已知反应Ⅰ:2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=﹣159.5kJ/mol
反应Ⅱ:NH2CO2NH4(s)═CO(NH2)2 (s)+H2O(g)△H= + 116.5kJ/mol
反应Ⅲ:H2O(l)═H2O(g)△H= + 44.0kJ/mol
工业上以CO2、NH3为原料合成尿素和液态水 的热化学方程式为___________________ ,该反应在_________ 条件下可以自发进行(填“高温”、“低温”或“任何温度下”);
(2)查阅资料可知:常温下,K稳[Ag(NH3)2+]=1.00×107,Ksp[AgCl]=2.50×10﹣10.
①银氨溶液中存在平衡:Ag+(aq)+2NH3(aq) Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=
Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=_______________ ;
②计算得到可逆反应AgCl (s)+2NH3(aq) Ag(NH3)2+ (aq)+Cl﹣(aq)的化学平衡常数K=
Ag(NH3)2+ (aq)+Cl﹣(aq)的化学平衡常数K=_________________________ ;在1L浓度为1mol/L氨水中最多可以溶解AgCl为_______ mol(保留2位有效数字)。
(1)已知反应Ⅰ:2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=﹣159.5kJ/mol
反应Ⅱ:NH2CO2NH4(s)═CO(NH2)2 (s)+H2O(g)△H= + 116.5kJ/mol
反应Ⅲ:H2O(l)═H2O(g)△H= + 44.0kJ/mol
工业上以CO2、NH3为原料合成尿素和
(2)查阅资料可知:常温下,K稳[Ag(NH3)2+]=1.00×107,Ksp[AgCl]=2.50×10﹣10.
①银氨溶液中存在平衡:Ag+(aq)+2NH3(aq)
 Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=
Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=②计算得到可逆反应AgCl (s)+2NH3(aq)
 Ag(NH3)2+ (aq)+Cl﹣(aq)的化学平衡常数K=
Ag(NH3)2+ (aq)+Cl﹣(aq)的化学平衡常数K=
您最近一年使用:0次
2017-12-31更新
|
196次组卷
|
2卷引用:【全国百强校】福建省三明市第一中学2018-2019学年高二上学期第二次月考化学试题
名校
9 . (1)火箭推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢(H2O2),当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65 kJ的热量。
①写出反应的热化学方程式:________________________________ ,其中氧化剂是____________ ,若反应中当有1molN2生成时转移的电子物质的量是__________ 。
②此反应用于火箭推进,除释放大量热和产生气体外,还有一个很大的优点是___________ 。
(2)已知:2CO(g) + O2(g) = 2CO2(g) △H= -566 kJ/mol
Na2O2(s) + CO2(g) = Na2CO3(s) + O2(g) △H= -226 kJ/mol
O2(g) △H= -226 kJ/mol
请写出常温下,过氧化钠与一氧化碳反应生成碳酸钠的热化学方程式:____________________ 。
(3)中学化学实验中的中和热的测定所需的玻璃仪器除了大烧杯、小烧杯、量筒外还有:_____ ,在大小烧杯之间填满碎泡沫(或纸条)其作用是_____ 。
①写出反应的热化学方程式:
②此反应用于火箭推进,除释放大量热和产生气体外,还有一个很大的优点是
(2)已知:2CO(g) + O2(g) = 2CO2(g) △H= -566 kJ/mol
Na2O2(s) + CO2(g) = Na2CO3(s) +
 O2(g) △H= -226 kJ/mol
O2(g) △H= -226 kJ/mol请写出常温下,过氧化钠与一氧化碳反应生成碳酸钠的热化学方程式:
(3)中学化学实验中的中和热的测定所需的玻璃仪器除了大烧杯、小烧杯、量筒外还有:
您最近一年使用:0次
解题方法
10 . (1)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6),丙烷脱氢可得丙烯。
已知:C3H8(g) → CH4(g) + HC≡CH(g) + H2(g) △H1=+156.6 kJ·mol-1
CH3CH=CH2(g) → CH4(g) + HC≡CH(g) △H2=+32.4 kJ·mol-1
则相同条件下,反应C3H8(g) → CH3CH=CH2(g) + H2(g)的△H=___________ kJ·mol-1;
(2)已知H2(g) + Br2(l) = 2HBr(g) ΔH=-72 kJ/mol,蒸发1 mol Br2(l)需要吸收的能量为30 kJ。
则反应:H2(g) + Br2(g) = 2HBr(g) ΔH=____________ kJ/mol,若断裂1 mol H2(g)分子中的化学键需要吸收能量436kJ, 断裂1 mol HBr(g)分子中的化学键需要吸收能量369kJ,则断裂1 mol Br2(g)分子中的化学键需要吸收的能量为:____________ kJ。
已知:C3H8(g) → CH4(g) + HC≡CH(g) + H2(g) △H1=+156.6 kJ·mol-1
CH3CH=CH2(g) → CH4(g) + HC≡CH(g) △H2=+32.4 kJ·mol-1
则相同条件下,反应C3H8(g) → CH3CH=CH2(g) + H2(g)的△H=
(2)已知H2(g) + Br2(l) = 2HBr(g) ΔH=-72 kJ/mol,蒸发1 mol Br2(l)需要吸收的能量为30 kJ。
则反应:H2(g) + Br2(g) = 2HBr(g) ΔH=
您最近一年使用:0次
2017-12-05更新
|
139次组卷
|
2卷引用:福建省东山第二中学2017-2018学年高二上学期期中考试化学试题



