名校
1 . 多晶硅是制作光伏电池的关键材料。以下是由粗硅制备多晶硅的简易过程。

回答下列问题:
(1)硅粉与HCl在300℃时反应生成SiHCl3气体和H2,当有1gSi反应时放出8.4kJ热量,该反应的热化学方程式为____ 。
(2)将SiCl4氢化为SiHCl3有三种方法,对应的反应依次为:
①SiCl4(g)+H2(g) SiHCl3(g)+HCl(g) △H1>0
SiHCl3(g)+HCl(g) △H1>0
②3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g) △H2<0
4SiHCl3(g) △H2<0
③2SiCl4(g)+H2(g)+Si(s)+HCl(g) 3SiHCl3(g) △H3
3SiHCl3(g) △H3
反应③的△H3____ 0(填“>”或“<”)。
(3)由粗硅制备多晶硅过程中循环使用的物质除SiCl4、SiHCl3、Si外,还有____ (填化学式)。
(4)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能,利用键能可以衡量化学键的强弱,也可以计算化学反应的焓变。已知:
则SiO2与SiC中比较稳定的是____ (填化学式),工业上高纯硅可以通过下列反应制取:SiCl4(g)+2H2(g)=Si(s)+4HCl(g),该反应的△H=____ 。(提示:1mol晶体Si中含有2molSi-Si键)

回答下列问题:
(1)硅粉与HCl在300℃时反应生成SiHCl3气体和H2,当有1gSi反应时放出8.4kJ热量,该反应的热化学方程式为
(2)将SiCl4氢化为SiHCl3有三种方法,对应的反应依次为:
①SiCl4(g)+H2(g)
 SiHCl3(g)+HCl(g) △H1>0
SiHCl3(g)+HCl(g) △H1>0②3SiCl4(g)+2H2(g)+Si(s)
 4SiHCl3(g) △H2<0
4SiHCl3(g) △H2<0③2SiCl4(g)+H2(g)+Si(s)+HCl(g)
 3SiHCl3(g) △H3
3SiHCl3(g) △H3反应③的△H3
(3)由粗硅制备多晶硅过程中循环使用的物质除SiCl4、SiHCl3、Si外,还有
(4)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能,利用键能可以衡量化学键的强弱,也可以计算化学反应的焓变。已知:
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
您最近一年使用:0次
2022-09-25更新
|
266次组卷
|
4卷引用:福建省泉州第五中学2022-2023学年高二上学期期中考化学试题
解题方法
2 . 已知下列热化学方程式:
2Zn(s)+O2(g)=2ZnO(s) ΔH1=-702.2kJ·molˉl
2Hg(l)+O2(g)=2HgO(s) ΔH2=-181.4kJ·molˉl
由此可知Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH=___________ kJ·molˉl
2Zn(s)+O2(g)=2ZnO(s) ΔH1=-702.2kJ·molˉl
2Hg(l)+O2(g)=2HgO(s) ΔH2=-181.4kJ·molˉl
由此可知Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH=
您最近一年使用:0次
3 . 合成氨技术的发明使工业化人工固氮成为现实。请回答下列问题:
(1)合成氨的反应为:2NH3(g) N2(g)+3H2(g),有关化学键的键能如表所示。
N2(g)+3H2(g),有关化学键的键能如表所示。
①该反应的反应热ΔH=_______ 。
②已知该反应的ΔS=198.9 J·mol−1·K−1,在下列哪些温度下反应能自发进行?_______ (填标号)
A.25℃ B.125℃ C.225℃ D.325℃
(2)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为3.0 mol。
①达平衡时,H2的转化率α=_______ 。
②已知平衡时,容器压强为8 MPa,则平衡常数Kp=_______ (用平衡分压代替浓度计算,分压=总压×物质的量分数)。
(3)利用电解原理,将氨转化为高纯氢气,其装置如图所示。
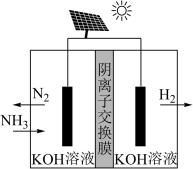
①阴极产生标准状况下112mL气体时,通过阴离子交换膜的离子的物质的量为_______ ;
②阳极的电极反应式为_______ 。
(1)合成氨的反应为:2NH3(g)
 N2(g)+3H2(g),有关化学键的键能如表所示。
N2(g)+3H2(g),有关化学键的键能如表所示。| 化学键 |  |  |  |
| 键能E/ kJ·mol−1 | 946 | 436.0 | 390.8 |
②已知该反应的ΔS=198.9 J·mol−1·K−1,在下列哪些温度下反应能自发进行?
A.25℃ B.125℃ C.225℃ D.325℃
(2)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为3.0 mol。
①达平衡时,H2的转化率α=
②已知平衡时,容器压强为8 MPa,则平衡常数Kp=
(3)利用电解原理,将氨转化为高纯氢气,其装置如图所示。

①阴极产生标准状况下112mL气体时,通过阴离子交换膜的离子的物质的量为
②阳极的电极反应式为
您最近一年使用:0次
2022-09-06更新
|
281次组卷
|
3卷引用:福建省宁德市部分达标中学2021-2022学年高二上学期期中联合考试化学试题
名校
解题方法
4 . 汽车内燃机工作时引起反应: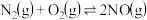 ,是导致汽车尾气中含有NO的原因之一、已知断裂某些共价键需要的能量如表:
,是导致汽车尾气中含有NO的原因之一、已知断裂某些共价键需要的能量如表:
(1)机动车发动机工作时会引发 和
和 的反应,该反应是
的反应,该反应是_______ (填“放热”或“吸热”)反应。
(2) 与
与 合成NO的热化学方程式可以表示为
合成NO的热化学方程式可以表示为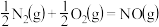
 ,则
,则
_______ 。
(3)NO与CO反应的热化学方程式可以表示为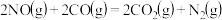
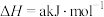 ,但该反应的速率很小,若使用机动车尾气催化转化器,尾气中的NO与CO可以转化成无害物质排封。上述反应在使用“催化转化器”后,a
,但该反应的速率很小,若使用机动车尾气催化转化器,尾气中的NO与CO可以转化成无害物质排封。上述反应在使用“催化转化器”后,a_______ (填“增大”“减小”或“不变”)。
(4)已知:①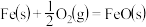
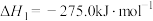 ;
;
②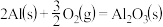
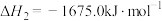 。
。
Al和FeO发生铝热反应的热化学方程式是_______ 。
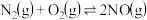 ,是导致汽车尾气中含有NO的原因之一、已知断裂某些共价键需要的能量如表:
,是导致汽车尾气中含有NO的原因之一、已知断裂某些共价键需要的能量如表:| 断裂的共价键 | O=O | N≡N | N-O |
| 需要的能量 | 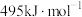 | 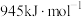 | 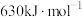 |
 和
和 的反应,该反应是
的反应,该反应是(2)
 与
与 合成NO的热化学方程式可以表示为
合成NO的热化学方程式可以表示为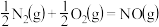
 ,则
,则
(3)NO与CO反应的热化学方程式可以表示为
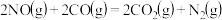
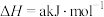 ,但该反应的速率很小,若使用机动车尾气催化转化器,尾气中的NO与CO可以转化成无害物质排封。上述反应在使用“催化转化器”后,a
,但该反应的速率很小,若使用机动车尾气催化转化器,尾气中的NO与CO可以转化成无害物质排封。上述反应在使用“催化转化器”后,a(4)已知:①
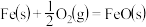
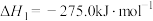 ;
;②
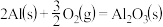
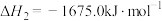 。
。Al和FeO发生铝热反应的热化学方程式是
您最近一年使用:0次
名校
5 . I.科学家已实现反应 。
。
某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.4 mol NO和0.4 mol CO,在三种 不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间变化如图所示。
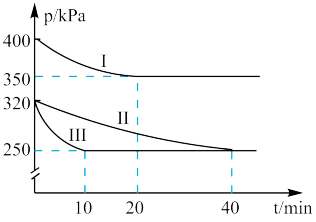
(1)①与实验II相比,实验I和实验III分别仅改变一种反应条件,所改变的条件分别为:实验I___________ ,实验III___________ 。
②三组实验中CO的平衡转化率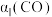 、
、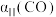 和
和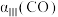 的大小关系为
的大小关系为___________ 。
③实验III的平衡常数
___________ 。
II.已知 分解成水和氧气放出热量,在少量
分解成水和氧气放出热量,在少量 作用下,常温时能剧烈分解,
作用下,常温时能剧烈分解, 分解的机理分为两步基元反应,第一步为:
分解的机理分为两步基元反应,第一步为: (慢反应,
(慢反应, )、第二步略(快反应)。
)、第二步略(快反应)。
(2)请补充第二步反应方程式:___________ 。
(3)在如图中分别画出无加入 和有加入
和有加入 的反应能量变化示意图(大致曲线)
的反应能量变化示意图(大致曲线) _______ 。

 。
。某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.4 mol NO和0.4 mol CO,在三种 不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间变化如图所示。

(1)①与实验II相比,实验I和实验III分别仅改变一种反应条件,所改变的条件分别为:实验I
②三组实验中CO的平衡转化率
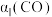 、
、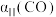 和
和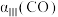 的大小关系为
的大小关系为③实验III的平衡常数

II.已知
 分解成水和氧气放出热量,在少量
分解成水和氧气放出热量,在少量 作用下,常温时能剧烈分解,
作用下,常温时能剧烈分解, 分解的机理分为两步基元反应,第一步为:
分解的机理分为两步基元反应,第一步为: (慢反应,
(慢反应, )、第二步略(快反应)。
)、第二步略(快反应)。(2)请补充第二步反应方程式:
(3)在如图中分别画出无加入
 和有加入
和有加入 的反应能量变化示意图(大致曲线)
的反应能量变化示意图(大致曲线) 
您最近一年使用:0次
2022-08-30更新
|
342次组卷
|
3卷引用:福建省龙岩市第一中学2022-2023学年高二上学期第一次月考(实验班)化学试题
名校
6 . Ⅰ.当今,世界多国相继规划了碳达峰、碳中和的时间节点,我国力争于2030年前做到碳达峰,2060年前实现碳中和。因此,研发二氧化碳利用技术,降低空气中二氧化碳的含量成为研究热点。近年我国大力加强温室气体 催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:
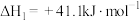

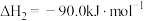
则 催化氢化合成甲醇的热化学方程式:
催化氢化合成甲醇的热化学方程式:___________ 。
Ⅱ.工业上高炉炼铁中常见的反应为: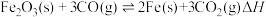
(2)某实验小组在实验室模拟上述反应。一定温皮下,在2L盛有 粉末的恒容密闭器中通入0.1mol
粉末的恒容密闭器中通入0.1mol ,5min时生成2.24gFe.0~5nin内用CO的浓度变化表示的平均反应速率是
,5min时生成2.24gFe.0~5nin内用CO的浓度变化表示的平均反应速率是___________  ;5min时
;5min时 的体积分数为
的体积分数为___________ 。
(3)上述反应的平衡常数表达式为K=___________ 。
(4)下列能说明该反应已经达到平衡状态的是___________ (填序号)。
a.容器内固体质量保持不变 b.容器中气体压强保持不变
c. d.
d.
(5)已知上述反应的平衡常数K与温度T(单位:K)之向的关系如图所示,其中直线的斜率为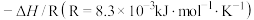 。
。
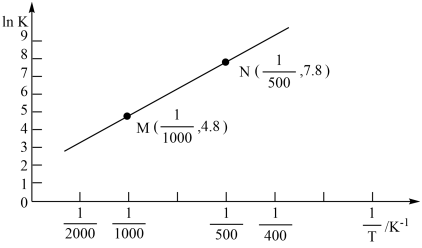
根据图象,试计算该反应的
___________  。
。
 催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。(1)已知:

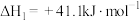

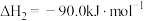
则
 催化氢化合成甲醇的热化学方程式:
催化氢化合成甲醇的热化学方程式:Ⅱ.工业上高炉炼铁中常见的反应为:
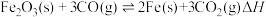
(2)某实验小组在实验室模拟上述反应。一定温皮下,在2L盛有
 粉末的恒容密闭器中通入0.1mol
粉末的恒容密闭器中通入0.1mol ,5min时生成2.24gFe.0~5nin内用CO的浓度变化表示的平均反应速率是
,5min时生成2.24gFe.0~5nin内用CO的浓度变化表示的平均反应速率是 ;5min时
;5min时 的体积分数为
的体积分数为(3)上述反应的平衡常数表达式为K=
(4)下列能说明该反应已经达到平衡状态的是
a.容器内固体质量保持不变 b.容器中气体压强保持不变
c.
 d.
d.
(5)已知上述反应的平衡常数K与温度T(单位:K)之向的关系如图所示,其中直线的斜率为
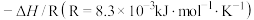 。
。
根据图象,试计算该反应的

 。
。
您最近一年使用:0次
7 . I.完成下列问题
(1)N2H4(肼)常用作火箭推进剂。
已知:①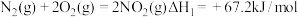
②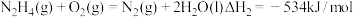 ,
,
请写出气态N2H4(肼)在NO2气体中燃烧,生成N2、液态H2O反应的热化学方程式___________ 。
II.电化学在生产、生活中有广泛的应用。
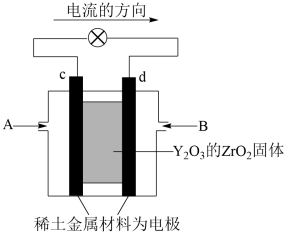
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。如下图所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导 。则c电极的名称为
。则c电极的名称为___________ ,d电极上的电极反应式为___________ 。
(3)高铁酸盐在能源、环保等领域有着广泛的应用。
资料:高铁酸钾(K2FeO4)固体呈紫色,能溶于水,微溶于浓KOH溶液。K2FeO4在碱性溶液中性质稳定。研究人员用Ni、Fe作电极电解浓KOH溶液制备K2FeO4,装置示意图如下。
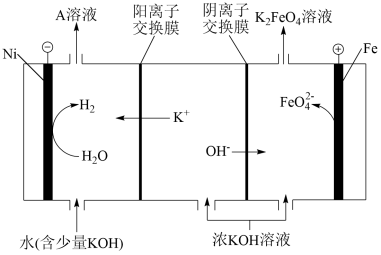
①Ni电极作___________ (填“阴”或“阳”)极。
②Fe电极上的电极反应为___________ 。
③循环使用的物质是___________ (填化学式)溶液。
④向阳极流出液中加入饱和KOH溶液,析出紫色固体。试从平衡的角度解释析出固体的原因:___________ 。
(1)N2H4(肼)常用作火箭推进剂。
已知:①
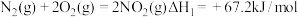
②
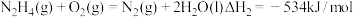 ,
,请写出气态N2H4(肼)在NO2气体中燃烧,生成N2、液态H2O反应的热化学方程式
II.电化学在生产、生活中有广泛的应用。
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。如下图所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导
 。则c电极的名称为
。则c电极的名称为
(3)高铁酸盐在能源、环保等领域有着广泛的应用。
资料:高铁酸钾(K2FeO4)固体呈紫色,能溶于水,微溶于浓KOH溶液。K2FeO4在碱性溶液中性质稳定。研究人员用Ni、Fe作电极电解浓KOH溶液制备K2FeO4,装置示意图如下。

①Ni电极作
②Fe电极上的电极反应为
③循环使用的物质是
④向阳极流出液中加入饱和KOH溶液,析出紫色固体。试从平衡的角度解释析出固体的原因:
您最近一年使用:0次
解题方法
8 . 回答下列问题:
(1)在一 定条件下,氢气在氯气中燃烧的热化学方程式: H2(g)+C12(g) =2HCl(g) ΔH= - 184.6 kJ•mol-1;该反应属于___________ (填“热吸”或“放热”)反应 。
(2)常温常压下,1 mol乙醇完全燃烧生成CO2气体和液态水放出的热量为1367 kJ,写出乙醇燃烧热的热化学方程式:___________
(3)根据盖斯定律计算
P4(白磷,s)+5O2(g)=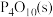 △H=-2983.2 kJ·mol-1 ①
△H=-2983.2 kJ·mol-1 ①
P(红磷,s)+ O2(g)=
O2(g)=
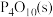 △H=-738.5 kJ·mol-1 ②
△H=-738.5 kJ·mol-1 ②
则白磷转化为红磷的热化学方程式为___________
(4)已知破坏1 mol H-H 键、1 mol I-I键、1 mol H-I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ 。则由氢气和碘单质反应生成2molHI 需要放出___________ kJ 的热量。
(1)在一 定条件下,氢气在氯气中燃烧的热化学方程式: H2(g)+C12(g) =2HCl(g) ΔH= - 184.6 kJ•mol-1;该反应属于
(2)常温常压下,1 mol乙醇完全燃烧生成CO2气体和液态水放出的热量为1367 kJ,写出乙醇燃烧热的热化学方程式:
(3)根据盖斯定律计算
P4(白磷,s)+5O2(g)=
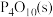 △H=-2983.2 kJ·mol-1 ①
△H=-2983.2 kJ·mol-1 ①P(红磷,s)+
 O2(g)=
O2(g)=
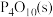 △H=-738.5 kJ·mol-1 ②
△H=-738.5 kJ·mol-1 ②则白磷转化为红磷的热化学方程式为
(4)已知破坏1 mol H-H 键、1 mol I-I键、1 mol H-I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ 。则由氢气和碘单质反应生成2molHI 需要放出
您最近一年使用:0次
2022-03-19更新
|
980次组卷
|
2卷引用:福建省福州市协作体四校2021-2022学年高二上学期期中联考化学试题
9 . 请回答下列问题:
(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下16g SiH4自燃放出热量713.6kJ。SiH4自燃的热化学方程式为___________ 。
(2)标准摩尔生成焓是指在25℃和101kPa时,最稳定的单质生成1mol化合物的焓变。
已知25℃和101kPa时下列反应:①2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) ∆H=-3116kJ/mol
②C(石墨,s)+O2(g)=CO2(g) ∆H=-393.5kJ/mol
③2H2(g)+O2(g)=2H2O(l) ∆H=-571.6kJ/mol
写出乙烷标准摩尔生成焓的热化学方程式:___________ 。
(3)肼(N2H4)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1mol化学键需的能量(kJ):N≡N为942、O=O为500、N-N为154,则断裂1mol N-H键需要___________ kJ的能量。

(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下16g SiH4自燃放出热量713.6kJ。SiH4自燃的热化学方程式为
(2)标准摩尔生成焓是指在25℃和101kPa时,最稳定的单质生成1mol化合物的焓变。
已知25℃和101kPa时下列反应:①2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) ∆H=-3116kJ/mol
②C(石墨,s)+O2(g)=CO2(g) ∆H=-393.5kJ/mol
③2H2(g)+O2(g)=2H2O(l) ∆H=-571.6kJ/mol
写出乙烷标准摩尔生成焓的热化学方程式:
(3)肼(N2H4)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1mol化学键需的能量(kJ):N≡N为942、O=O为500、N-N为154,则断裂1mol N-H键需要

您最近一年使用:0次
名校
解题方法
10 . 回答下列问题:
(1)在某溶液中存在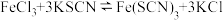 的平衡体系。
的平衡体系。
①在溶液中加入少量的 固体,平衡
固体,平衡___________ (填“正向”、“逆向”、“不”)移动。
②在溶液中加入少量的 固体,平衡
固体,平衡___________ (填“正向”、“逆向”、“不”)移动。
(2)煤作为燃料可通过下列两种途径提供热能:
途径Ⅰ: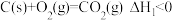
途径Ⅱ:制水煤气: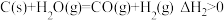
水煤气燃烧: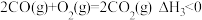
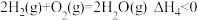
则
___________ (用 、
、 、
、 表示)。
表示)。
(3)利用 和
和 在一定条件下可合成甲醇,发生如下反应:
在一定条件下可合成甲醇,发生如下反应: ,其两种反应过程中能量的变化曲线分别如下图a、b所示,下列说法正确的是___________(填标号)。
,其两种反应过程中能量的变化曲线分别如下图a、b所示,下列说法正确的是___________(填标号)。

A.上述反应的
B.a过程正反应的活化能为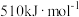
C.b过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D.b过程使用催化剂后降低了反应的活化能和
E.b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
(4)将等物质的量的A和B,混合于 的密闭容器中,发生如下反应:
的密闭容器中,发生如下反应: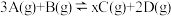 ,
, 后测得
后测得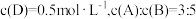 ,且
,且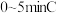 的平均反应速率是
的平均反应速率是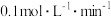 。则
。则
___________ ,A的转化率为___________ 。
(5)天然气中含有的微量 会腐蚀管道和设备,在
会腐蚀管道和设备,在 下进行脱硫处理,
下进行脱硫处理, 会被氧气氧化为
会被氧气氧化为 ,并产生水蒸气。
,并产生水蒸气。
该反应的热化学方程式为___________ 。
(1)在某溶液中存在
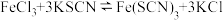 的平衡体系。
的平衡体系。①在溶液中加入少量的
 固体,平衡
固体,平衡②在溶液中加入少量的
 固体,平衡
固体,平衡(2)煤作为燃料可通过下列两种途径提供热能:
途径Ⅰ:
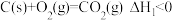
途径Ⅱ:制水煤气:
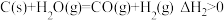
水煤气燃烧:
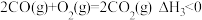
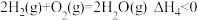
则

 、
、 、
、 表示)。
表示)。(3)利用
 和
和 在一定条件下可合成甲醇,发生如下反应:
在一定条件下可合成甲醇,发生如下反应: ,其两种反应过程中能量的变化曲线分别如下图a、b所示,下列说法正确的是___________(填标号)。
,其两种反应过程中能量的变化曲线分别如下图a、b所示,下列说法正确的是___________(填标号)。
A.上述反应的

B.a过程正反应的活化能为
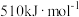
C.b过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D.b过程使用催化剂后降低了反应的活化能和

E.b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
(4)将等物质的量的A和B,混合于
 的密闭容器中,发生如下反应:
的密闭容器中,发生如下反应: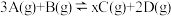 ,
, 后测得
后测得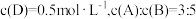 ,且
,且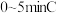 的平均反应速率是
的平均反应速率是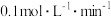 。则
。则
(5)天然气中含有的微量
 会腐蚀管道和设备,在
会腐蚀管道和设备,在 下进行脱硫处理,
下进行脱硫处理, 会被氧气氧化为
会被氧气氧化为 ,并产生水蒸气。
,并产生水蒸气。| 化学键 |  |  |  |  中共价键 中共价键 |
键能/ | 339 | 498 | 464 | 1083 |
您最近一年使用:0次
2021-11-12更新
|
268次组卷
|
2卷引用:福建省厦门市外国语学校2022-2023学年高二上学期期中考化学试卷



