2021·全国·模拟预测
1 . 我国力争于 2030 年前做到碳达峰,2060 年前实现碳中和。二氧化碳加氢制备甲醇既可以实现二氧化碳的转化利用,又可以有效缓解温室效应问题。
已知:反应 I:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH1=akJ·mol-1
反应 II:CO(g)+2H2(g)=CH3OH(g) ΔH2=b kJ·mol-1
反应III:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH3
(1)原料 CO2可通过捕获技术从空气或工业尾气中获取,下列物质能作为 CO2 捕获剂的是_______(填标号)。
(2)根据盖斯定律,反应 III 的ΔH3=_______ kJ·mol-1
(3)对于上述 CO2加氢合成 CH3OH 的体系,下列说法错误的是_______(填标号)。
(4)上述反应平衡常数的自然对数 ln Kp(Kp是以分压表示的平衡常数,分压=总压×物质的量分数)随温度的变化如图所示:
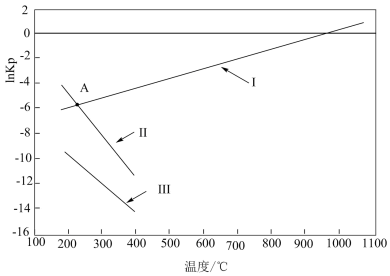
①反应I、II、III 中属于吸热反应的是_______ ,写出推理过程_______ 。
②若图中 A 点时发生反应 CH3OH(g)+CO2(g) ⇌2CO(g)+H2(g)+H2O(g),则lnKp=_______ (填数值)。
③若T0℃时,在密闭容器中加入 6 mol H2、4 molCO2只进行反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),维持压强为 p0kPa不变,达到平衡时H2的转化率是50%,则该温度下反应的平衡常数Kp=_______ 。
已知:反应 I:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH1=akJ·mol-1
反应 II:CO(g)+2H2(g)=CH3OH(g) ΔH2=b kJ·mol-1
反应III:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH3
(1)原料 CO2可通过捕获技术从空气或工业尾气中获取,下列物质能作为 CO2 捕获剂的是_______(填标号)。
| A.NaOH 溶液 | B.浓氨水 | C.CH3CH2OH | D.NH4Cl 溶液 |
(3)对于上述 CO2加氢合成 CH3OH 的体系,下列说法错误的是_______(填标号)。
| A.增大 H2浓度有利于提高 CO2的转化率 |
| B.若气体的平均相对分子质量保持不变,说明反应体系已达平衡 |
| C.体系达平衡后,若压缩体积,则反应 I 平衡不移动,反应 III 平衡逆向移动 |
| D.选用合适的催化剂可以提高 CH3OH 在单位时间内的产量 |

①反应I、II、III 中属于吸热反应的是
②若图中 A 点时发生反应 CH3OH(g)+CO2(g) ⇌2CO(g)+H2(g)+H2O(g),则lnKp=
③若T0℃时,在密闭容器中加入 6 mol H2、4 molCO2只进行反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),维持压强为 p0kPa不变,达到平衡时H2的转化率是50%,则该温度下反应的平衡常数Kp=
您最近一年使用:0次
2021-09-30更新
|
902次组卷
|
4卷引用:湖北省部分重点中学(武汉市,十堰市,襄阳市,恩施土家族苗族自治州)2022-2023学年高二下学期三月智学联合检测化学试题
湖北省部分重点中学(武汉市,十堰市,襄阳市,恩施土家族苗族自治州)2022-2023学年高二下学期三月智学联合检测化学试题(已下线)第8周 周测卷-备战2022年高考化学周测与晚练(新高考专用)2020年全国卷Ⅰ理综化学高考真题变式题广东省2022届高三上学期综合能力测试(一)化学试题
名校
2 . 合成氨技术的创立开辟了人工固氮的重要途径,解决了亿万人口生存问题。回答下列问题:
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”标记。
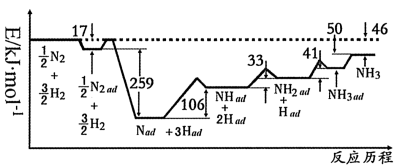
由图可知合成氨反应的热化学方程式为___ ,写出该历程中速率最慢一步的反应___ 。
(2)工业合成氨反应为:N2(g)+3H2(g) 2NH3(g),当进料体积比V(N2):V(H2)=1:3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:
2NH3(g),当进料体积比V(N2):V(H2)=1:3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:
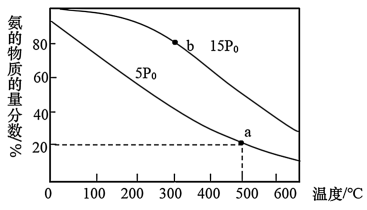
①该反应的平衡常数K(a)___ K(b)(填“<”或“=”或“>”)。
②500℃、压强为5P0时,Kp=___ [Kp为平衡分压代替平衡浓度计算求得的平衡常数(分压=总压×物质的量分数)]。
(3)科学家利用生物燃料电池原理研究室温下氨的合成并取得初步成果,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如图所示。

①A极是___ (填“正极”或“负极”),电极反应为___ 。
②电池工作时在固氮酶表面发生的反应为___ 。
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”标记。

由图可知合成氨反应的热化学方程式为
(2)工业合成氨反应为:N2(g)+3H2(g)
 2NH3(g),当进料体积比V(N2):V(H2)=1:3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:
2NH3(g),当进料体积比V(N2):V(H2)=1:3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:
①该反应的平衡常数K(a)
②500℃、压强为5P0时,Kp=
(3)科学家利用生物燃料电池原理研究室温下氨的合成并取得初步成果,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如图所示。

①A极是
②电池工作时在固氮酶表面发生的反应为
您最近一年使用:0次
2021-02-05更新
|
250次组卷
|
4卷引用:湖北省武汉市新洲区第一中学2024届高二上学期期末联考化学试题
名校
解题方法
3 . 随着化石能源的减少,新能源的开发利用日益迫切。
(1)Bunsen热化学循环制氢工艺由下列三个反应组成:
SO2(g)+I2(g)+2H2O(g)=2HI(g)+H2SO4(l) ΔH1=a kJ·mol-1
2H2SO4(l)=2H2O(g)+2SO2(g)+O2(g) ΔH2=b kJ·mol-1
2HI(g)=H2(g)+I2(g) ΔH3=c kJ·mol-1
则:2H2O(g)=2H2(g)+O2(g) ΔH=_____ kJ·mol-1。
(2)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,工业制备纯硅的反应为2H2(g)+SiCl4(g)=Si(s)+4HCl(g) ΔH=+240.4kJ·mol-1。若将生成的HCl通入100mL1mol·L-1的NaOH溶液中恰好完全反应,则在此制备纯硅反应过程中的热效应是____ kJ。
(3)据粗略统计,我国没有经过处理便排放的焦炉煤气已超过250亿立方米,这不仅是能源的浪费,也对环境造成极大污染。为解决这一问题,我国在2004年起已利用焦炉煤气制取甲醇及二甲醚。已知CO中的C与O之间为三键连接,且合成甲醇的主要反应原理为CO(g)+2H2(g)=CH3OH(g)ΔH。表中所列为常见化学键的键能数据:
则该反应的ΔH=____ kJ·mol-1。
(4)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如图1所示。
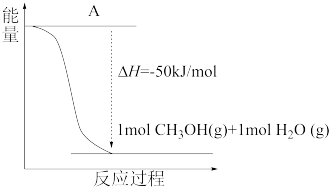
补全上图:图中A处应填入_______ 。
(5)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图2所示。
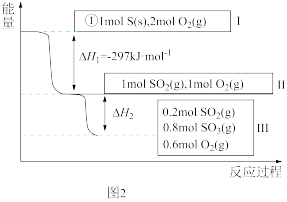
已知:2SO2(g)+O2(g)⇌2SO3(g) ΔH=-196.6 kJ·mol-1
①写出能表示硫的燃烧热的热化学方程式:____ 。
②ΔH2=___ kJ·mol-1。
(1)Bunsen热化学循环制氢工艺由下列三个反应组成:
SO2(g)+I2(g)+2H2O(g)=2HI(g)+H2SO4(l) ΔH1=a kJ·mol-1
2H2SO4(l)=2H2O(g)+2SO2(g)+O2(g) ΔH2=b kJ·mol-1
2HI(g)=H2(g)+I2(g) ΔH3=c kJ·mol-1
则:2H2O(g)=2H2(g)+O2(g) ΔH=
(2)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,工业制备纯硅的反应为2H2(g)+SiCl4(g)=Si(s)+4HCl(g) ΔH=+240.4kJ·mol-1。若将生成的HCl通入100mL1mol·L-1的NaOH溶液中恰好完全反应,则在此制备纯硅反应过程中的热效应是
(3)据粗略统计,我国没有经过处理便排放的焦炉煤气已超过250亿立方米,这不仅是能源的浪费,也对环境造成极大污染。为解决这一问题,我国在2004年起已利用焦炉煤气制取甲醇及二甲醚。已知CO中的C与O之间为三键连接,且合成甲醇的主要反应原理为CO(g)+2H2(g)=CH3OH(g)ΔH。表中所列为常见化学键的键能数据:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ·mol-1 | 348 | 414 | 436 | 326.8 | 1032 | 464 |
(4)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如图1所示。

补全上图:图中A处应填入
(5)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图2所示。

已知:2SO2(g)+O2(g)⇌2SO3(g) ΔH=-196.6 kJ·mol-1
①写出能表示硫的燃烧热的热化学方程式:
②ΔH2=
您最近一年使用:0次
2020-11-26更新
|
194次组卷
|
4卷引用:湖北省黄州中学(黄冈市外国语学校)2023-2024学年高二上学期9月月考化学试题
4 . “低碳经济”已成为全世界科学家研究的重要课题。为减小和消除 CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对 CO2 创新利用的研究。
(1)已知:①CO(g)+H2O(g) H2(g)+CO2(g) △H=-41kJ/mol
H2(g)+CO2(g) △H=-41kJ/mol
②C(s)+2H2(g) CH4(g) △H=-73kJ/mol
CH4(g) △H=-73kJ/mol
③2CO(g) C(s)+CO2(g) △H=-171kJ/mol
C(s)+CO2(g) △H=-171kJ/mol
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:_____ 。
(2)目前工业上有一种方法是用 CO2来生产燃料甲醇。为探究该反应原理,在容积为 2L密闭容器中,充入1molCO2和 3.25molH2在一定条件下发生反应,测得 CO2、CH3OH(g)和 H2O(g)的物质的量(n)随时间的变化如图所示:
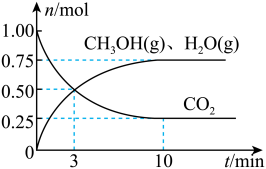
①从反应开始到平衡,氢气的平均反应速率v(H2)=____ 。
②下列措施一定不能使CO2的平衡转化率增大的是____ (填字母)。
A.在原容器中再充入1molCO2
B.在原容器中再充入1molH2
C.在原容器中充入1mol氦气
D.使用更有效的催化剂
E.缩小容器的容积
F.将水蒸气从体系中分离
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g)⇌H2(g)+CO2(g)的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:
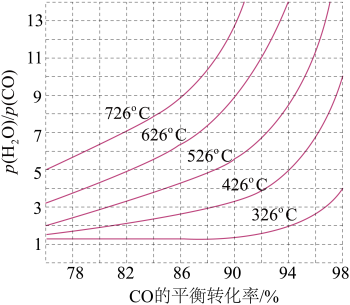
①上述反应的正反应方向是____ (填“吸热”或“放热”)反应;
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作 Kp),则在恒温密闭容器中,该反应的Kp与Kc的关系是_______ ,如果提高p(H2O)/p(CO),则Kp_______ (填“变大”“变小”或“不变”);使用铁镁催化剂的实际工业流程中,一般采用400℃左右,p(H2O)/p(CO) =3~5,采取此条件的原因可能是 _________ 。
(4)科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置实现了用CO2和H2O合成CH4。下列关于该电池的叙述正确的是____ (填字母)。
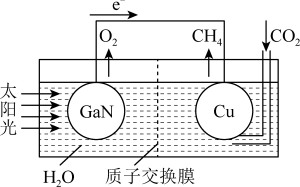
A.该装置能量转化形式仅存在太阳能转化为电能
B.铜电极为正极,电极反应式为CO2+8e-+8H+=CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
D.反应结束后,理论上溶液的 pH 值保持不变
(1)已知:①CO(g)+H2O(g)
 H2(g)+CO2(g) △H=-41kJ/mol
H2(g)+CO2(g) △H=-41kJ/mol②C(s)+2H2(g)
 CH4(g) △H=-73kJ/mol
CH4(g) △H=-73kJ/mol③2CO(g)
 C(s)+CO2(g) △H=-171kJ/mol
C(s)+CO2(g) △H=-171kJ/mol写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:
(2)目前工业上有一种方法是用 CO2来生产燃料甲醇。为探究该反应原理,在容积为 2L密闭容器中,充入1molCO2和 3.25molH2在一定条件下发生反应,测得 CO2、CH3OH(g)和 H2O(g)的物质的量(n)随时间的变化如图所示:

①从反应开始到平衡,氢气的平均反应速率v(H2)=
②下列措施一定不能使CO2的平衡转化率增大的是
A.在原容器中再充入1molCO2
B.在原容器中再充入1molH2
C.在原容器中充入1mol氦气
D.使用更有效的催化剂
E.缩小容器的容积
F.将水蒸气从体系中分离
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g)⇌H2(g)+CO2(g)的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:

①上述反应的正反应方向是
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作 Kp),则在恒温密闭容器中,该反应的Kp与Kc的关系是
(4)科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置实现了用CO2和H2O合成CH4。下列关于该电池的叙述正确的是

A.该装置能量转化形式仅存在太阳能转化为电能
B.铜电极为正极,电极反应式为CO2+8e-+8H+=CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
D.反应结束后,理论上溶液的 pH 值保持不变
您最近一年使用:0次
名校
解题方法
5 . 硫、氮的氧化物是形成酸雨的主要原因,一种比较常用的方法是用NH3处理氮的氧化物(NxOy)。完成下列问题。
(1)已知:①2NO(g)=N2(g)+O2(g) △H=-177kJ/mol
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=-1253.4kJ/mol
则用NH3处理NO生成氮气和气态水的热化学方程式为__ 。
(2)已知:N2(g)+3H2(g) 2NH3(g) △H<0。不同温度下,向三个一样的容器中投入相同的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。
2NH3(g) △H<0。不同温度下,向三个一样的容器中投入相同的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。
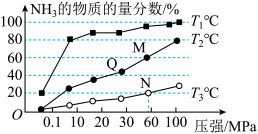
①M点的v正__ Q点的v正(填“>”“<”或“=”),原因是__ 。
②维持10MPa、T3℃的条件不变,要提高H2的转化率,可以采取的措施是__ (任写一条)。
③图中三条曲线对应的温度T1、T2、T3由高到低的顺序为___ 。
④恒温恒容条件下,能说明反应N2(g)+3H2(g) 2NH3(g)达到平衡状态的是
2NH3(g)达到平衡状态的是__ (填选项字母)
A. 保持不变
保持不变
B.3molH-H键断裂的同时,有2molN-H键断裂
C.2v(N2)=v(NH3)
D.反应器中的压强不再发生变化
⑤T3温度下,将1molN2和3molH2充入2L的恒容密闭容器中反应,一段时间后达到N点的平衡状态,则反应的平衡常数为K=__ (结果保留2位小数),M点与Q点对应的平衡常数大小关系为M__ Q(填“>”“<”或“=”)。
(1)已知:①2NO(g)=N2(g)+O2(g) △H=-177kJ/mol
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=-1253.4kJ/mol
则用NH3处理NO生成氮气和气态水的热化学方程式为
(2)已知:N2(g)+3H2(g)
 2NH3(g) △H<0。不同温度下,向三个一样的容器中投入相同的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。
2NH3(g) △H<0。不同温度下,向三个一样的容器中投入相同的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。
①M点的v正
②维持10MPa、T3℃的条件不变,要提高H2的转化率,可以采取的措施是
③图中三条曲线对应的温度T1、T2、T3由高到低的顺序为
④恒温恒容条件下,能说明反应N2(g)+3H2(g)
 2NH3(g)达到平衡状态的是
2NH3(g)达到平衡状态的是A.
 保持不变
保持不变B.3molH-H键断裂的同时,有2molN-H键断裂
C.2v(N2)=v(NH3)
D.反应器中的压强不再发生变化
⑤T3温度下,将1molN2和3molH2充入2L的恒容密闭容器中反应,一段时间后达到N点的平衡状态,则反应的平衡常数为K=
您最近一年使用:0次
2020-01-08更新
|
210次组卷
|
2卷引用:湖北省新高考协作体2022-2023学年高二下学期3月联考化学试题



