1 . 全球大气CO2浓度升高对人类生活产生了影响,CO2的捕集和资源化利用成为研究热点。
(1)CO2能引起海水酸化,原理为___ (用化学方程式表示),因此CO2过量排放对海洋生态系统会造成严重影响。
(2)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。下列物质中能作为捕碳剂的是___ 。
A.K2CO3 B.CaO C.NH3. D.NH4Cl
(3)CO2甲烷化是实现其资源化利用的有效方式之一。
I.热化学转化法:工业上常用CO2催化加氢合成CH4。
已知:①CO(g)+H2O(g) H2(g)+CO2(g) ΔH1=-41kJ·mol-1
H2(g)+CO2(g) ΔH1=-41kJ·mol-1
②C(s)+2H2(g) CH4(g) ΔH2=-73kJ·mol-1
CH4(g) ΔH2=-73kJ·mol-1
③2CO(g) C(s)+CO2(g) ΔH3=-171 kJ·mol-1
C(s)+CO2(g) ΔH3=-171 kJ·mol-1
反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的ΔH=
CH4(g)+2H2O(g)的ΔH=___ kJ·mol-1
在该工业生产中,选用了高活性的Ni基催化剂,目的是:___ 。
II.电化学转化法:多晶Cu可高效催化CO2甲烷化,电解CO2制备CH4的原理示意图如图。
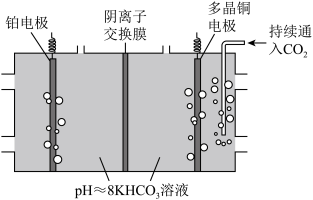
①多晶铜连接电源的___ 极。(填“正”或“负”)
②阳极氧化产物只有O2。电解时实际生成CH4的总最小于由O2理论计算所得CH4的量,结合电极反应式解释原因:___ 。
(1)CO2能引起海水酸化,原理为
(2)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。下列物质中能作为捕碳剂的是
A.K2CO3 B.CaO C.NH3. D.NH4Cl
(3)CO2甲烷化是实现其资源化利用的有效方式之一。
I.热化学转化法:工业上常用CO2催化加氢合成CH4。
已知:①CO(g)+H2O(g)
 H2(g)+CO2(g) ΔH1=-41kJ·mol-1
H2(g)+CO2(g) ΔH1=-41kJ·mol-1②C(s)+2H2(g)
 CH4(g) ΔH2=-73kJ·mol-1
CH4(g) ΔH2=-73kJ·mol-1③2CO(g)
 C(s)+CO2(g) ΔH3=-171 kJ·mol-1
C(s)+CO2(g) ΔH3=-171 kJ·mol-1反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g)的ΔH=
CH4(g)+2H2O(g)的ΔH=在该工业生产中,选用了高活性的Ni基催化剂,目的是:
II.电化学转化法:多晶Cu可高效催化CO2甲烷化,电解CO2制备CH4的原理示意图如图。

①多晶铜连接电源的
②阳极氧化产物只有O2。电解时实际生成CH4的总最小于由O2理论计算所得CH4的量,结合电极反应式解释原因:
您最近一年使用:0次
2 . 已知C(s)、H2(g)、CH3COOH(l)的燃烧热分别是393.5kJ·mol-1、285.8kJ·mol-1和870.3kJ·mol-1(注:CH3COOH的燃烧产物是CO2和H2O,则反应2C(g)+2H2+O2(g)=CH3COOH(l)的ΔH为
| A.-488.3kJ·mol-1 | B.-762.6kJ·mol-1 |
| C.-654.9kJ·mol-1 | D.+191kJ·mol-1 |
您最近一年使用:0次
3 . 在25℃、1.01×105Pa下,将22gCO2通入750mL1mol/LNaOH溶液中充分反应,测得反应放出ykJ的热量。已知在该条件下,1molCO2通入1L2mol/LNaOH溶液中充分反应放出xkJ的热量,则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是
A.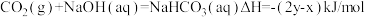 |
B.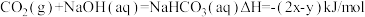 |
C.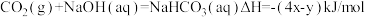 |
D. |
您最近一年使用:0次
2021-06-22更新
|
504次组卷
|
7卷引用:内蒙古鄂尔多斯市第一中学2020-2021学年高一下学期第三次月考化学试题
内蒙古鄂尔多斯市第一中学2020-2021学年高一下学期第三次月考化学试题【全国百强校】内蒙古自治区鄂尔多斯市第一中学2018-2019学年高一下学期期中考试化学试题(已下线)第一章 第三节 化学反应热的计算(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)(已下线)第1章 化学反应的热效应(基础过关卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)广东省揭阳市惠来慈云实验中学2021-2022学年高二上学期第一次月考化学试题河北省石家庄实验中学2021-2022学年高二上学期10月月考化学试题2020届高三化学选修4二轮专题练——盖斯定律的应用【选择精编25题】
4 . Ⅰ.钢铁容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一、可采用电化学防护技术减缓海水中钢铁设施的腐蚀,下图是钢铁桥墩部分防护原理示意图。
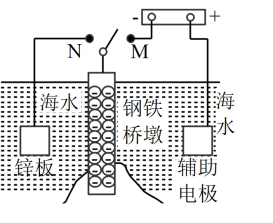
(1)K 与 M 连接时钢铁桥墩的电化学防护方法为___________ 。
(2)K与N连接时,钢铁桥墩为___________ 极(填"正"、"负"、"阴"或"阳"),电极反应式为___________ 。
(3)下列各情况中,Fe片腐蚀由快到慢的顺序是___________ 。
(4)已知:2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s) ΔH = +234.1 kJ/mol
C(s)+O2(g)=CO2(g) ΔH = -393.5 kJ/mol。
根据以上信息,则Fe(s)与O2(g)反应生成Fe2O3(s)的热化学方程式是__________ 。
Ⅱ.经研究发现青铜器的腐蚀竟然都跟原电池有关。如图为青铜器在潮湿环境中发生电化学腐蚀的示意图。
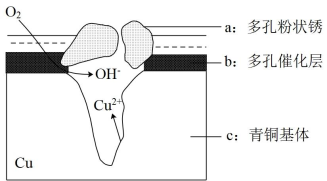
(1)腐蚀过程中,负极是___________ (填图中字母"a"或"b"或"c");
(2)环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为___________ 。
(3)若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为___________ L(标准状况)。

(1)K 与 M 连接时钢铁桥墩的电化学防护方法为
(2)K与N连接时,钢铁桥墩为
(3)下列各情况中,Fe片腐蚀由快到慢的顺序是

(4)已知:2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s) ΔH = +234.1 kJ/mol
C(s)+O2(g)=CO2(g) ΔH = -393.5 kJ/mol。
根据以上信息,则Fe(s)与O2(g)反应生成Fe2O3(s)的热化学方程式是
Ⅱ.经研究发现青铜器的腐蚀竟然都跟原电池有关。如图为青铜器在潮湿环境中发生电化学腐蚀的示意图。

(1)腐蚀过程中,负极是
(2)环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为
(3)若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为
您最近一年使用:0次
2021-06-17更新
|
180次组卷
|
2卷引用:黑龙江省鹤岗市第一中学2020-2021学年高一6月月考化学试题
5 . (1)在恒容的密闭容器中,气体X与气体Y反应可生成气体Z,反应过程中,X、Y、Z三种气体的浓度(c)随时间(t)的变化关系如图_______ ,若t0=10s,用X表示的该反应速率为_______ ;若向容器中充入He,该反应速率_______ (填“加快”或“减慢”或“不变”)
(2)一种新型催化剂用于NO和CO的反应:2NO+2CO⇌2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
①a=_______ 。
②能验证温度对化学反应速率规律的是实验_______ (填实验序号)。
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线_______ (填“甲”或“乙”)。_______ (任写一条)。
(3)已知:P(s,白磷)=P(s,黑磷),每1molP(s,白磷)发生反应,放出39.3kJ的热量,P(s,白磷)=P(s,红磷),每1molP(s,白磷)发生反应,放出17.6kJ的热量,由此推知,其中最稳定的磷单质是_______ (填“黑磷”或“红磷”)。
(4)丙烷氧气燃料电池在碱性电解质环境中放电时丙烷在_______ (填“正”或“负”)极发生的电极反应式为_______ ,电路中每转移0.4mol电子,标准状况下消耗O2的体积是_______ L。

(2)一种新型催化剂用于NO和CO的反应:2NO+2CO⇌2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
| 实验编号 | t(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.2×10−3 | 5.80×10−3 | 82 |
| Ⅱ | 280 | 1.2×10−3 | b | 124 |
| Ⅲ | 350 | a | 5.80×10−3 | 82 |
②能验证温度对化学反应速率规律的是实验
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线

(3)已知:P(s,白磷)=P(s,黑磷),每1molP(s,白磷)发生反应,放出39.3kJ的热量,P(s,白磷)=P(s,红磷),每1molP(s,白磷)发生反应,放出17.6kJ的热量,由此推知,其中最稳定的磷单质是
(4)丙烷氧气燃料电池在碱性电解质环境中放电时丙烷在
您最近一年使用:0次
2021-06-15更新
|
385次组卷
|
4卷引用:四川省广安友谊中学高2020-2021学年高一下学期6月月考化学试题
四川省广安友谊中学高2020-2021学年高一下学期6月月考化学试题天津市第四十三中学2020-2021学年高一下学期期末考试化学试题(已下线)重难点04 化学反应速率及平衡图表问题的分析 平衡状态的判断-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(天津专用)(已下线)专题03 化学反应的速率与限度-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(天津专用)
解题方法
6 . 断开1molAB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称A-B键的键能E:
请回答下列问题:
(1)如图表示某反应的能量变化关系,则此反应_______ (填“吸热”或“放热”)反应,其中∆H=_______ (用含有a、b的关系式表示)

(2)若图中表示反应2H2(g)+O2(g)=2H2O(g) ∆H=-241.8kJ·mol-1,x=_______ ;若忽略温度和压强对反应热的影响,当反应中有1mol电子转移时,反应的热量变化为_______ 。
(3)处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S。
已知:2CO(g)+O2(g)=2CO2(g) ∆H=-283.0kJ·mol-1
S(s)+O2(g)=SO2(g) ∆H=-296.0kJ·mol-1
写出CO和SO2转化为单质硫的反应热化学方程式是_______ 。
| 化学键 | H—H | Cl—Cl | O=O | C—Cl | C—H | O—H | H—Cl |
| E/KJ·mol-1 | 436 | 247 | x | 330 | 413 | 463 | 431 |
(1)如图表示某反应的能量变化关系,则此反应

(2)若图中表示反应2H2(g)+O2(g)=2H2O(g) ∆H=-241.8kJ·mol-1,x=
(3)处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S。
已知:2CO(g)+O2(g)=2CO2(g) ∆H=-283.0kJ·mol-1
S(s)+O2(g)=SO2(g) ∆H=-296.0kJ·mol-1
写出CO和SO2转化为单质硫的反应热化学方程式是
您最近一年使用:0次
7 . 已知: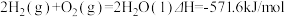 ①
①
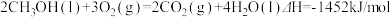 ②
②
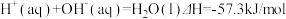
下列说法正确的是
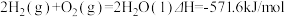 ①
①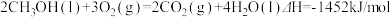 ②
②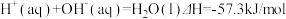
下列说法正确的是
| A.H2(g)的燃烧热为571.6kJ/mol |
| B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 |
C.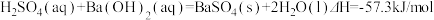 |
D.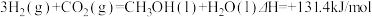 |
您最近一年使用:0次
2021-06-14更新
|
309次组卷
|
3卷引用:四川省南充西南大学实验学校2020-2021学年高一下学期6月月考化学试题
四川省南充西南大学实验学校2020-2021学年高一下学期6月月考化学试题(已下线)第一章 第三节 化学反应热的计算(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)辽宁省大石桥市第三高级中学等三校2022-2023学年高一下学期5月期中联考化学试题
8 . 分别填空(1)已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1
写出FeO(s)被CO还原成Fe和CO2的热化学方程式___________
(2)书写下列物质的电子式:NH4Cl___________ HClO___________ Ca(OH)2 ___________ Na2O2 ___________
(3)将Mg、Cu组成的2.64g混合物投入适量稀硝酸中恰好完全反应,并收集还原产物NO气体(还原产物只有一种)。然后向反应后的溶液中加入一定量NaOH溶液,金属离子恰好沉淀完全,沉淀质量为4.68g,则反应过程中收集到NO气体(标况下)体积为___________
(4)在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出 650kJ的热量,反应的热化学方程式为___________
(5)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为___________
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1
写出FeO(s)被CO还原成Fe和CO2的热化学方程式
(2)书写下列物质的电子式:NH4Cl
(3)将Mg、Cu组成的2.64g混合物投入适量稀硝酸中恰好完全反应,并收集还原产物NO气体(还原产物只有一种)。然后向反应后的溶液中加入一定量NaOH溶液,金属离子恰好沉淀完全,沉淀质量为4.68g,则反应过程中收集到NO气体(标况下)体积为
(4)在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出 650kJ的热量,反应的热化学方程式为
(5)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为
您最近一年使用:0次
解题方法
9 . 作为一种绿色消毒剂,H2O2在公共卫生事业中发挥了重要的作用。已知反应:H2O2(l)=H2O(1)+ O2(g)ΔH=-98kJ·mol-1K=2.88×1020
O2(g)ΔH=-98kJ·mol-1K=2.88×1020
回答问题:
(1)H2O2的强氧化性使其对大多数致病菌和病毒具有消杀功能。用3%医用H2O2对传染病房喷洒消毒时,地板上有气泡冒出,该气体是___ 。
(2)纯H2O2可作为民用驱雹火箭推进剂。在火箭喷口铂网催化下,H2O2剧烈分解:H2O2(l)=H2O(g)+ O2(g),放出大量气体,驱动火箭升空。每消耗34gH2O2,理论上
O2(g),放出大量气体,驱动火箭升空。每消耗34gH2O2,理论上____ (填“放出”或“吸收”)热量____ 98kJ(填“大于”、“小于”或“等于”)。
(3)向H2O2稀溶液中滴加数滴含Mn2+的溶液,即有气泡快速逸出,反应中Mn2+起____ 作用。某组实验数据如下:
0-30minH2O2反应的平均速率v=____ mol·L-1·min-1
 O2(g)ΔH=-98kJ·mol-1K=2.88×1020
O2(g)ΔH=-98kJ·mol-1K=2.88×1020回答问题:
(1)H2O2的强氧化性使其对大多数致病菌和病毒具有消杀功能。用3%医用H2O2对传染病房喷洒消毒时,地板上有气泡冒出,该气体是
(2)纯H2O2可作为民用驱雹火箭推进剂。在火箭喷口铂网催化下,H2O2剧烈分解:H2O2(l)=H2O(g)+
 O2(g),放出大量气体,驱动火箭升空。每消耗34gH2O2,理论上
O2(g),放出大量气体,驱动火箭升空。每消耗34gH2O2,理论上(3)向H2O2稀溶液中滴加数滴含Mn2+的溶液,即有气泡快速逸出,反应中Mn2+起
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| c(H2O2)/mol·L-1 | 0.70 | 0.49 | 0.35 | 0.25 | 0.17 | 0.12 |
0-30minH2O2反应的平均速率v=
您最近一年使用:0次
解题方法
10 . 计算
(1)焦炭与CO、CO2、H2均是重要的化工原料。由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.58 kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.19 kJ·mol-1
反应Ⅲ:CO(g)+2H2(g)=CH3OH(g) ΔH3
则反应Ⅲ的ΔH3=___________ 。
(2)低能耗高效率的合成氨技术开发是实现氨燃料化利用的基础。探索新型合成氨技术是研究热点之一。回答下列问题:
哈伯合成氨在较高温度下以氢气做氢源,氢气可由天然气制备。CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
下表列出了几种化学键的键能:【CO的结构 】
】
298 K时,上述反应的ΔH=___________ 。
(1)焦炭与CO、CO2、H2均是重要的化工原料。由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.58 kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.19 kJ·mol-1
反应Ⅲ:CO(g)+2H2(g)=CH3OH(g) ΔH3
则反应Ⅲ的ΔH3=
(2)低能耗高效率的合成氨技术开发是实现氨燃料化利用的基础。探索新型合成氨技术是研究热点之一。回答下列问题:
哈伯合成氨在较高温度下以氢气做氢源,氢气可由天然气制备。CH4(g)+H2O(g)
 CO(g)+3H2(g)
CO(g)+3H2(g)下表列出了几种化学键的键能:【CO的结构
 】
】| 化学键 | H-H | C-H | H-O |  |
| 键能kJ/mol | 436 | 413 | 467 | 1072 |
您最近一年使用:0次



