名校
解题方法
1 . 工业上在一定条件下可由水煤气合成甲醇,同时有副反应,反应如下:
主反应: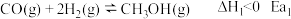
副反应: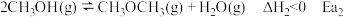
已知: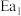 和
和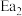 为正反应活化能,且
为正反应活化能,且 。
。
请回答:
(1)有利于主反应平衡正向移动的适宜条件___________ 。
A.高温高压 B.低温高压 C.高温低压 D.低温低压
(2)反应: 的
的
___________ (用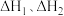 表示)
表示)
(3)若主反应在恒温恒容下进行,下列说法正确的是___________
A.当容器压强不变,反应处于平衡状态
B.K值越大,反应速率一定越快
C. 越小,放热越多,反应速率就越快
越小,放热越多,反应速率就越快
D.使用合适催化剂,可快速提高反应平衡前的转化率
E.正反应活化能越大, 就越大
就越大
(4)在 时,
时, 和
和 在体积为
在体积为 的恒温密闭容器中反应,测得2小时和5小时
的恒温密闭容器中反应,测得2小时和5小时 的选择性为80%和60%(
的选择性为80%和60%( 的选择性是指转化的
的选择性是指转化的 中生成
中生成 的百分比)。
的百分比)。 的转化率与时间的关系如图1所示:(不考虑其它副反应)
的转化率与时间的关系如图1所示:(不考虑其它副反应)
则:①2小时 的产率
的产率___________ 。
②副反应的平衡常数___________ 。
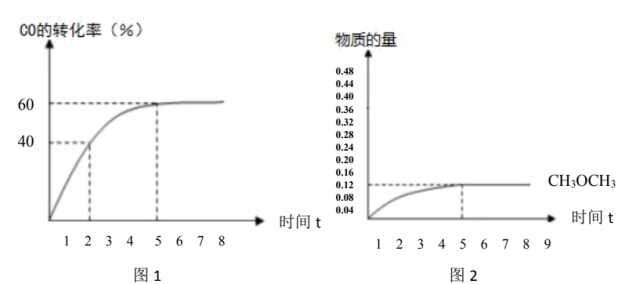
(5) 的物质的量随时间变化如图2所示,请在图2上画出
的物质的量随时间变化如图2所示,请在图2上画出 的物质的量随时间变化曲线
的物质的量随时间变化曲线___________ 。
主反应:
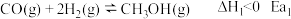
副反应:
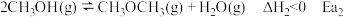
已知:
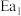 和
和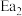 为正反应活化能,且
为正反应活化能,且 。
。请回答:
(1)有利于主反应平衡正向移动的适宜条件
A.高温高压 B.低温高压 C.高温低压 D.低温低压
(2)反应:
 的
的
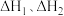 表示)
表示)(3)若主反应在恒温恒容下进行,下列说法正确的是
A.当容器压强不变,反应处于平衡状态
B.K值越大,反应速率一定越快
C.
 越小,放热越多,反应速率就越快
越小,放热越多,反应速率就越快D.使用合适催化剂,可快速提高反应平衡前的转化率
E.正反应活化能越大,
 就越大
就越大(4)在
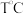 时,
时, 和
和 在体积为
在体积为 的恒温密闭容器中反应,测得2小时和5小时
的恒温密闭容器中反应,测得2小时和5小时 的选择性为80%和60%(
的选择性为80%和60%( 的选择性是指转化的
的选择性是指转化的 中生成
中生成 的百分比)。
的百分比)。 的转化率与时间的关系如图1所示:(不考虑其它副反应)
的转化率与时间的关系如图1所示:(不考虑其它副反应)则:①2小时
 的产率
的产率②副反应的平衡常数

(5)
 的物质的量随时间变化如图2所示,请在图2上画出
的物质的量随时间变化如图2所示,请在图2上画出 的物质的量随时间变化曲线
的物质的量随时间变化曲线
您最近一年使用:0次
2021-04-14更新
|
209次组卷
|
2卷引用:浙江省绍兴市诸暨中学2020-2021学年高一下学期4月期中考试(实验班)化学试题
解答题-原理综合题
|
适中(0.65)
|
名校
解题方法
2 . (1)断裂 化学键所需要的能量如表所示,腓(
化学键所需要的能量如表所示,腓( )的有关化学反应的能量变化如图所示。
)的有关化学反应的能量变化如图所示。
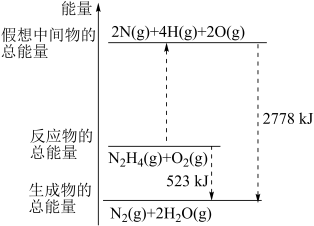
回答下列问题:
①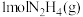 与
与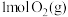 反应生成
反应生成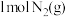 和
和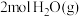 放出的能量为
放出的能量为____ kJ。
②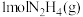 与
与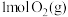 断键吸收的能量为
断键吸收的能量为____ kJ。
③a=____ 。
④当有 生成时,放出的能量
生成时,放出的能量_____ (填“>”“<”或“=”)523kJ。
(2)某镇有座硫酸厂,设备简陋,技术陈旧,该厂每天排放大量含 的废气和含
的废气和含 的酸性废水。当地的其他工厂和居民均用煤炭作燃料。只要下雨就下酸雨,对该镇环境造成极大破坏。
的酸性废水。当地的其他工厂和居民均用煤炭作燃料。只要下雨就下酸雨,对该镇环境造成极大破坏。
①分析该镇下酸雨的原因:_______ ;
②举一例说明酸雨对环境造成的危害:_______ ;
③该镇某中学环保小组提出了治理酸雨的下列措施,你认为其中不妥的是_______ ;
④可用熟石灰来处理硫酸厂排出的酸性废水,处理原理的化学方程式是_______ ;
⑤浓硫酸弄到手上后直接用大量水洗,然后涂上碳酸氢钠。这样的处理方法正确吗?_______ (填“正确”或“不正确”),理由是_______ 。
 化学键所需要的能量如表所示,腓(
化学键所需要的能量如表所示,腓( )的有关化学反应的能量变化如图所示。
)的有关化学反应的能量变化如图所示。
| 化学键 |  | 氧氧键 |  |  |
能量/( ) ) |  | 498 | 946 | 391 |
①
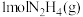 与
与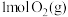 反应生成
反应生成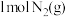 和
和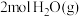 放出的能量为
放出的能量为②
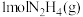 与
与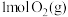 断键吸收的能量为
断键吸收的能量为③a=
④当有
 生成时,放出的能量
生成时,放出的能量(2)某镇有座硫酸厂,设备简陋,技术陈旧,该厂每天排放大量含
 的废气和含
的废气和含 的酸性废水。当地的其他工厂和居民均用煤炭作燃料。只要下雨就下酸雨,对该镇环境造成极大破坏。
的酸性废水。当地的其他工厂和居民均用煤炭作燃料。只要下雨就下酸雨,对该镇环境造成极大破坏。①分析该镇下酸雨的原因:
②举一例说明酸雨对环境造成的危害:
③该镇某中学环保小组提出了治理酸雨的下列措施,你认为其中不妥的是
| A.将硫酸厂搬离该镇 |
| B.建议环保部门限令整改 |
C.将硫酸厂排出的废气中的 处理后排放 处理后排放 |
| D.工厂和居民改用较清洁的燃料 |
⑤浓硫酸弄到手上后直接用大量水洗,然后涂上碳酸氢钠。这样的处理方法正确吗?
您最近一年使用:0次
名校
解题方法
3 . (1)有两个反应:a.H2(g)+Cl2(g)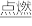 2HCl(g),b.H2(g)+Cl2(g)
2HCl(g),b.H2(g)+Cl2(g) 2HCl(g)。这两个反应的能量转化方式主要是
2HCl(g)。这两个反应的能量转化方式主要是___ 能转化为____ 能,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量___ (填“相等”或“不相等”)。
(2)利用反应4HCl+O2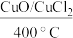 2Cl2+2H2O,可实现氯的循环利用,已知:该反应中,2molHCl被氧化时,放出57.8kJ的热量。
2Cl2+2H2O,可实现氯的循环利用,已知:该反应中,2molHCl被氧化时,放出57.8kJ的热量。
请回答下列有关问题:
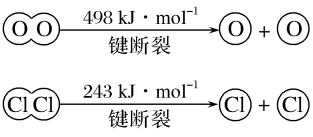
①4molHCl被氧化时,放出___ kJ的热量。
②断开1molH—O键与断开1molH—Cl键所需能量相差___ kJ,H2O中H—O键比HCl中H—Cl键(填“强”或“弱”)___ 。
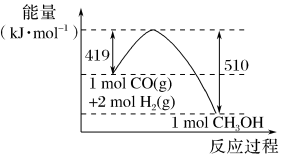
(3)根据图示的能量转化关系判断,生成16gCH3OH(l)____ (填“吸收”或“放出”)___ kJ能量。
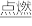 2HCl(g),b.H2(g)+Cl2(g)
2HCl(g),b.H2(g)+Cl2(g)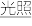 2HCl(g)。这两个反应的能量转化方式主要是
2HCl(g)。这两个反应的能量转化方式主要是(2)利用反应4HCl+O2
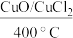 2Cl2+2H2O,可实现氯的循环利用,已知:该反应中,2molHCl被氧化时,放出57.8kJ的热量。
2Cl2+2H2O,可实现氯的循环利用,已知:该反应中,2molHCl被氧化时,放出57.8kJ的热量。
请回答下列有关问题:
①4molHCl被氧化时,放出
②断开1molH—O键与断开1molH—Cl键所需能量相差
(3)根据图示的能量转化关系判断,生成16gCH3OH(l)

您最近一年使用:0次
名校
4 . 实验测得:含1molNaOH的溶液与HCN(aq)充分反应ΔH=-21.1kJ·mol-1;与HCl(aq)充分反应ΔH=-55.6kJ·mol-1,则实验条件下HCN在水溶液中电离的ΔH等于
| A.-76.7kJ·mol-1 | B.-44.5kJ·mol-1 |
| C.+76.7kJ·mol-1 | D.+34.5kJ·mol-1 |
您最近一年使用:0次
2021-04-06更新
|
116次组卷
|
2卷引用:陕西省西安市铁一中 学2021-2022学年高一下学期期中考试化学试题
名校
解题方法
5 . 下图为元素周期表的一部分,根据元素①~⑧在表中的位置回答下列问题。
(1)元素⑧的最高价氧化物对应水化物的分子式为___________ ;
(2)元素①与④形成的18电子的化合物的结构式为___________ ;
(3)用电子式表示元素⑤与⑧形成化合物的过程___________ ;
(4)假设元素⑧的对应元素符号为X,若在一定条件下,X单质能够与硫反应生成一种用途广泛的硫化剂S2X2.该硫化剂S2X2与足量水反应有淡黄色沉淀生成,同时生成能够使品红溶液褪色的无色气体,则该反应的化学方程式是___________ (元素X请用具体元素符号表示)。
(5)元素①与③形成的简单化合物是___________ 分子(填极性或非极性)
(6)丙烷燃烧可以通过以下两种途径:
途径Ⅰ:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)ΔH=-akJ/mol
途径Ⅱ:C3H8(g)=C3H6(g)+H2(g)ΔH=+bkJ/mol
2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l)ΔH=-ckJ/mol
2H2(g)+O2(g)=2H2O(l)ΔH=-dkJ/mol(a、b、c、d均为正值)
判断等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量___________ (填“大于”、“等于”或“小于”)途径Ⅱ放出的热量。
族 周期 | Ⅰ | 0 | ||||||
| 1 | ① | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(2)元素①与④形成的18电子的化合物的结构式为
(3)用电子式表示元素⑤与⑧形成化合物的过程
(4)假设元素⑧的对应元素符号为X,若在一定条件下,X单质能够与硫反应生成一种用途广泛的硫化剂S2X2.该硫化剂S2X2与足量水反应有淡黄色沉淀生成,同时生成能够使品红溶液褪色的无色气体,则该反应的化学方程式是
(5)元素①与③形成的简单化合物是
(6)丙烷燃烧可以通过以下两种途径:
途径Ⅰ:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)ΔH=-akJ/mol
途径Ⅱ:C3H8(g)=C3H6(g)+H2(g)ΔH=+bkJ/mol
2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l)ΔH=-ckJ/mol
2H2(g)+O2(g)=2H2O(l)ΔH=-dkJ/mol(a、b、c、d均为正值)
判断等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量
您最近一年使用:0次
名校
解题方法
6 . 已知以下的热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)ΔH=-24.8kJ·mol-1
②Fe2O3(s)+ CO(g)=
CO(g)= Fe3O4(s)+
Fe3O4(s)+ CO2(g)ΔH=-15.73kJ·mol-1
CO2(g)ΔH=-15.73kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)ΔH=+640.4kJ·mol-1
则28gCO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)ΔH=-24.8kJ·mol-1
②Fe2O3(s)+
 CO(g)=
CO(g)= Fe3O4(s)+
Fe3O4(s)+ CO2(g)ΔH=-15.73kJ·mol-1
CO2(g)ΔH=-15.73kJ·mol-1③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)ΔH=+640.4kJ·mol-1
则28gCO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为
| A.+218kJ·mol-1 | B.-109kJ·mol-1 | C.-218kJ·mol-1 | D.+109kJ·mol-1 |
您最近一年使用:0次
2021-04-02更新
|
187次组卷
|
2卷引用:四川省阆中中学校2020-2021学年高一(仁智班)下学期第一次月考化学试题
名校
解题方法
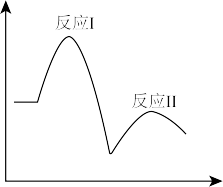
7 . 已知完全分解1molH2O2放出热量为98kJ,在含有少量I-的溶液中H2O2分解的机理为
反应Ⅰ:H2O2(aq)+I-(aq) IO-(aq)+H2O(l) △H1
IO-(aq)+H2O(l) △H1
反应Ⅱ:H2O2(aq)+IO-(aq) O2(g)+I-(aq)+H2O(l) △H2
O2(g)+I-(aq)+H2O(l) △H2
在一定温度下,其反应过程能量变化如图所示,下列有关该反应的说法不正确的是
反应Ⅰ:H2O2(aq)+I-(aq)
 IO-(aq)+H2O(l) △H1
IO-(aq)+H2O(l) △H1反应Ⅱ:H2O2(aq)+IO-(aq)
 O2(g)+I-(aq)+H2O(l) △H2
O2(g)+I-(aq)+H2O(l) △H2在一定温度下,其反应过程能量变化如图所示,下列有关该反应的说法不正确的是

| A.反应Ⅱ高温下能自发进行 |
| B.H2O2分解产生氧气的速率是由反应I决定的 |
| C.I-、IO-都是催化剂 |
| D.△H1+△H2=-196kJ•mol-1 |
您最近一年使用:0次
2021-03-16更新
|
940次组卷
|
12卷引用:辽宁省沈阳市郊联体2020-2021学期高一下学期期中考试化学试题
辽宁省沈阳市郊联体2020-2021学期高一下学期期中考试化学试题浙江省2021届高三下学期3月联考化学试题(已下线)浙江省“超级全能生”2021年3月高考选考科目联考化学试题(已下线)押山东卷第14题 化学反应速率和平衡-备战2021年高考化学临考题号押题(山东卷)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)广东省广州中学2021-2022学年高二上学期期中考试化学试题广东省揭阳市榕城区仙桥中学2021-2022学年高二下学期期中考试化学试题云南省昆明市第一中学2021-2022学年高二下学期期中考试化学试题浙江省温州新力量联盟2022-2023学年高二 上学期期中联考化学试题广东省广州市东涌中学2022-2023学年高二上学期期中考试化学试题广东省深圳市富源学校2023-2024学年高二上学期11月期中化学试题
8 . 反应2H2(g)+O2(g)=2H2O(1) ΔH=-571.6 kJ·mol-1 过程中的能量变化关系如图。下列说法错误的是

| A.ΔH1>△H2 |
| B.ΔH1+ΔH2+ΔH3=ΔH4=-571.6kJ·mol-1 |
C.2mol水蒸气转化为液态水能够释放出的能量为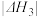 kJ kJ |
| D.若将上述反应设计成原电池,则当氢失4mol电子时能够产生571.6kJ的电能 |
您最近一年使用:0次
2021-03-14更新
|
496次组卷
|
6卷引用:辽宁省大连市一0三中学2020-2021学年高一4月月考化学试题
辽宁省大连市一0三中学2020-2021学年高一4月月考化学试题福建省福州市2021届高考3月毕业班质量检测(一模)化学试题(已下线)押山东卷第07题 化学反应与能量-备战2021年高考化学临考题号押题(山东卷)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)云南省大理州实验中学2021-2022学年高二上学期化学期末考试题
名校
解题方法
9 . 硫酰氯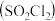 是一种重要的磺化试剂,其可利用
是一种重要的磺化试剂,其可利用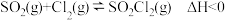 制备。
制备。 时,该反应的压强平衡常数
时,该反应的压强平衡常数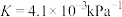 ,在恒温恒容的容器中发生反应,下列说法正确的是
,在恒温恒容的容器中发生反应,下列说法正确的是
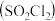 是一种重要的磺化试剂,其可利用
是一种重要的磺化试剂,其可利用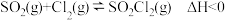 制备。
制备。 时,该反应的压强平衡常数
时,该反应的压强平衡常数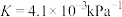 ,在恒温恒容的容器中发生反应,下列说法正确的是
,在恒温恒容的容器中发生反应,下列说法正确的是A.已知硫酰氯结构式为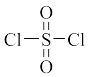 ,硫酰氯每个原子均达到8电子稳定结构 ,硫酰氯每个原子均达到8电子稳定结构 |
| B.容器内气体的平均摩尔质量不变时,反应达到平衡 |
| C.温度升高,平衡逆向移动,反应的压强平衡常数增大 |
| D.上述制备硫酰氯的反应,在高温下自发 |
您最近一年使用:0次
2021-03-10更新
|
531次组卷
|
7卷引用:甘肃省礼县第一中学2020-2021学年高一上学期期中测试化学试题
甘肃省礼县第一中学2020-2021学年高一上学期期中测试化学试题河北省“五个一名校联盟”(张家口一中、唐山一中、保定一中、邯郸一中、邢台一中)2021届高三第二次模拟考试化学试题河南省鹤壁市高中2020-2021学年高二下学期第三次段考化学试题(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(浙江专用)河北省石家庄市第二中学2021-2022学年高三上学期10月第二次考试化学试题(已下线)专题10 化学反应速率与平衡-2023年高考化学一轮复习小题多维练(全国通用)
20-21高一下·全国·课时练习
名校
解题方法
10 . 氢能是最具前景的清洁能源之一,目前水分解制氢技术及贮氢材料的开发应用都取得了很大进展。已知:2H2(g)+ O2(g)=2H2O(1)∆H=-571.6kJ·mol-1。下列说法错误的是
| A.1mol H2O(l)分解制得1molH2需要吸收571.6kJ的能量 |
| B.氢气作为新能源具有热值高、无污染、资源丰富、可再生等优点 |
| C.贮氢材料具有能大量、快速和高效率地吸收和释放氢气的特点 |
| D.利用太阳能光催化分解水制氢是一种理想的制氢手段 |
您最近一年使用:0次
2021-03-09更新
|
273次组卷
|
3卷引用:6.2.2 燃料燃烧释放的能量 氢燃料的应用前景(练习)-2020-2021学年下学期高一化学同步精品课堂(苏教版2019必修第二册)
(已下线)6.2.2 燃料燃烧释放的能量 氢燃料的应用前景(练习)-2020-2021学年下学期高一化学同步精品课堂(苏教版2019必修第二册)江苏省沭阳县修远中学2020-2021学年高一下学期第一次月考化学试题江苏省淮安市涟水县第一中学2021-2022学年高一下学期第一次阶段检测化学试题



