解题方法
1 . 联氨( )是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料。回答下列问题:
)是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料。回答下列问题:
(1)工业上利用 和
和 合成
合成 ,用
,用 进一步制备联氨
进一步制备联氨 。
。
①已知断开(或形成)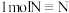 键、
键、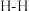 键分别需要吸收(或放出)
键分别需要吸收(或放出)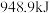 ,
, 的热量,合成
的热量,合成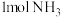 可放出
可放出 的热量,则形成
的热量,则形成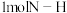 放出的热量为
放出的热量为___________  (保留一位小数)。
(保留一位小数)。
②工业上一种制备联氨的方法为 。该反应涉及物质中属于离子化合物的是
。该反应涉及物质中属于离子化合物的是___________ (填写化学式)。制备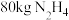 ,反应中转移电子的物质的量为
,反应中转移电子的物质的量为___________  。
。
(2)发射航天器时常以 为燃料,
为燃料, 为推进剂。
为推进剂。
已知
ⅰ.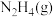 的摩尔燃烧焓为
的摩尔燃烧焓为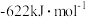 。
。
ⅱ.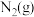 与
与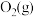 反应的物质和能量变化示意图如下:
反应的物质和能量变化示意图如下:
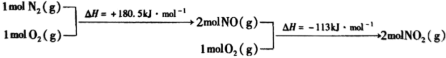
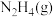 与
与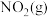 反应生成
反应生成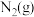 和
和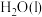 的热化学方程式为
的热化学方程式为___________ 。
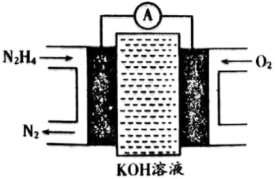
(3)一种联氨燃料电池的工作原理如图所示。放电一段时间,电解质溶液中 的物质的量浓度
的物质的量浓度___________ (填“增大”“减小”或“不变”),负极反应式为___________ 。
 )是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料。回答下列问题:
)是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料。回答下列问题:(1)工业上利用
 和
和 合成
合成 ,用
,用 进一步制备联氨
进一步制备联氨 。
。①已知断开(或形成)
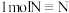 键、
键、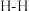 键分别需要吸收(或放出)
键分别需要吸收(或放出)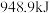 ,
, 的热量,合成
的热量,合成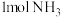 可放出
可放出 的热量,则形成
的热量,则形成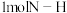 放出的热量为
放出的热量为 (保留一位小数)。
(保留一位小数)。②工业上一种制备联氨的方法为
 。该反应涉及物质中属于离子化合物的是
。该反应涉及物质中属于离子化合物的是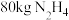 ,反应中转移电子的物质的量为
,反应中转移电子的物质的量为 。
。(2)发射航天器时常以
 为燃料,
为燃料, 为推进剂。
为推进剂。已知
ⅰ.
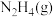 的摩尔燃烧焓为
的摩尔燃烧焓为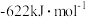 。
。ⅱ.
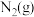 与
与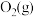 反应的物质和能量变化示意图如下:
反应的物质和能量变化示意图如下: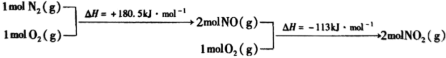
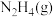 与
与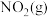 反应生成
反应生成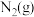 和
和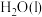 的热化学方程式为
的热化学方程式为(3)一种联氨燃料电池的工作原理如图所示。放电一段时间,电解质溶液中
 的物质的量浓度
的物质的量浓度
您最近一年使用:0次
名校
解题方法
2 . 已知:CH3OH(g)+ O2(g)=CO2(g)+2H2O(g)△H=akJ·mol﹣1、CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=bkJ·mol﹣1,则下列叙述正确的是
O2(g)=CO2(g)+2H2O(g)△H=akJ·mol﹣1、CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=bkJ·mol﹣1,则下列叙述正确的是
 O2(g)=CO2(g)+2H2O(g)△H=akJ·mol﹣1、CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=bkJ·mol﹣1,则下列叙述正确的是
O2(g)=CO2(g)+2H2O(g)△H=akJ·mol﹣1、CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=bkJ·mol﹣1,则下列叙述正确的是| A.C﹣H键键长小于H﹣H键 |
| B.CH4(g)+2O2=CO2(g)+2H2O(g)△H=bkJ·mol﹣1表示甲烷燃烧热的热化学方程式 |
| C.2CH3OH(g)=2CH4(g)+O2(g)△H=2(a﹣b)kJ·mol﹣1 |
D.当CH3OH(g)和CH4(g)物质的量之比为1:2时,其完全燃烧生成CO2和H2O(g)时,放出的热量为ckJ,则该混合物中CH3OH(g)的物质的量为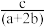 mol mol |
您最近一年使用:0次
名校
解题方法
3 . 工业合成氨的反应N2+3H2⇌2NH3的能量变化如图所示,请回答有关问题:
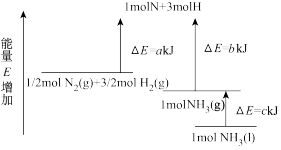
(1)合成1molNH3(l)____ (填“吸收”或“放出”)____ kJ的热量。
(2)推测反应2NH3(l)⇌2N2(g)+3H2(g)比反应2NH3(g)⇌2N2(g)+3H2(g)___ (填“吸收”或“放出”)的热量___ (填“多”或“少”)。
(3)已知:P(s,白磷)=P(s,黑磷),每1molP(s,白磷)发生反应,放出39.3kJ的热量,P(s,白磷)=P(s,红磷),每1molP(s,白磷)发生反应,放出17.6kJ的热量,由此推知,其中最稳定的磷单质是__ (填“黑磷”或“红磷”)。
(4)某实验小组同学对电化学原理进行了一系列探究活动。
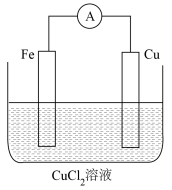
该电池基于总反应____ (用离子方程式表示)来设计的,一段时间后,铜极质量变化32g,则导线中通过____ mol电子。

(1)合成1molNH3(l)
(2)推测反应2NH3(l)⇌2N2(g)+3H2(g)比反应2NH3(g)⇌2N2(g)+3H2(g)
(3)已知:P(s,白磷)=P(s,黑磷),每1molP(s,白磷)发生反应,放出39.3kJ的热量,P(s,白磷)=P(s,红磷),每1molP(s,白磷)发生反应,放出17.6kJ的热量,由此推知,其中最稳定的磷单质是
(4)某实验小组同学对电化学原理进行了一系列探究活动。

该电池基于总反应
您最近一年使用:0次
4 . 能源是现代文明的原动力,通过化学方法可以使能源按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。回答下列问题:
(1)氢能作为一种清洁高效的二次能源,在未来能源格局中发挥着重要作用。已知:常温下,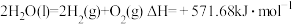 ,
,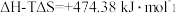 。则常温下水的分解不能自发进行的热力学依据是
。则常温下水的分解不能自发进行的热力学依据是_______ 。
(2)已知反应: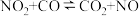
①在某温度下该反应的平衡常数为K,则其逆反应的平衡常数为_______ (用含K的式子表示)。
②下图是该反应中能量变化示意图。
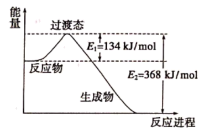
则 和
和 反应生成
反应生成 和
和 的活化能为
的活化能为_______ , 和
和 反应的热化学方程式为
反应的热化学方程式为_______ 。
(3)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①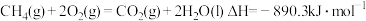
②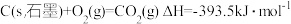
③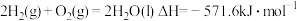
则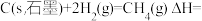
_______ 。
(4)已知一些化学键的键能数据如表所示:
请根据键能数据写出 和
和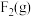 反应生成
反应生成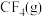 和
和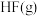 的热化学方程式:
的热化学方程式:_______ 。
(1)氢能作为一种清洁高效的二次能源,在未来能源格局中发挥着重要作用。已知:常温下,
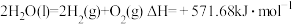 ,
,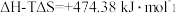 。则常温下水的分解不能自发进行的热力学依据是
。则常温下水的分解不能自发进行的热力学依据是(2)已知反应:
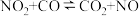
①在某温度下该反应的平衡常数为K,则其逆反应的平衡常数为
②下图是该反应中能量变化示意图。

则
 和
和 反应生成
反应生成 和
和 的活化能为
的活化能为 和
和 反应的热化学方程式为
反应的热化学方程式为(3)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①
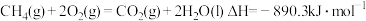
②
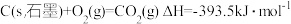
③
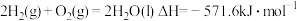
则
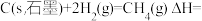
(4)已知一些化学键的键能数据如表所示:
| 化学键 |  |  |  |  |
键能/ | 414 | 489 | 565 | 155 |
请根据键能数据写出
 和
和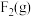 反应生成
反应生成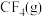 和
和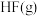 的热化学方程式:
的热化学方程式:
您最近一年使用:0次
名校
解题方法
5 . 工业合成氨的反应N2+3H2=2NH3的能量变化如图所示,请回答有关问题:
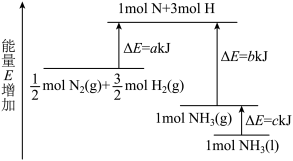
(1)合成1molNH3(l)___________ (填“吸收”或“放出”)___________ kJ的热量。(用字母表示)
(2)已知:拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1molN2(g)完全反应生成NH3(g)产生的能量变化为___________ kJ。
(3)推测反应2NH3(l)=N2(g)+3H2(g)比反应2NH3(g)=N2(g)+3H2(g)___________ (填“吸收”或“放出”)的热量___________ (填“多”或“少”)。

(1)合成1molNH3(l)
(2)已知:拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1molN2(g)完全反应生成NH3(g)产生的能量变化为
(3)推测反应2NH3(l)=N2(g)+3H2(g)比反应2NH3(g)=N2(g)+3H2(g)
您最近一年使用:0次
2021-05-03更新
|
300次组卷
|
8卷引用:江西省南昌市八一中学、洪都中学等七校2020-2021学年高一下学期期中联考化学试题
江西省南昌市八一中学、洪都中学等七校2020-2021学年高一下学期期中联考化学试题安徽省滁州市定远县育才学校2020-2021学年高一下学期期中考试化学试题江西省赣州市南康区第三中学2020-2021学年高一下学期期中考试化学试题黑龙江省齐齐哈尔市第八中学校2020-2021学年高一下学期期中考试化学试题山西省朔州市应县第一中学校2019-2020学年高一下学期期中考试化学试题陕西省渭南市华州区咸林中学2022-2023学年高一下学期期中考试化学试题云南省昌宁县第一中学2021-2022学年高一 3月月考化学试题(已下线)练习3 化学反应热的计算-2020-2021学年【补习教材·寒假作业】高二化学(人教版)
6 . 按要求填空:
(1)相对分子质量为72的烷烃的分子式为___________ ,结构有___________ 种,分别写出它们的结构简式___________ 。
(2)下列物质熔沸点由高到低的顺序是:①CH4;②C3H8;③CH3CH(CH3)2 ;④CH3CH2CH2CH3;___________ (填序号)
(3)4 g甲烷在氧气中燃烧生成CO2和液态水,放出222.5 kJ热量,写出表示甲烷燃烧热的热化学方程式___________ 。
(4)已知:①Fe(s)+ O2(g)=FeO(s) ΔH1=—272.0 kJ·mol-1
O2(g)=FeO(s) ΔH1=—272.0 kJ·mol-1
②2Al(s)+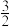 O2(g)=Al2O3(s) ΔH2=—1675.7 kJ·mol-1
O2(g)=Al2O3(s) ΔH2=—1675.7 kJ·mol-1
Al和FeO发生反应的热化学方程式是___________ 。
(1)相对分子质量为72的烷烃的分子式为
(2)下列物质熔沸点由高到低的顺序是:①CH4;②C3H8;③CH3CH(CH3)2 ;④CH3CH2CH2CH3;
(3)4 g甲烷在氧气中燃烧生成CO2和液态水,放出222.5 kJ热量,写出表示甲烷燃烧热的热化学方程式
(4)已知:①Fe(s)+
 O2(g)=FeO(s) ΔH1=—272.0 kJ·mol-1
O2(g)=FeO(s) ΔH1=—272.0 kJ·mol-1②2Al(s)+
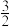 O2(g)=Al2O3(s) ΔH2=—1675.7 kJ·mol-1
O2(g)=Al2O3(s) ΔH2=—1675.7 kJ·mol-1Al和FeO发生反应的热化学方程式是
您最近一年使用:0次
7 . 化学反应往往伴随着能量的变化,请完成以下问题
Ⅰ.已知:2H2(g)+O2(g)=2H2O(g) ΔΗ=-483.6kJ·mol-1 ,N2(g)+2O2(g)=2NO2(g) ΔΗ=+67.7kJ·mol-1;则反应4H2(g)+2NO2(g)=N2(g)+4H2O(g)的反应热ΔΗ=_______ 。
II.工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g) =CH3OH(g),反应过程中的能量变化情况如图所示。
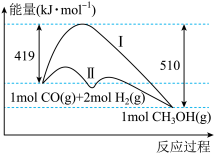
(1)曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。该反应是_______ (填“吸热”或“放热”)反应。计算当反应生成1.5molCH3OH(g)时,能量变化值是_______ kJ。
(2)选择适宜的催化剂_______ (填“能”或“不能”)改变该反应的反应热。
(3)推测反应CH3OH(g) =CO(g)+2H2(g)是_______ (填“吸热”或“放热”)反应。
III.断开1molH—H键、1molN—H键、1molN≡N键分别需要吸收能量为436kJ、391kJ、946kJ,则1molH2与足量N2反应生成NH3需_______ (填“吸收”或“放出”)能量_______ kJ。(小数点后保留两位数字),事实上,反应的热量总小于理论值,理由是_______ 。
Ⅰ.已知:2H2(g)+O2(g)=2H2O(g) ΔΗ=-483.6kJ·mol-1 ,N2(g)+2O2(g)=2NO2(g) ΔΗ=+67.7kJ·mol-1;则反应4H2(g)+2NO2(g)=N2(g)+4H2O(g)的反应热ΔΗ=
II.工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g) =CH3OH(g),反应过程中的能量变化情况如图所示。

(1)曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。该反应是
(2)选择适宜的催化剂
(3)推测反应CH3OH(g) =CO(g)+2H2(g)是
III.断开1molH—H键、1molN—H键、1molN≡N键分别需要吸收能量为436kJ、391kJ、946kJ,则1molH2与足量N2反应生成NH3需
您最近一年使用:0次
名校
8 . 已知25℃、101kPa时,以下反应的热化学方程式为:
Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)ΔH1=+489kJ·mol-1
2CO(g)+O2(g)=2CO2(g)ΔH2=-564kJ·mol-1
C(s)+O2(g)=CO2(g)ΔH3=-393kJ·mol-1
则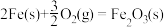 的ΔH为
的ΔH为
Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)ΔH1=+489kJ·mol-1
2CO(g)+O2(g)=2CO2(g)ΔH2=-564kJ·mol-1
C(s)+O2(g)=CO2(g)ΔH3=-393kJ·mol-1
则
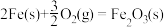 的ΔH为
的ΔH为| A.-822kJ·mol-1 | B.-468kJ·mol-1 | C.-186kJ·mol-1 | D.+468kJ·mol-1 |
您最近一年使用:0次
2021-04-23更新
|
1024次组卷
|
11卷引用:黑龙江省大庆市铁人中学2020-2021学年高一下学期期中考试化学试题
黑龙江省大庆市铁人中学2020-2021学年高一下学期期中考试化学试题河北省2021届高三普通高中学业水平选择性模拟考试化学试题第34届(2021年)高中化学奥林匹克竞赛浙江省预赛试题(已下线)课时29 盖斯定律及反应热计算-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)黑龙江省佳木斯市建三江第一中学2021-2022学年高一下学期期末测试化学试题(已下线)专题09 化学反应的热效应-2023年高考化学一轮复习小题多维练(全国通用)(已下线)专题09 化学反应的热效应-2023年高考化学一轮复习小题多维练(全国通用)黑龙江省双鸭山市第一中学2023-2024学年高二上学期开学考试化学试题湖北省武汉市第四十九中学2023-2024学年高二上学期10月月考化学试题(已下线)寒假作业01 化学反应的热效应-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)
名校
解题方法
9 . 工业上在一定条件下可由水煤气合成甲醇,同时有副反应,反应如下:
主反应: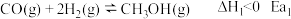
副反应: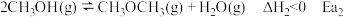
已知: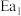 和
和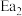 为正反应活化能,且
为正反应活化能,且 。
。
请回答:
(1)有利于主反应平衡正向移动的适宜条件___________ 。
A.高温高压 B.低温高压 C.高温低压 D.低温低压
(2)反应: 的
的
___________ (用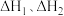 表示)
表示)
(3)若主反应在恒温恒容下进行,下列说法正确的是___________
A.当容器压强不变,反应处于平衡状态
B.K值越大,反应速率一定越快
C. 越小,放热越多,反应速率就越快
越小,放热越多,反应速率就越快
D.使用合适催化剂,可快速提高反应平衡前的转化率
E.正反应活化能越大, 就越大
就越大
(4)在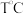 时,
时, 和
和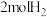 在体积为
在体积为 的恒温密闭容器中反应,测得2小时和5小时
的恒温密闭容器中反应,测得2小时和5小时 的选择性为80%和60%(
的选择性为80%和60%( 的选择性是指转化的
的选择性是指转化的 中生成
中生成 的百分比)。
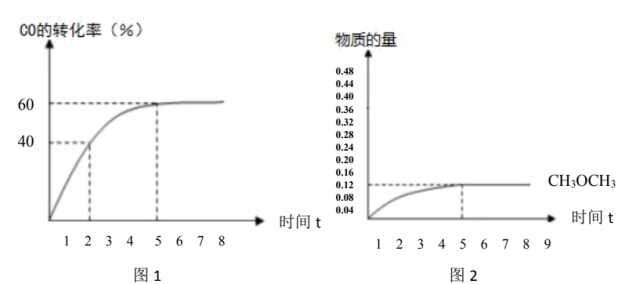
的百分比)。 的转化率与时间的关系如图1所示:(不考虑其它副反应)
的转化率与时间的关系如图1所示:(不考虑其它副反应)
则:①2小时 的产率
的产率___________ 。
②副反应的平衡常数___________ 。
(5) 的物质的量随时间变化如图2所示,请在图2上画出
的物质的量随时间变化如图2所示,请在图2上画出 的物质的量随时间变化曲线
的物质的量随时间变化曲线___________ 。
主反应:
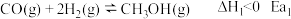
副反应:
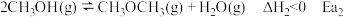
已知:
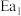 和
和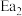 为正反应活化能,且
为正反应活化能,且 。
。请回答:
(1)有利于主反应平衡正向移动的适宜条件
A.高温高压 B.低温高压 C.高温低压 D.低温低压
(2)反应:
 的
的
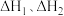 表示)
表示)(3)若主反应在恒温恒容下进行,下列说法正确的是
A.当容器压强不变,反应处于平衡状态
B.K值越大,反应速率一定越快
C.
 越小,放热越多,反应速率就越快
越小,放热越多,反应速率就越快D.使用合适催化剂,可快速提高反应平衡前的转化率
E.正反应活化能越大,
 就越大
就越大(4)在
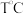 时,
时, 和
和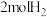 在体积为
在体积为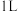 的恒温密闭容器中反应,测得2小时和5小时
的恒温密闭容器中反应,测得2小时和5小时 的选择性为80%和60%(
的选择性为80%和60%( 的选择性是指转化的
的选择性是指转化的 中生成
中生成 的百分比)。
的百分比)。 的转化率与时间的关系如图1所示:(不考虑其它副反应)
的转化率与时间的关系如图1所示:(不考虑其它副反应)则:①2小时
 的产率
的产率②副反应的平衡常数

(5)
 的物质的量随时间变化如图2所示,请在图2上画出
的物质的量随时间变化如图2所示,请在图2上画出 的物质的量随时间变化曲线
的物质的量随时间变化曲线
您最近一年使用:0次
2021-04-14更新
|
209次组卷
|
2卷引用:浙江省绍兴市诸暨中学2020-2021学年高一下学期4月期中考试(实验班)化学试题
10 . 十九大报告中提出要“打赢蓝天保卫战”意味着对大气污染防治比过去要求更高。硫化氢—空气质子交换膜燃料电池实现了发电、环保的有效结合,已知:
 。下列说法正确的是
。下列说法正确的是
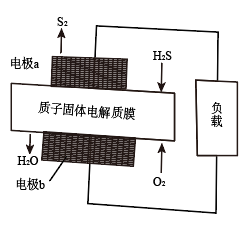

 。下列说法正确的是
。下列说法正确的是
A.电极b上发生的电极反应为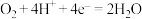 |
| B.电极a发生还原反应 |
| C.每11.2LH2S参与反应,有1molH+经固体电解质膜进入正极区 |
| D.当电极a的质量增加64g时电池内部释放632kJ的热能 |
您最近一年使用:0次
2021-04-13更新
|
464次组卷
|
3卷引用:安徽省淮北市树人高级中学2020-2021学年高一下学期期中考试化学试题
安徽省淮北市树人高级中学2020-2021学年高一下学期期中考试化学试题湖南省长郡十五校2021届高三下学期第二次联考化学试题(已下线)押山东卷第10题 原电池选择题-备战2021年高考化学临考题号押题(山东卷)



