名校
解题方法
1 . 最新一期国际学术期刊《自然纳米技术》介绍了我国科学家曾杰团队的成果:在含铂高效催化剂作用下把二氧化碳高效转化清洁液态燃料——甲醇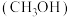 .
.
(1)该法利用 制取甲醇的有关化学反应如下:
制取甲醇的有关化学反应如下:
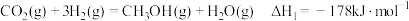
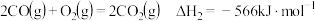
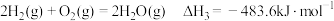
已知:i.断开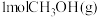 中的化学键共吸收
中的化学键共吸收 的能量
的能量
ⅱ.反应①中部分化学键键能数据如下:
由此计算断开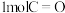 需要吸收
需要吸收_______  的能量,
的能量,
______  。
。
(2)将甲醇完全燃烧生成液态水的反应设计成原电池,以 为电解质.工作时负极的电极反应式
为电解质.工作时负极的电极反应式_____________________ 。
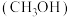 .
.(1)该法利用
 制取甲醇的有关化学反应如下:
制取甲醇的有关化学反应如下: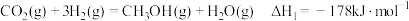
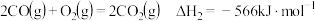
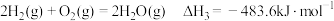
已知:i.断开
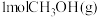 中的化学键共吸收
中的化学键共吸收 的能量
的能量ⅱ.反应①中部分化学键键能数据如下:
化学键 |
|
|
键能 | 436 | 463 |
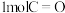 需要吸收
需要吸收 的能量,
的能量,
 。
。(2)将甲醇完全燃烧生成液态水的反应设计成原电池,以
 为电解质.工作时负极的电极反应式
为电解质.工作时负极的电极反应式
您最近一年使用:0次
解题方法
2 . Ⅰ.现有部分元素的性质与原子(或分子)结构如表所示:
回答下列问题:
(1)T是_______ (填元素符号)。元素X在周期表的位置_______ 。
(2)Y与Z相比,金属性较强的是_____ (填元素符号),下列表述中能证明这一事实的是_______ (填标号)。
A.Y单质的熔点比Z单质的低
B.Y的化合价比Z的低
C.Y单质与水反应比Z单质与水反应剧烈得多
(3)Z的最高价氧化物属于_______ 氧化物(“酸性”、“碱性”或“两性”),写出Y、Z最高价氧化物对应水化物反应的离子方程式____ 。
Ⅱ.2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
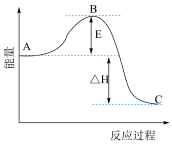
已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(4)图中A、C分别表示_______ 、_______ 。
(5)图中△H=_______ kJ·mol-1。
(6)已知单质硫的燃烧热为296KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H_______ 。
元素 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质分子为双原子分子,是空气的主要成分,分子比较稳定 |
| Y | M层比K层少一个电子 |
| Z | 有三个电子层,M层上有3个电子 |
(1)T是
(2)Y与Z相比,金属性较强的是
A.Y单质的熔点比Z单质的低
B.Y的化合价比Z的低
C.Y单质与水反应比Z单质与水反应剧烈得多
(3)Z的最高价氧化物属于
Ⅱ.2SO2(g)+O2(g)
 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(4)图中A、C分别表示
(5)图中△H=
(6)已知单质硫的燃烧热为296KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H
您最近一年使用:0次
名校
解题方法
3 . 长征五号B运载火箭是中国近地轨道运载能力最大的新一代运载火箭,承担中国空间站舱段发射任务.采用液氧、液氢作为推进剂.回答下列问题:
(1)与偏二甲肼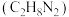 、四氧化二氨推进剂相比,液氢、液氧推进剂的优点是
、四氧化二氨推进剂相比,液氢、液氧推进剂的优点是___________ ;
(2)已知: ;
;
 ;
;
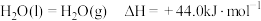 ;
;
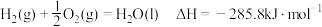 .
.
请写出液氢和液氧生成气态水的热化学方程式:______________ ,氢气的燃烧热
________ ;
(3)如果长征五号B运载火箭所携带的燃料为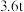 液氢、液氢,且液氢、液氧恰好完全反应生成气态水,总共释放能量
液氢、液氢,且液氢、液氧恰好完全反应生成气态水,总共释放能量________  (保留3位有效数字);
(保留3位有效数字);
(4)光催化制氢是能源研究热点.一种光催化水分解制取氢气的机理如图所示.

①该转化过程中,________ 能转化为化学能;
②由图可知, 转化为
转化为 的催化剂是
的催化剂是________ (填字母)。
A. B.
B. C.
C. D.紫外线
D.紫外线
(1)与偏二甲肼
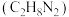 、四氧化二氨推进剂相比,液氢、液氧推进剂的优点是
、四氧化二氨推进剂相比,液氢、液氧推进剂的优点是(2)已知:
 ;
; ;
;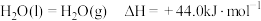 ;
;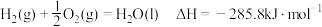 .
.请写出液氢和液氧生成气态水的热化学方程式:

(3)如果长征五号B运载火箭所携带的燃料为
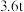 液氢、液氢,且液氢、液氧恰好完全反应生成气态水,总共释放能量
液氢、液氢,且液氢、液氧恰好完全反应生成气态水,总共释放能量 (保留3位有效数字);
(保留3位有效数字);(4)光催化制氢是能源研究热点.一种光催化水分解制取氢气的机理如图所示.

①该转化过程中,
②由图可知,
 转化为
转化为 的催化剂是
的催化剂是A.
 B.
B. C.
C. D.紫外线
D.紫外线
您最近一年使用:0次
名校
4 . 已知Fe2O2(s)+ C(s)=
C(s)=  CO2(g)+2Fe(s) △H=+234.1kJ·mol-1,C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1,则2Fe(s)+
CO2(g)+2Fe(s) △H=+234.1kJ·mol-1,C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1,则2Fe(s)+ O2(g)=Fe2O3(s)的△H是
O2(g)=Fe2O3(s)的△H是
 C(s)=
C(s)=  CO2(g)+2Fe(s) △H=+234.1kJ·mol-1,C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1,则2Fe(s)+
CO2(g)+2Fe(s) △H=+234.1kJ·mol-1,C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1,则2Fe(s)+ O2(g)=Fe2O3(s)的△H是
O2(g)=Fe2O3(s)的△H是| A.-824.4kJ·mol-1 | B.-627.6kJ·mol-1 |
| C.-744.7kJ·mol-1 | D.-169.4kJ·mol-1 |
您最近一年使用:0次
2024-03-18更新
|
372次组卷
|
4卷引用:云南省保山市腾冲市第八中学2020-2021学年高一下学期期中考试化学试题
名校
解题方法
5 . 化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是


| A.N2(g)+3H2(g)=2NH3(l) ΔH=2(a-b-c)kJ·mol-1 |
| B.N2(g)+3H2(g)=2NH3(g) ΔH=2(b-a)kJ·mol-1 |
C. N2(g)+ N2(g)+ H2(g)=NH3(l) ΔH=(b+c-a)kJ·mol-1 H2(g)=NH3(l) ΔH=(b+c-a)kJ·mol-1 |
D. N2(g)+ N2(g)+ H2(g)=NH3(g) ΔH=(a+b)kJ·mol-1 H2(g)=NH3(g) ΔH=(a+b)kJ·mol-1 |
您最近一年使用:0次
2024-01-11更新
|
157次组卷
|
2卷引用:云南省保山市腾冲市第八中学2020-2021学年高一下学期期中考试化学试题
6 . 已知一定条件下,有下列反应(相同质量的金刚石、石墨完全反应):
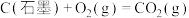
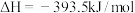
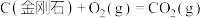
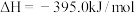
据此判断,下列说法正确的是
| A.由石墨制备金刚石是吸热反应,等质量时,石墨的能量比金刚石的低 |
| B.由石墨制备金刚石是吸热反应,等质量时,石墨的能量比金刚石的高 |
| C.由石墨制备金刚石是放热反应,等质量时,石墨的能量比金刚石的低 |
| D.由石墨制备金刚石是放热反应,等质量时,石墨的能量比金刚石的高 |
您最近一年使用:0次
2023-10-26更新
|
116次组卷
|
34卷引用:云南省保山市腾冲市第八中学2020-2021学年高一下学期期中考试化学试题
云南省保山市腾冲市第八中学2020-2021学年高一下学期期中考试化学试题(已下线)09~10年江西四校高一下学期期中联考化学卷(已下线)2012-2013学年河北省石家庄市第一中学高一下学期期中考试化学试卷山西省应县第一中学校2018-2019学年高一下学期期中考试化学试题(已下线)2011-2012年山西省平遥中学高二上学期期中考试化学(理)试卷(已下线)2011-2012年陕西宁强天津中学高二下学期期中考试化学试卷(已下线)2012年人教版高中化学必修二2.1 化学能与热能练习卷(已下线)2012-2013学年昆明三中、滇池中学(滇中)高二下期中考试化学卷(已下线)2013届河北省石家庄市第二实验中学高二上学期期中考试文科化学试卷(已下线)2013-2014山西省广灵县第一中学第二学期期末考试高一化学试卷2014-2015浙江省杭州市西湖高级中学高一下学期5月月考化学试卷黑龙江省大庆市第十中学2016-2017学年高一下学期期末考试化学试题福建省长泰县第一中学2020届高三上学期期中考试化学试题山西省晋中市和诚中学2019-2020学年高一4月月考化学试题安徽省阜阳市2019-2020学年高一下学期开学考化学试题宁夏吴忠市吴忠中学2021-2022学年高二上学期月考化学试题陕西省宜君县高级中学2021-2022学年高二上学期第一次月考化学(理)试题(已下线)2010年甘肃省康县一中高二第二学期期末考试化学试题(已下线)2012-2013学年福建省东山县第二中学高二第一次月考化学试卷(已下线)2014-2015学年北京市第六十六中学高二上第一次质量检测化学试卷2015-2016学年湖南省岳阳县第一中学高二上学期第一次月考化学试卷2015-2016学年浙江省台州市书生中学高二上学期第一次月考化学试卷2015-2016学年安徽省阜阳市太和八中高二上学期期末理化学试卷2015-2016学年福建省漳州市东山二中高二上第一次月考化学试卷河北省景县中学2017-2018学年高二开学摸底考试化学试题福建省惠安惠南中学2017-2018学年高二10月月考(理)化学试题甘肃省甘谷县第一中学2018-2019学年高二上学期第一次月考子材班化学试题福建省东山县第二中学2018-2019学年高二上学期第一次(10月)月考化学试题云南省楚雄市楚雄实验中学2018—2019学年高二上学期9月月考化学试题江西省赣州市赣县第三中学2020-2021学年高二上学期9月入学考试化学试题(重点班)天津市静海区大邱庄中学2020-2021学年高二上学期第一次月考化学试题陕西省西安市第八十九中学2022-2023学年高二上学期期末测试化学试题天津市第四十七中学2023-2024学年高二上学期10月月考化学试题天津市第四十七中学2023-2024学年高二上学期第一次月考化学试题
名校
7 . 请完成下列有关非金属元素及其化合物的问题:
(1)氮及其化合物用途广泛。写出 的电子式:
的电子式:_______ 。
(2)将空气中的氮气转化为氮的化合物的过程称为固氮。下列能实现人工固氮的是_______(填字母)。
(3)肼 又称联氨,是一种可燃性的液体,可用作火箭燃料。肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时负极的电极反应式是
又称联氨,是一种可燃性的液体,可用作火箭燃料。肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时负极的电极反应式是_______ 。
(4)传统制备肼的方法,是以 氧化
氧化 ,制得肼的稀溶液。该反应的离子方程式是
,制得肼的稀溶液。该反应的离子方程式是_______ 。
(5)黑火药是中国古代的四大发明之一,其成分含有硝酸盐等,已知其爆炸反应为: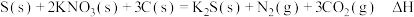
已知①碳的燃烧热为 ,
,
② ,
,
③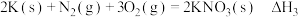 ;
;
则 为
为_______ (用含有 、
、 、
、 的代数式表示)。
的代数式表示)。
(6)铵盐常用作化肥,在实验室中检验 固体中含有
固体中含有 的实验方案为:
的实验方案为:_______ 。
(7)可以用氢氟酸刻蚀玻璃,氢氟酸发生反应的化学方程式是:_______ 。
(1)氮及其化合物用途广泛。写出
 的电子式:
的电子式:(2)将空气中的氮气转化为氮的化合物的过程称为固氮。下列能实现人工固氮的是_______(填字母)。
A. 和 和 在一定条件下反应生成 在一定条件下反应生成 | B.雷雨闪电时空气中的 和 和 化合生成NO 化合生成NO |
C. 经过催化氧化生成NO 经过催化氧化生成NO | D. 和 和 反应生成 反应生成 |
 又称联氨,是一种可燃性的液体,可用作火箭燃料。肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时负极的电极反应式是
又称联氨,是一种可燃性的液体,可用作火箭燃料。肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时负极的电极反应式是(4)传统制备肼的方法,是以
 氧化
氧化 ,制得肼的稀溶液。该反应的离子方程式是
,制得肼的稀溶液。该反应的离子方程式是(5)黑火药是中国古代的四大发明之一,其成分含有硝酸盐等,已知其爆炸反应为:
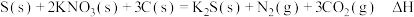
已知①碳的燃烧热为
 ,
,②
 ,
,③
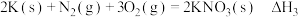 ;
;则
 为
为 、
、 、
、 的代数式表示)。
的代数式表示)。(6)铵盐常用作化肥,在实验室中检验
 固体中含有
固体中含有 的实验方案为:
的实验方案为:(7)可以用氢氟酸刻蚀玻璃,氢氟酸发生反应的化学方程式是:
您最近一年使用:0次
8 . 下列有关说法正确的是
A.已知HI(g)  H2(g)+ H2(g)+ I2(s) ΔH=-26.5 kJ·mol-1,由此可知1 mol HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量 I2(s) ΔH=-26.5 kJ·mol-1,由此可知1 mol HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量 |
| B.已知2H2(g)+O2(g)=2H2O(g) ΔH= -571.6 kJ·mol-1,则氢气的燃烧热为ΔH= -285.8 kJ·mol-1 |
| C.已知2C(s)+2O2(g)=2CO2(g) ΔH1,2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2 |
| D.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ·mol-1 |
您最近一年使用:0次
2023-06-06更新
|
1848次组卷
|
31卷引用:四川省南充市李渡中学2020-2021学年高一下学期期中考试化学试题
四川省南充市李渡中学2020-2021学年高一下学期期中考试化学试题湖北省武汉市第十一中学2019-2020学年高一下学期期中测试化学试题辽宁省大连市一0三中学2020-2021学年高一4月月考化学试题甘肃省甘南藏族自治州舟曲县第一中学2021-2022学年高二上学期期中考试化学试题黑龙江省大庆铁人中学2022-2023学年高一下学期期中考试化学试题【全国百强校】四川省成都市石室中学2018-2019学年高二上学期期中考试化学试题广东省广州大学附属中学2019-2020学年高一下学期期末考试化学试题广东省广州大学附属中学等三校2019~2020学年高一下学期期末联考化学试题江西省南昌县莲塘第三中学2020-2021学年高二上学期期中考试化学试题重庆市朝阳中学2021-2022学年高二10月月考化学试题广西贵港市江南中学2021-2022学年高二上学期12月月考化学(理科)试题吉林省汪清县第六中学2021-2022学年高二12月月考化学试题内蒙古赤峰市第四中学分校2021-2022学年高二上学期9月月考化学试题陕西省宝鸡市金台区2022-2023学年高一下学期期末考试化学试题广东省深圳市罗湖外语学校2023-2024学年高二上学期期中考试化学试题湖南省长沙市明德中学2019-2020学年高二下学期第一次月考化学试题河南省南阳市第一中学2019-2020学年高二下学期第三次月考(6月)化学试题(已下线)1.1.2 热化学方程式 燃烧热(练习)——2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)(已下线)1.3.2 反应热的计算(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)第一章 化学反应与能量(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版选修4)(已下线)1.3.1+盖斯定律-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)山东省德州市夏津第一中学2020-2021学年高二上学期9月月考化学试题江西省赣州市会昌县第五中学2020-2021学年高二上学期第一次月考化学试题吉林省延边第二中学2020-2021学年高二上学期第二次考试月考化学试题云南省富源县第一中学2020-2021学年高二上学期第一次统测化学试题黑龙江省大兴安岭呼玛县高级中学2021-2022学年高二上学期期末考试化学试题(已下线)考点巩固卷07 化学反应与能量(3大考点45题)-2024年高考化学一轮复习考点通关卷(新高考通用)黑龙江省佳木斯市第一中学2023-2024学年高二上学期10月月考化学试题河南省商丘市第一高级中学2023-2024学年高三上学期10月份月考化学试题江西省宜春市上高二中2023-2024学年高二上学期第一次月考化学试题陕西省汉中市乡县第一中学2023-2024学年高二上学期10月月考化学试题
名校
解题方法
9 . I.某学习小组利用铁与稀硫酸的反应,探究影响化学反应速率的因素,结果如表:
(1)实验1、2表明_______ 对反应速率有影响。
(2)探究反应物浓度影响反应速率的实验有_______ (填实验序号)。
(3)该小组的实验中,探究的反应速率的影响因素还有_______ ,体现该影响因素的实验有_______ (填实验序号)。
II汽车尾气的主要成分有CO、SO2、NO、NO2等。
(4)利用氨水可以将SO2、NO2吸收,原理如下图所示:
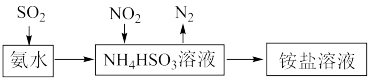
请写出NO2被吸收反应的离子方程式_______ 。
(5)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①已知:
反应Ⅰ:2NO(g)+O2(g)=2NO2(g) ΔH1=-113.0kJ·mol-1
反应Ⅱ:2SO2(g)+O2(g)=2SO3(1) ΔH2=-288.4kJ·mol-1
反应Ⅲ:3NO2(g)+H2O(g)=2HNO3+NO(g) ΔH3=-138.0kJ·mol-1
则反应NO2(g)+SO2(g)=NO(g)+SO3(1) ΔH4=_______ 。
②已知TiO2催化尾气降解原理可表示为:
2CO(g)+O2(g) 2CO2(g) ΔH5;
2CO2(g) ΔH5;
2H2O(g)+4NO(g)+3O2(g) 4HNO3(g) ΔH6。
4HNO3(g) ΔH6。
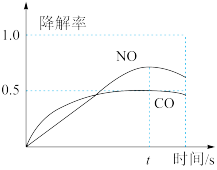
在O2、H2O(g)浓度一定条件下,模拟CO、NO的降解,得到其降解率(即转化率)如下图所示。请解释ts后NO降解率下降的可能原因_______ 。
| 实验序号 | 铁的质量(g) | 铁的形态 | V(H2SO4) | c(H2SO4)(mol/L) | 反应前溶液的温度(℃) | 金属完全消失的时间(s) |
| 1 | 0.10 | 片状 | 50 | 0.8 | 20 | 200 |
| 2 | 0.10 | 粉状 | 50 | 0.8 | 20 | 25 |
| 3 | 0.10 | 片状 | 50 | 1.0 | 20 | 125 |
| 4 | 0.10 | 片状 | 50 | 1.0 | 35 | 50 |
(1)实验1、2表明
(2)探究反应物浓度影响反应速率的实验有
(3)该小组的实验中,探究的反应速率的影响因素还有
II汽车尾气的主要成分有CO、SO2、NO、NO2等。
(4)利用氨水可以将SO2、NO2吸收,原理如下图所示:
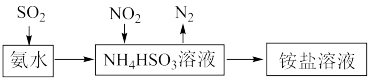
请写出NO2被吸收反应的离子方程式
(5)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①已知:
反应Ⅰ:2NO(g)+O2(g)=2NO2(g) ΔH1=-113.0kJ·mol-1
反应Ⅱ:2SO2(g)+O2(g)=2SO3(1) ΔH2=-288.4kJ·mol-1
反应Ⅲ:3NO2(g)+H2O(g)=2HNO3+NO(g) ΔH3=-138.0kJ·mol-1
则反应NO2(g)+SO2(g)=NO(g)+SO3(1) ΔH4=
②已知TiO2催化尾气降解原理可表示为:
2CO(g)+O2(g)
 2CO2(g) ΔH5;
2CO2(g) ΔH5;2H2O(g)+4NO(g)+3O2(g)
 4HNO3(g) ΔH6。
4HNO3(g) ΔH6。在O2、H2O(g)浓度一定条件下,模拟CO、NO的降解,得到其降解率(即转化率)如下图所示。请解释ts后NO降解率下降的可能原因

您最近一年使用:0次
名校
解题方法
10 . 实验室利用下列装置模拟工业生产制备少量硝酸。
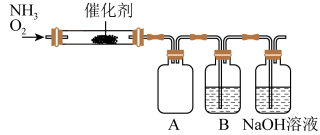
(1)实验结束时,两种反应气体中需要再持续通入_______ (填化学式)一段时间。
(2)B中反应的化学方程式为_______ 。
(3)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上。下列图示中,能够正确表示该反应过程能量变化的是_______
(4)已知:①2H2(g)+O2(g)=2H2O(1) △H=-571.5kJ/mol
②N2(g)+2O2(g)=2NO2(g) △H=+68.0kJ/mol
③N2(g)+3H2(g)=2NH3(g) △H=-92.5kJ/mol
则:8NH3(g)+6NO2(g)=7N2(g)+12H2O(l) △H=_______ kJ/mol
(5)控制氨气和氧气的比例是制备硝酸的关键。
①当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。白烟是_______ (填化学式)。
②理论上使氨气完全转化为硝酸,则NH3与O2(相同条件下)的体积比应满足V(NH3):V(O2)_____ 。

(1)实验结束时,两种反应气体中需要再持续通入
(2)B中反应的化学方程式为
(3)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上。下列图示中,能够正确表示该反应过程能量变化的是_______
A.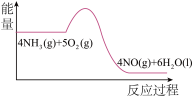 | B.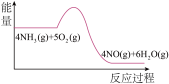 | C.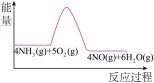 | D.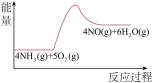 |
②N2(g)+2O2(g)=2NO2(g) △H=+68.0kJ/mol
③N2(g)+3H2(g)=2NH3(g) △H=-92.5kJ/mol
则:8NH3(g)+6NO2(g)=7N2(g)+12H2O(l) △H=
(5)控制氨气和氧气的比例是制备硝酸的关键。
①当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。白烟是
②理论上使氨气完全转化为硝酸,则NH3与O2(相同条件下)的体积比应满足V(NH3):V(O2)
您最近一年使用:0次