名校
1 . 甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、 和
和 )在催化剂作用下可合成甲醇,发生的主要反应如下:
)在催化剂作用下可合成甲醇,发生的主要反应如下:
Ⅰ.
 kJ⋅mol
kJ⋅mol ;
;
Ⅱ.
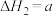 kJ⋅mol
kJ⋅mol ;
;
Ⅲ.
 kJ⋅mol
kJ⋅mol 。
。
(1)
___________ 。
(2)将2.0 mol 和3.0 mol
和3.0 mol  通入容积为3 L的恒容密闭容器中,在一定条件下发生反应Ⅱ,测得
通入容积为3 L的恒容密闭容器中,在一定条件下发生反应Ⅱ,测得 的平衡转化率与温度的关系如图所示。
的平衡转化率与温度的关系如图所示。
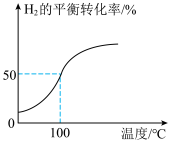
①100℃时反应达到平衡所需的时间为5 min,则反应从起始至5 min内,用 表示该反应的平均反应速率为
表示该反应的平均反应速率为___________ ;平衡后向容器中再通入3 mol Ar,平衡___________ (填“正向”“逆向”或“不”)移动。
②100℃时,反应Ⅱ的平衡常数
___________ 。
③若改变条件使平衡常数增大,则从改变条件至再次平衡正反应速率的变化为___________ 。
(3)甲醇会对水质造成一定的污染,有一种电化学法可消除稀硫酸和甲醇这种污染,其原理如下:通电后,将 氧化成
氧化成 ,下图然后以
,下图然后以 作氧化剂,将水中的甲醇氧化成
作氧化剂,将水中的甲醇氧化成 而净化。实验室用如图装置模拟上述过程。
而净化。实验室用如图装置模拟上述过程。
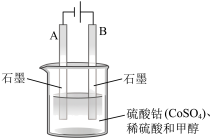
①写出阳极的电极反应式:___________ 。
②写出除去甲醇的离子方程式:___________ 。
 和
和 )在催化剂作用下可合成甲醇,发生的主要反应如下:
)在催化剂作用下可合成甲醇,发生的主要反应如下:Ⅰ.

 kJ⋅mol
kJ⋅mol ;
;Ⅱ.

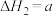 kJ⋅mol
kJ⋅mol ;
;Ⅲ.

 kJ⋅mol
kJ⋅mol 。
。(1)

(2)将2.0 mol
 和3.0 mol
和3.0 mol  通入容积为3 L的恒容密闭容器中,在一定条件下发生反应Ⅱ,测得
通入容积为3 L的恒容密闭容器中,在一定条件下发生反应Ⅱ,测得 的平衡转化率与温度的关系如图所示。
的平衡转化率与温度的关系如图所示。
①100℃时反应达到平衡所需的时间为5 min,则反应从起始至5 min内,用
 表示该反应的平均反应速率为
表示该反应的平均反应速率为②100℃时,反应Ⅱ的平衡常数

③若改变条件使平衡常数增大,则从改变条件至再次平衡正反应速率的变化为
(3)甲醇会对水质造成一定的污染,有一种电化学法可消除稀硫酸和甲醇这种污染,其原理如下:通电后,将
 氧化成
氧化成 ,下图然后以
,下图然后以 作氧化剂,将水中的甲醇氧化成
作氧化剂,将水中的甲醇氧化成 而净化。实验室用如图装置模拟上述过程。
而净化。实验室用如图装置模拟上述过程。
①写出阳极的电极反应式:
②写出除去甲醇的离子方程式:
您最近一年使用:0次
名校
解题方法
2 . 已知反应① 和反应②
和反应② 在T℃时的平衡常数分别为
在T℃时的平衡常数分别为 和
和 ,该温度下反应③
,该温度下反应③ 的平衡常数为
的平衡常数为 。则下列说法正确的是
。则下列说法正确的是
 和反应②
和反应② 在T℃时的平衡常数分别为
在T℃时的平衡常数分别为 和
和 ,该温度下反应③
,该温度下反应③ 的平衡常数为
的平衡常数为 。则下列说法正确的是
。则下列说法正确的是A.反应①的平衡常数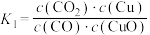 |
B.反应②中,增大氢气浓度,平衡正移, 增大 增大 |
C.对于反应③,T℃时,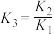 |
| D.对于反应③,恒容时,温度升高,K值减小,则该反应为放热反应 |
您最近一年使用:0次
3 . 镁和卤素单质( )反应的相对能量变化如图所示,下列说法正确的是
)反应的相对能量变化如图所示,下列说法正确的是
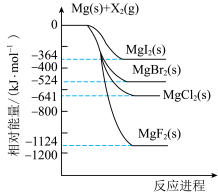
 )反应的相对能量变化如图所示,下列说法正确的是
)反应的相对能量变化如图所示,下列说法正确的是
A.热稳定性: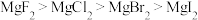 |
| B.1mol碘晶体与足量的Mg充分反应,放热364kJ |
C.工业上常用电解 溶液的方法冶炼金属Mg 溶液的方法冶炼金属Mg |
D.由图可知, 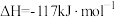 |
您最近一年使用:0次
2023-10-28更新
|
226次组卷
|
2卷引用:福建省漳州市东山县2023-2024学年高二上学期期中考试化学试题
名校
解题方法
4 . 如图1、图2分别表示 和
和 分解时的能量变化情况(单位:kJ)。下列说法错误的是
分解时的能量变化情况(单位:kJ)。下列说法错误的是
 和
和 分解时的能量变化情况(单位:kJ)。下列说法错误的是
分解时的能量变化情况(单位:kJ)。下列说法错误的是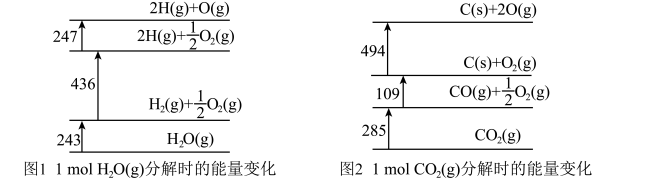
A.CO的燃烧热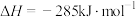 |
B. 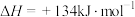 |
C.O=O的键能为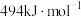 |
D.无法求得 的反应热 的反应热 |
您最近一年使用:0次
2023-10-27更新
|
469次组卷
|
11卷引用:福建省厦门外国语学校2023-2024学年高二上学期期中考试化学试题
福建省厦门外国语学校2023-2024学年高二上学期期中考试化学试题江西省上饶市广信中学2023-2024学年高二上学期11月月考化学试题河南省豫北名校2024届高三毕业班上学期一轮复习联考(二)化学试题山西省部分学校2023-2024学年高三上学期10月月考(一轮复习联考(二))化学试题河北省石家庄部分高中2023-2024学年高三上学期10月期中考试化学试题甘肃省部分校2024届高三上学期10月月考化学试题辽宁省部分学校2023-2024学年高三上学期一轮复习联考(二)化学试题重庆市百师联盟2024届高三一轮复习联考(二)(已下线)寒假作业01 化学反应的热效应-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)河北省保定市唐县第一中学2023-2024学年高三上学期11月期中考试化学试题(已下线)专题05 化学反应与能量-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
名校
5 . 火箭推进器中装有还原剂液态肼(N2H4)和氧化剂过氧化氢(H2O2),当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量。回答下列问题:
(1)过氧化氢的电子式是___________ 。
(2)该反应的热化学方程式为___________ 。
(3)实验室可用次氯酸钠溶液与氨气反应制备液态肼,已知生成物之一是常见的盐,则反应的化学方程式为___________ 。
(4)在微生物作用的条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
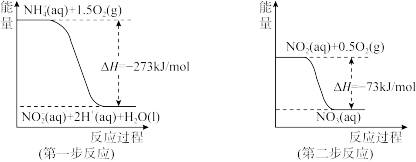
①第一步反应是___________ (填“放热”或“吸热”)反应,判断依据是___________ 。
②1 mol NH (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的反应热ΔH是
(aq)的反应热ΔH是___________ 。
(5)已知: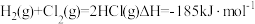 ,几种化学键的键能如下表所示,则a=
,几种化学键的键能如下表所示,则a=___________ 。
(1)过氧化氢的电子式是
(2)该反应的热化学方程式为
(3)实验室可用次氯酸钠溶液与氨气反应制备液态肼,已知生成物之一是常见的盐,则反应的化学方程式为
(4)在微生物作用的条件下,NH
 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
①第一步反应是
②1 mol NH
 (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的反应热ΔH是
(aq)的反应热ΔH是(5)已知:
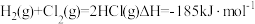 ,几种化学键的键能如下表所示,则a=
,几种化学键的键能如下表所示,则a=| 共价键 | H-H | Cl-Cl | H-Cl |
键能/( ) ) | 436 | 247 | a |
您最近一年使用:0次
2023-10-24更新
|
206次组卷
|
2卷引用:福建省漳州市东山县2023-2024学年高二上学期期中考试化学试题
6 . 已知下列反应的平衡常数:
S(s)+ O2(g)⇌SO2(g),K1;
H2(g) +S(s)⇌H2S(g), K2;
则反应H2(g) +SO2(g)⇌O2(g) +H2S(g)的平衡常数是
S(s)+ O2(g)⇌SO2(g),K1;
H2(g) +S(s)⇌H2S(g), K2;
则反应H2(g) +SO2(g)⇌O2(g) +H2S(g)的平衡常数是
| A.K1+K2 | B.K2−K1 | C.K1 ×K2 | D.K2/K1 |
您最近一年使用:0次
2023-10-24更新
|
204次组卷
|
2卷引用:福建省建瓯市芝华中学2023-2024学年高二上学期期中考试化学试题
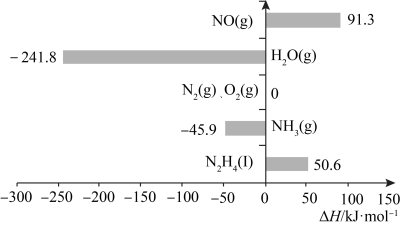
7 . 已知:在标准压强101kPa、25℃,由最稳定的单质合成1mol物质B的反应焓变,叫做物质B的标准摩尔生成焓,用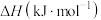 表示。有关物质的标准摩尔生成焓
表示。有关物质的标准摩尔生成焓 如图所示,下列有关判断正确的是
如图所示,下列有关判断正确的是
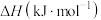 表示。有关物质的标准摩尔生成焓
表示。有关物质的标准摩尔生成焓 如图所示,下列有关判断正确的是
如图所示,下列有关判断正确的是
A.H2O(l)的 | B.N2H4(l)的标准燃烧热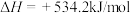 |
| C.N2H4比NH3稳定 | D.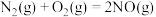 是放热反应 是放热反应 |
您最近一年使用:0次
2023-10-15更新
|
408次组卷
|
3卷引用:福建省厦门外国语学校2023-2024学年高二上学期期中考试化学试题
8 . 化学反应过程伴随有热量的变化。
(1)在尿素合成塔中的主要反应可表示如下:
反应I:
反应Ⅱ: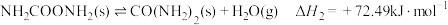
总反应: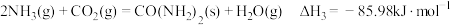
则反应I的
___________  。
。
(2)利用CH4可制备乙烯及合成气(CO、H2)。
①有关化学键键能(E)的数据如下表:
则

___________ 。(用a、b、c、d表示)
②制备合成气反应历程分两步(步骤I、步骤Ⅱ,反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:
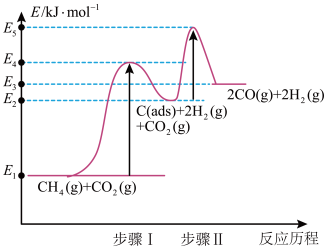
步骤1反应的焓变 为
为___________ kJ/mol(选用E1~E5的关系式表示)。
③反应 的焓变为
的焓变为 ,与步骤1焓变
,与步骤1焓变 相比,
相比,
___________  (填“>”或“<)。
(填“>”或“<)。
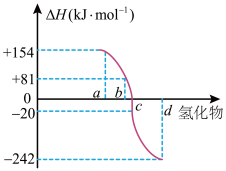
(3)一定条件下,由稳定单质反应生成1mol化合物的反应热叫该化合物的生成热( )。下图为VIA族元素(O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。已知非金属元素气态氢化物的稳定性越强,其氢化物的生成热
)。下图为VIA族元素(O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。已知非金属元素气态氢化物的稳定性越强,其氢化物的生成热 越小。硫化氢发生分解反应的热化学方程式为
越小。硫化氢发生分解反应的热化学方程式为___________ 。
(1)在尿素合成塔中的主要反应可表示如下:
反应I:

反应Ⅱ:
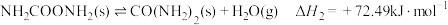
总反应:
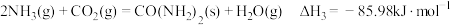
则反应I的

 。
。(2)利用CH4可制备乙烯及合成气(CO、H2)。
①有关化学键键能(E)的数据如下表:
| 化学键 | H—H | C=C | C—C | C—H |
| E(kJ/mol) | a | b | c | d |


②制备合成气反应历程分两步(步骤I、步骤Ⅱ,反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:

步骤1反应的焓变
 为
为③反应
 的焓变为
的焓变为 ,与步骤1焓变
,与步骤1焓变 相比,
相比,
 (填“>”或“<)。
(填“>”或“<)。(3)一定条件下,由稳定单质反应生成1mol化合物的反应热叫该化合物的生成热(
 )。下图为VIA族元素(O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。已知非金属元素气态氢化物的稳定性越强,其氢化物的生成热
)。下图为VIA族元素(O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。已知非金属元素气态氢化物的稳定性越强,其氢化物的生成热 越小。硫化氢发生分解反应的热化学方程式为
越小。硫化氢发生分解反应的热化学方程式为
您最近一年使用:0次
名校
解题方法
9 . 请回答下列问题:
(1)工业上以 和
和 为原料在一定温度和压强下合成尿素。
为原料在一定温度和压强下合成尿素。
反应分两步:i. 和
和 生成
生成 ;ii.
;ii. 分解生成尿素。
分解生成尿素。
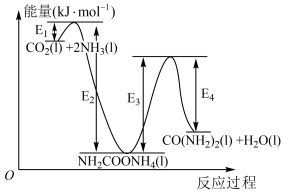
结合反应过程中能量变化示意图,合成尿素总反应的 为
为___________ 。(用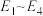 列式表示)
列式表示)
(2)根据表格计算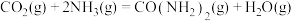

___________ 。
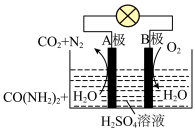
(3)尿素 燃料电池可直接去除城市废水中的尿素,既能产生净化水,又能发电。其装置如下图所示,正极反应为
燃料电池可直接去除城市废水中的尿素,既能产生净化水,又能发电。其装置如下图所示,正极反应为___________ 。
(4)近年研究发现,电催化 和含氮物质(
和含氮物质( 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的 溶液通
溶液通 至饱和,在电极上反应生成
至饱和,在电极上反应生成 ,电解原理如图所示。
,电解原理如图所示。
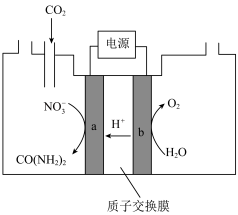
①电极b是电解池的___________ 极。
②尿素分子中,C元素的价态为___________ 。电解过程中生成尿素的电极反应为___________ 。
(5)以石墨为阳极、铁为阴极电解含 废水可用于去除
废水可用于去除 。电解过程中各种含氮微粒的浓度、溶液的pH与时间的关系如图所示。
。电解过程中各种含氮微粒的浓度、溶液的pH与时间的关系如图所示。

①0~1 min时,阴极发生的主要电极反应方程式为___________ 。
②若向废水中加入一定量的NaCl,则电解后的废水中 几乎完全转化为
几乎完全转化为 ,原因是
,原因是___________ 。
(1)工业上以
 和
和 为原料在一定温度和压强下合成尿素。
为原料在一定温度和压强下合成尿素。反应分两步:i.
 和
和 生成
生成 ;ii.
;ii. 分解生成尿素。
分解生成尿素。
结合反应过程中能量变化示意图,合成尿素总反应的
 为
为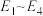 列式表示)
列式表示)(2)根据表格计算
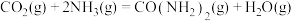

| 化学键 |  |  |  |  |
键能( ) ) | 389 | 728 | 305 | 464 |
(3)尿素
 燃料电池可直接去除城市废水中的尿素,既能产生净化水,又能发电。其装置如下图所示,正极反应为
燃料电池可直接去除城市废水中的尿素,既能产生净化水,又能发电。其装置如下图所示,正极反应为
(4)近年研究发现,电催化
 和含氮物质(
和含氮物质( 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的 溶液通
溶液通 至饱和,在电极上反应生成
至饱和,在电极上反应生成 ,电解原理如图所示。
,电解原理如图所示。
①电极b是电解池的
②尿素分子中,C元素的价态为
(5)以石墨为阳极、铁为阴极电解含
 废水可用于去除
废水可用于去除 。电解过程中各种含氮微粒的浓度、溶液的pH与时间的关系如图所示。
。电解过程中各种含氮微粒的浓度、溶液的pH与时间的关系如图所示。
①0~1 min时,阴极发生的主要电极反应方程式为
②若向废水中加入一定量的NaCl,则电解后的废水中
 几乎完全转化为
几乎完全转化为 ,原因是
,原因是
您最近一年使用:0次
名校
解题方法
10 . A.为探究碳酸钠、碳酸氢钠分别与稀盐酸反应的热效应,某化学兴趣小组进行如下实验。
查阅资料:反应Ⅰ: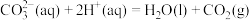
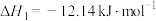 ;
;
反应Ⅱ: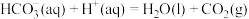
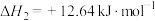
(1)反应Ⅲ:向碳酸钠溶液中滴加少量盐酸生成碳酸氢钠的离子反应的热化学方程式为___________ 。
(2)向 碳酸钠溶液中,逐滴加入
碳酸钠溶液中,逐滴加入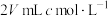 稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是___________(填标号)。
稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是___________(填标号)。
B.实验探究:按表格所示用量,在量热器中将相应试剂混合后测定温度,验证碳酸钠、碳酸氢钠分别与稀盐酸反应的热效应。

表格1:
表格2:
表格3:
(3)表格1实验___________ (填“能”或“否”)验证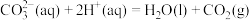
 ,
,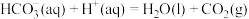
 。
。
(4)实验中玻璃搅拌器的使用方法是___________ 。(填标号)
A.顺时针搅拌 B.逆时针搅拌 C.上下拉动
(5)进行表格3操作的目的是___________ 。
(6)结合实验探究所得的结论进行分析判断。
反应Ⅳ: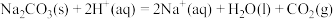
 ;
;
反应Ⅴ: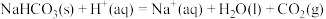

则
___________  (填“>”、“<”或“=”,下同),
(填“>”、“<”或“=”,下同),
___________  。
。
查阅资料:反应Ⅰ:
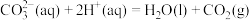
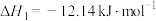 ;
;反应Ⅱ:
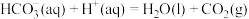
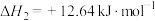
(1)反应Ⅲ:向碳酸钠溶液中滴加少量盐酸生成碳酸氢钠的离子反应的热化学方程式为
(2)向
 碳酸钠溶液中,逐滴加入
碳酸钠溶液中,逐滴加入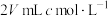 稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是___________(填标号)。
稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是___________(填标号)。A.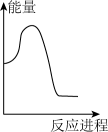 | B.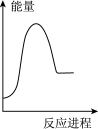 | C.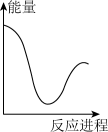 | D.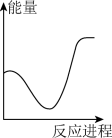 |
B.实验探究:按表格所示用量,在量热器中将相应试剂混合后测定温度,验证碳酸钠、碳酸氢钠分别与稀盐酸反应的热效应。

表格1:
| 试剂1 | 试剂2 | 试剂1和试剂2混合后温度 |
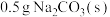 | 19.0℃的40 mL HCl | 21.7℃ |
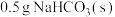 | 19.0℃的40 mL HCl | 18.1℃ |
| 试剂1 | 试剂2 | 试剂1溶解于试剂2后的温度 | 静置后混合液的温度 | 试剂3 | 静置后混合液再加入试剂3后的温度 |
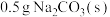 | 19.0℃的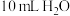 | 22.3℃ | 19.0℃ | 19.0℃的10 mL HCl | 20.5℃ |
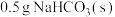 | 19.0℃的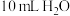 | 17.5℃ | 19.0℃ | 19.0℃的10 mL HCl | 18.3℃ |
| 试剂1 | 试剂2 | 试剂1溶解于试剂2后的温度 | 静置后混合液的温度 | 试剂3 | 静置后混合液再加入试剂3后的温度 |
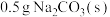 | 19.0℃的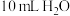 | 22.3℃ | 19.0℃ | 19.0℃的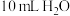 | 19.0℃ |
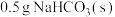 | 19.0℃的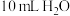 | 17.5℃ | 19.0℃ | 19.0℃的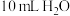 | 19.0℃ |
(3)表格1实验
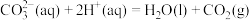
 ,
,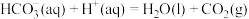
 。
。(4)实验中玻璃搅拌器的使用方法是
A.顺时针搅拌 B.逆时针搅拌 C.上下拉动
(5)进行表格3操作的目的是
(6)结合实验探究所得的结论进行分析判断。
反应Ⅳ:
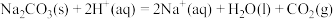
 ;
;反应Ⅴ:
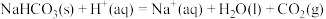

则

 (填“>”、“<”或“=”,下同),
(填“>”、“<”或“=”,下同),
 。
。
您最近一年使用:0次



