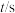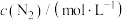名校
1 . 多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T ℃时(各物质均为气态),甲醇与水在铜基催化剂上的反应机理和能量图如图:

已知:
下列说法正确的是

已知:

下列说法正确的是
| A.反应Ⅱ的热化学方程式为CO(g)+H2O(g)=H2(g)+CO2(g) ΔH=+a kJ·mol-1(a>0) |
| B.1 mol CH3OH(g)和1 mol H2O(g)的总能量大于1 mol CO2(g)和3 mol H2(g)的总能量 |
| C.选择优良的催化剂,有利于减少过程中的能耗 |
| D.CO(g)在反应中生成又消耗,CO(g)可认为是催化剂 |
您最近一年使用:0次
2023-08-14更新
|
561次组卷
|
3卷引用:福建省宁德第一中学2023-2024学年高二上学期9月月考化学试题
名校
2 . 二硫化碳用于制造人造丝、杀虫剂、促进剂等,也用作溶剂。回答下列问题:
(1)下列反应的焓变及平衡常数如下:
(Ⅰ)


(Ⅱ)
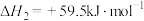
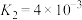
(Ⅲ)
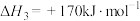
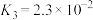
(Ⅳ)
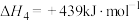

①反应(Ⅳ)自发进行的条件是_______ (填字母)。
A.高温 B.低温 C.任意温度
②
_______  ;
;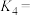
_______ 。
(2)硫化氢替代硫黄生产二硫化碳的原理为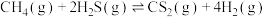 ,起始时,
,起始时,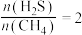 。在100 kPa压强下测得不同温度时的平衡组成如图1所示,在不同压强下测得的平衡组成如图2所示:
。在100 kPa压强下测得不同温度时的平衡组成如图1所示,在不同压强下测得的平衡组成如图2所示:

①该反应的
_______ 0(填“>”或“<”);图2中a、d代表的物质分别是_______ 、_______ 。
②图1中,X点H2S的转化率为_______ %。
③为提高该反应中H2S的平衡转化率,除改变温度和压强外,还可采取的措施是_______ 。
(1)下列反应的焓变及平衡常数如下:
(Ⅰ)



(Ⅱ)

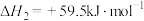
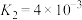
(Ⅲ)

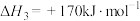
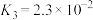
(Ⅳ)

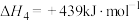

①反应(Ⅳ)自发进行的条件是
A.高温 B.低温 C.任意温度
②

 ;
;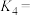
(2)硫化氢替代硫黄生产二硫化碳的原理为
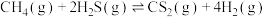 ,起始时,
,起始时,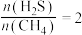 。在100 kPa压强下测得不同温度时的平衡组成如图1所示,在不同压强下测得的平衡组成如图2所示:
。在100 kPa压强下测得不同温度时的平衡组成如图1所示,在不同压强下测得的平衡组成如图2所示:
①该反应的

②图1中,X点H2S的转化率为
③为提高该反应中H2S的平衡转化率,除改变温度和压强外,还可采取的措施是
您最近一年使用:0次
2023-08-14更新
|
131次组卷
|
3卷引用:福建省三明第一中学2023-2024学年高二上学期10月月考化学试题
3 . 利用CO2催化加氢制二甲醚,可以实现CO2的再利用,该过程中涉及以下两个反应:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2
CH3OCH3(g)+H2O(g) ΔH2
则反应2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)的ΔH为
CH3OCH3(g)+3H2O(g)的ΔH为
①CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1②2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH2
CH3OCH3(g)+H2O(g) ΔH2则反应2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g)的ΔH为
CH3OCH3(g)+3H2O(g)的ΔH为| A.2ΔH1+ΔH2 | B.2ΔH1-ΔH2 | C.ΔH1+2ΔH2 | D.ΔH1+ΔH2 |
您最近一年使用:0次
2023-08-02更新
|
534次组卷
|
4卷引用:福建省福州市延安中学2023-2024学年高二上学期期中考试化学试题
福建省福州市延安中学2023-2024学年高二上学期期中考试化学试题新疆生产建设兵团第二师八一中学2023-2024学年高二上学期第一次月考化学试题辽宁省部分学校2022-2023学年高一下学期期末考试化学试题(已下线)寒假作业01 化学反应的热效应-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)
名校
4 . NO催化 生成
生成 的过程由以下三步基元反应构成:
的过程由以下三步基元反应构成:
第1步:
 ;
;
第2步: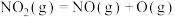
 ;
;
第3步:

 生成
生成 的过程由以下三步基元反应构成:
的过程由以下三步基元反应构成:第1步:

 ;
;第2步:
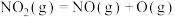
 ;
;第3步:


| A.第2步是总反应的决速步 |
| B.三步基元反应都是放热反应 |
| C.该过程共有两种中间产物 |
D.总反应 的焓变为 的焓变为 |
您最近一年使用:0次
2023-07-31更新
|
485次组卷
|
7卷引用:福建省福州高新区第一中学(闽侯县第三中学)2023-2024学年高二上学期12月月考化学试题
福建省福州高新区第一中学(闽侯县第三中学)2023-2024学年高二上学期12月月考化学试题福建省福州市闽 闽侯县第一中学2023-2024学年高二上学期12月月考化学试题福建省莆田第七中学、第十一中学、第十五中学等校2023-2024学年高二上学期期末联考化学试题江苏省淮安市2022-2023学年高二上学期期末考试化学试题江苏省苏州震泽中学2023~2024学年高二上学期10月月考化学试题(已下线)专题07 化学能与热能、电能-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(江苏专用)江苏省苏州市吴江市高级中学2023-2024学年高二上学期10月月考化学试题
名校
5 . 填空
(1)已知下列热化学方程式:
①H2O(1)=H2(g)+ O2(g) △H1=285.8 kJ∙mol−1
O2(g) △H1=285.8 kJ∙mol−1
②C(s)+ O2(g)=CO(g) △H2=−110.5 kJ∙mol−1
O2(g)=CO(g) △H2=−110.5 kJ∙mol−1
③H2O(g)=H2(g)+ O2(g) △H3=241.8 kJ∙mol−1
O2(g) △H3=241.8 kJ∙mol−1
上述反应中属于放热反应的是_____ 。
(2)①的反应过程是太阳光催化分解水制氢气,该反应中主要能量转化形式为_____ 。
a.太阳能转化为化学能 b.化学能转化为电能
(3)若反应③使用催化剂,那么△H3将_____ (填“增大”“减小”或“不变”)
(4)反应C(s)+H2O(g)=CO(g)+H2(g)的△H=_____ kJ∙mol−1。
(5)0.1mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼(B2O3)和气态水,释放203.3kJ的热。
①写出反应的热化学方程式_____ 。
②H2O(1)=H2O(g) △H=_____ kJ∙mol−1。
③11.2L(标准状况)气态乙硼烷(B2H6)完全燃烧生成液态水生成的热_____ kJ。
(1)已知下列热化学方程式:
①H2O(1)=H2(g)+
 O2(g) △H1=285.8 kJ∙mol−1
O2(g) △H1=285.8 kJ∙mol−1②C(s)+
 O2(g)=CO(g) △H2=−110.5 kJ∙mol−1
O2(g)=CO(g) △H2=−110.5 kJ∙mol−1③H2O(g)=H2(g)+
 O2(g) △H3=241.8 kJ∙mol−1
O2(g) △H3=241.8 kJ∙mol−1上述反应中属于放热反应的是
(2)①的反应过程是太阳光催化分解水制氢气,该反应中主要能量转化形式为
a.太阳能转化为化学能 b.化学能转化为电能
(3)若反应③使用催化剂,那么△H3将
(4)反应C(s)+H2O(g)=CO(g)+H2(g)的△H=
(5)0.1mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼(B2O3)和气态水,释放203.3kJ的热。
①写出反应的热化学方程式
②H2O(1)=H2O(g) △H=
③11.2L(标准状况)气态乙硼烷(B2H6)完全燃烧生成液态水生成的热
您最近一年使用:0次
2023-07-28更新
|
453次组卷
|
2卷引用:福建省莆田第二十五中学2023-2024学年高二上学期期中考试化学试题
名校
6 . 某科学家利用二氧化铈 在太阳能作用下将
在太阳能作用下将 转变成
转变成 。其过程如下:
。其过程如下:
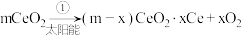
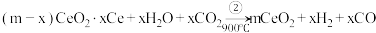
下列说法不正确 的是
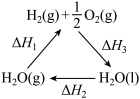
 在太阳能作用下将
在太阳能作用下将 转变成
转变成 。其过程如下:
。其过程如下: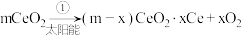
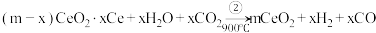
下列说法

A.该过程中 起到了催化作用 起到了催化作用 |
| B.该过程实现了太阳能向化学能的转化 |
C.如图中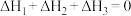 |
D.以 和 和 构成的碱性燃料电池的负极反应式为 构成的碱性燃料电池的负极反应式为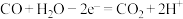 |
您最近一年使用:0次
2023-07-17更新
|
153次组卷
|
2卷引用:福建省莆田第二十五中学2023-2024学年高二上学期期中考试化学试题
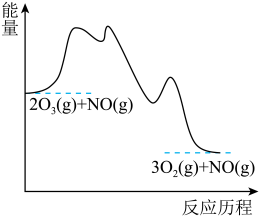
7 . 研究氮氧化物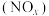 还原处理方法是环保领域的主要方向之一。上海复兴路的“生态马路”运用了“光触媒”技术,即在路面上涂了一层光催化剂涂料,可将汽车尾气中部分NO和
还原处理方法是环保领域的主要方向之一。上海复兴路的“生态马路”运用了“光触媒”技术,即在路面上涂了一层光催化剂涂料,可将汽车尾气中部分NO和 转化为
转化为 和
和 。
。
(1)在密闭容器中发生该反应,氮气浓度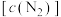 随温度
随温度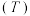 、时间
、时间 的变化关系如下表。
的变化关系如下表。
据此判断:
①
___________  (填“>”或“<”)。
(填“>”或“<”)。
② 时,
时, 内的
内的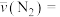
___________  。
。
(2)在绝热、恒容的密闭体系中充入一定量的 和
和 气体,反应达到平衡的标志是_______。
气体,反应达到平衡的标志是_______。
(3)计算机模拟 还原
还原 的反应经历以下3个步骤:
的反应经历以下3个步骤:
I: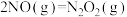
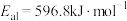
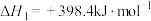
II:
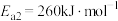
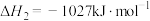
III :
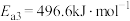
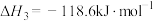
①反应过程的决速步骤是___________ (填“I”“II”或“III”)。
②总反应的热化学方程式为___________ 。
(4)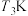 时,在刚性密闭容器中充入物质的量之比为
时,在刚性密闭容器中充入物质的量之比为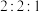 的
的 、
、 和
和 的混合气体,起始气体总压强为
的混合气体,起始气体总压强为 ,达到平衡时气体总压强为
,达到平衡时气体总压强为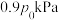 。实验测得:
。实验测得: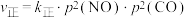 ,
,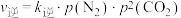 ,其中
,其中 、
、 分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=总压×物质的量分数)。
分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=总压×物质的量分数)。
①平衡后升高温度, 增大的倍数比
增大的倍数比 的
的___________ (填“大”或“小”)。
② 的平衡转化率为
的平衡转化率为___________ 。
③
___________ (用含 的代数式表示)。
的代数式表示)。
(5)该反应的某种催化剂的催化效率与NO的消耗速率随温度的变化关系如图所示。300~350℃之间,NO的消耗速率加快的原因是___________ 。

 还原处理方法是环保领域的主要方向之一。上海复兴路的“生态马路”运用了“光触媒”技术,即在路面上涂了一层光催化剂涂料,可将汽车尾气中部分NO和
还原处理方法是环保领域的主要方向之一。上海复兴路的“生态马路”运用了“光触媒”技术,即在路面上涂了一层光催化剂涂料,可将汽车尾气中部分NO和 转化为
转化为 和
和 。
。(1)在密闭容器中发生该反应,氮气浓度
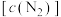 随温度
随温度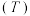 、时间
、时间 的变化关系如下表。
的变化关系如下表。
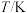 | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
 | 0 | 0.10 | 0.18 | 0.25 | 0.25 | 0.25 | 0.25 |
 | 0 | 0.08 | 0.15 | 0.21 | 0.26 | 0.29 | 0.29 |
①

 (填“>”或“<”)。
(填“>”或“<”)。②
 时,
时, 内的
内的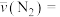
 。
。(2)在绝热、恒容的密闭体系中充入一定量的
 和
和 气体,反应达到平衡的标志是_______。
气体,反应达到平衡的标志是_______。| A.体系温度不变 | B. |
C. 的体积分数不变 的体积分数不变 | D. |
 还原
还原 的反应经历以下3个步骤:
的反应经历以下3个步骤:I:
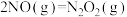
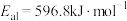
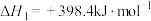
II:

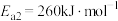
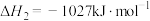
III :

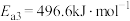
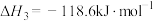
①反应过程的决速步骤是
②总反应的热化学方程式为
(4)
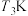 时,在刚性密闭容器中充入物质的量之比为
时,在刚性密闭容器中充入物质的量之比为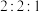 的
的 、
、 和
和 的混合气体,起始气体总压强为
的混合气体,起始气体总压强为 ,达到平衡时气体总压强为
,达到平衡时气体总压强为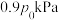 。实验测得:
。实验测得: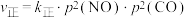 ,
,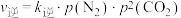 ,其中
,其中 、
、 分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=总压×物质的量分数)。
分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=总压×物质的量分数)。①平衡后升高温度,
 增大的倍数比
增大的倍数比 的
的②
 的平衡转化率为
的平衡转化率为③

 的代数式表示)。
的代数式表示)。(5)该反应的某种催化剂的催化效率与NO的消耗速率随温度的变化关系如图所示。300~350℃之间,NO的消耗速率加快的原因是

您最近一年使用:0次
名校
8 .  的资源化利用能有效减少碳排放充分利用碳资源。
的资源化利用能有效减少碳排放充分利用碳资源。 合成甲醇(
合成甲醇( )的反应包括下列两步:
)的反应包括下列两步:
反应Ⅰ:
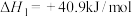
反应Ⅱ:
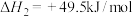
(1)由 与
与 合成
合成 的热化学方程式为
的热化学方程式为___________ 。
(2)在一定温度下,向体积为 的恒容密闭容器中充入
的恒容密闭容器中充入 和
和 ,控制条件仅发生反应Ⅱ,测得
,控制条件仅发生反应Ⅱ,测得 、
、 和
和 的物质的量(
的物质的量( )随时间的变化如图所示:
)随时间的变化如图所示:
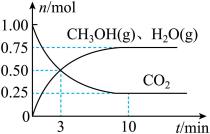
① 内,用
内,用 表示的化学反应速率
表示的化学反应速率
_______ 。
②该可逆反应的化学平衡常数
_______ 。
③下列有关该反应的说法正确的是_______ 。
A.升高温度逆反应速率加快,正反应速率减慢
B.反应体系中 浓度不再变化,说明反应达到平衡状态
浓度不再变化,说明反应达到平衡状态
C.恒温恒容下达到平衡后,再通入 ,平衡向正反应方向移动
,平衡向正反应方向移动
D.平衡时,若改变体积减小压强,则 、
、 均变小
均变小
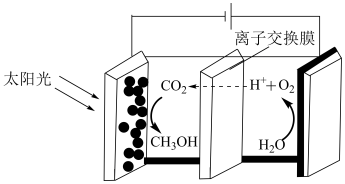
(3)在光电催化下 可以合成甲醇,原理如图所示。阴极的电极反应式为
可以合成甲醇,原理如图所示。阴极的电极反应式为_______ 。
 的资源化利用能有效减少碳排放充分利用碳资源。
的资源化利用能有效减少碳排放充分利用碳资源。 合成甲醇(
合成甲醇( )的反应包括下列两步:
)的反应包括下列两步:反应Ⅰ:

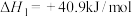
反应Ⅱ:

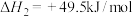
(1)由
 与
与 合成
合成 的热化学方程式为
的热化学方程式为(2)在一定温度下,向体积为
 的恒容密闭容器中充入
的恒容密闭容器中充入 和
和 ,控制条件仅发生反应Ⅱ,测得
,控制条件仅发生反应Ⅱ,测得 、
、 和
和 的物质的量(
的物质的量( )随时间的变化如图所示:
)随时间的变化如图所示:
①
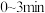 内,用
内,用 表示的化学反应速率
表示的化学反应速率
②该可逆反应的化学平衡常数

③下列有关该反应的说法正确的是
A.升高温度逆反应速率加快,正反应速率减慢
B.反应体系中
 浓度不再变化,说明反应达到平衡状态
浓度不再变化,说明反应达到平衡状态C.恒温恒容下达到平衡后,再通入
 ,平衡向正反应方向移动
,平衡向正反应方向移动D.平衡时,若改变体积减小压强,则
 、
、 均变小
均变小(3)在光电催化下
 可以合成甲醇,原理如图所示。阴极的电极反应式为
可以合成甲醇,原理如图所示。阴极的电极反应式为
您最近一年使用:0次
2023-07-13更新
|
79次组卷
|
2卷引用:福建省福州铜盘中学2022-2023学年高二下学期期末考试化学试题
9 . 丙烯是重要的有机原料,由丙烷制备丙烯是近年来研究的热点,主要涉及如下反应。
反应ⅰ:

反应ⅱ: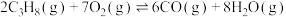
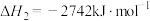
回答下列问题:
(1)反应:

___________
(2)在刚性绝热容器中通入 和
和 ,若只发生反应ⅰ,下列能说明已达到平衡状态的有___________(填标号)。
,若只发生反应ⅰ,下列能说明已达到平衡状态的有___________(填标号)。
(3)在压强恒定为100kPa条件下,按起始投料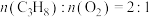 ,匀速通入装有催化剂的反应器中发生反应ⅰ和反应ⅱ,其中相同时间内不同温度下丙烷和氧气的转化率如图。
,匀速通入装有催化剂的反应器中发生反应ⅰ和反应ⅱ,其中相同时间内不同温度下丙烷和氧气的转化率如图。
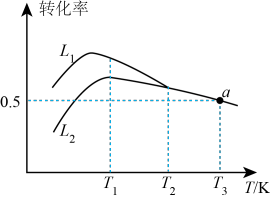
①线___________ (填“ ”或“
”或“ ”)表示丙烷的转化率。
”)表示丙烷的转化率。
②温度高于 后曲线
后曲线 随温度升高而降低的原因为
随温度升高而降低的原因为___________ 。
(3)当温度高于___________ (填“ ”或“
”或“ ”)时,可判断反应ⅱ不再发生的依据是
”)时,可判断反应ⅱ不再发生的依据是___________ ,a点对应的温度下,丙烯的分压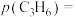
___________  (保留3位有效数字,下同),反应ⅰ的平衡常数
(保留3位有效数字,下同),反应ⅰ的平衡常数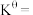
___________ 。(已知:分压 =总压×该组分物质的量分数,对于反应
=总压×该组分物质的量分数,对于反应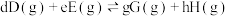 ,
,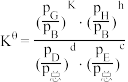 ,其中
,其中 、
、 、
、 、
、 为反应平衡时各组分的分压)
为反应平衡时各组分的分压)
反应ⅰ:


反应ⅱ:
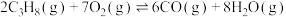
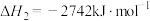
回答下列问题:
(1)反应:


(2)在刚性绝热容器中通入
 和
和 ,若只发生反应ⅰ,下列能说明已达到平衡状态的有___________(填标号)。
,若只发生反应ⅰ,下列能说明已达到平衡状态的有___________(填标号)。A.每断裂 键,同时生成 键,同时生成 键 键 |
| B.容器内温度不再变化 |
| C.混合气体的密度不再变化 |
D.容器内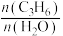 保持不变 保持不变 |
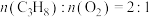 ,匀速通入装有催化剂的反应器中发生反应ⅰ和反应ⅱ,其中相同时间内不同温度下丙烷和氧气的转化率如图。
,匀速通入装有催化剂的反应器中发生反应ⅰ和反应ⅱ,其中相同时间内不同温度下丙烷和氧气的转化率如图。
①线
 ”或“
”或“ ”)表示丙烷的转化率。
”)表示丙烷的转化率。②温度高于
 后曲线
后曲线 随温度升高而降低的原因为
随温度升高而降低的原因为(3)当温度高于
 ”或“
”或“ ”)时,可判断反应ⅱ不再发生的依据是
”)时,可判断反应ⅱ不再发生的依据是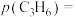
 (保留3位有效数字,下同),反应ⅰ的平衡常数
(保留3位有效数字,下同),反应ⅰ的平衡常数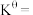
 =总压×该组分物质的量分数,对于反应
=总压×该组分物质的量分数,对于反应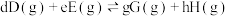 ,
,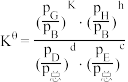 ,其中
,其中 、
、 、
、 、
、 为反应平衡时各组分的分压)
为反应平衡时各组分的分压)
您最近一年使用:0次
名校
解题方法
10 . 三氧化钼(MoO3)是石油工业中常用的催化剂,也是瓷轴药的颜料,该物质常使用辉钼矿(主要成分为MoS2)通过一定条件来制备。 回答下列相关问题:
(1)已知:①MoS2(s) Mo(s)+S2(g) △H1
Mo(s)+S2(g) △H1
②S2(g)+2O2(g)=2SO2(g) △H2
③2Mo(s)+3O2(g)=2MoO3(s) △H3
则2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g)的△H=________ (用含△H1、△H2、△H3的代数式表示)。
(2)若在恒温恒容条件下,仅发生反应MoS2(s) Mo(s)+S2(g)
Mo(s)+S2(g)
①下列说法不正确的是_________ (填字母)。
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加MoS2的质量,平衡向正反应方向移动
②达到平衡时S2(g)的浓度为1.4 mol/L,充入一定量的S2(g),反应再次达到平衡,S2(g)浓度______ 1.4 mol/L(填“>”"<“或""=”)。
(3)在2 L恒容密闭容器中充入1.0 mol S2(g)和1.5 mol O2(g),若仅发生反应S2+2O2 2SO2,5 min后反应达到平衡,此时容器压强为起始时的80%,则0~ 5 min内,O2的反应速率为
2SO2,5 min后反应达到平衡,此时容器压强为起始时的80%,则0~ 5 min内,O2的反应速率为____________ mol/(L·min),S2的平衡转化率为_______________ 。
(4)在密闭容器中,加入足量的MoS2和O2,仅发生反应:2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) △H。测得氧气的平衡转化率与压强、温度的关系如图所示。
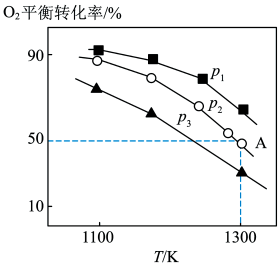
①△H______ 0(填“>”、“<"或“=");比较p1、p2、p3的大小:_______________ 。
②若初始时通入7.0 molO2,p2为7.0 kPa,则A点平衡常数Kp=_________ (用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数)。
(1)已知:①MoS2(s)
 Mo(s)+S2(g) △H1
Mo(s)+S2(g) △H1②S2(g)+2O2(g)=2SO2(g) △H2
③2Mo(s)+3O2(g)=2MoO3(s) △H3
则2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g)的△H=
(2)若在恒温恒容条件下,仅发生反应MoS2(s)
 Mo(s)+S2(g)
Mo(s)+S2(g)①下列说法不正确的是
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加MoS2的质量,平衡向正反应方向移动
②达到平衡时S2(g)的浓度为1.4 mol/L,充入一定量的S2(g),反应再次达到平衡,S2(g)浓度
(3)在2 L恒容密闭容器中充入1.0 mol S2(g)和1.5 mol O2(g),若仅发生反应S2+2O2
 2SO2,5 min后反应达到平衡,此时容器压强为起始时的80%,则0~ 5 min内,O2的反应速率为
2SO2,5 min后反应达到平衡,此时容器压强为起始时的80%,则0~ 5 min内,O2的反应速率为(4)在密闭容器中,加入足量的MoS2和O2,仅发生反应:2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) △H。测得氧气的平衡转化率与压强、温度的关系如图所示。

①△H
②若初始时通入7.0 molO2,p2为7.0 kPa,则A点平衡常数Kp=
您最近一年使用:0次
2023-07-07更新
|
158次组卷
|
2卷引用:福建省福州市八县(市)协作校2022-2023学年高二下学期期末联考化学试题