名校
解题方法
1 . 甲醇制烯烃(MTO)是煤制烯烃工艺路线的核心技术。煤制烯烃主要包括煤的气化、液化、烯烃化三个阶段。
(1)煤的液化发生的主要反应之一为
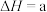 kJ⋅mol
kJ⋅mol ,在不同温度下,K(500°C)
,在不同温度下,K(500°C)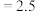 (mol⋅L
(mol⋅L ),K(700°C)
),K(700°C)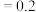 (mol⋅L
(mol⋅L )
)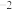 。
。
①
___________ 0(填“>”、“<”、“=”)。
②若反应在容积为2L的密闭容器中进行,500℃测得某一时刻体系内 、CO、
、CO、 物质的量分别为2 mol、1 mol、3 mol,则此时生成
物质的量分别为2 mol、1 mol、3 mol,则此时生成 的速率
的速率___________ 消耗 的速率(填“>”、“<”、“=”)。
的速率(填“>”、“<”、“=”)。
(2)通过研究外界条件对反应的影响,尽可能提高甲醇生成乙烯或丙烯的产率。
甲醇制烯烃的主要反应有:
Ⅰ.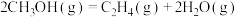
 kJ⋅mol
kJ⋅mol
Ⅱ.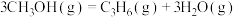
 kJ⋅mol
kJ⋅mol
Ⅲ.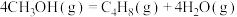
 kJ⋅mol
kJ⋅mol
① 转化为
转化为 的热化学方程式为Ⅳ:
的热化学方程式为Ⅳ: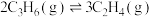
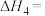
___________ 。
②加入 作为稀释剂,反应Ⅰ中
作为稀释剂,反应Ⅰ中 的产率将
的产率将___________ (填“增大”、“减小”或“不变”)。
(3)为研究不同条件对反应的影响,测得不同温度下平衡时 、
、 和
和 的物质的量分数变化,如图所示:
的物质的量分数变化,如图所示:
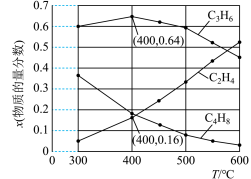
①随着温度的升高, 的物质的量分数呈现先增大后减小的趋势。温度高于400℃时,原因是
的物质的量分数呈现先增大后减小的趋势。温度高于400℃时,原因是___________ 。
②体系总压为0.1 MPa,400℃时反应Ⅳ的平衡常数
___________ 。
(1)煤的液化发生的主要反应之一为

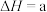 kJ⋅mol
kJ⋅mol ,在不同温度下,K(500°C)
,在不同温度下,K(500°C)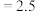 (mol⋅L
(mol⋅L ),K(700°C)
),K(700°C)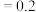 (mol⋅L
(mol⋅L )
)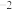 。
。①

②若反应在容积为2L的密闭容器中进行,500℃测得某一时刻体系内
 、CO、
、CO、 物质的量分别为2 mol、1 mol、3 mol,则此时生成
物质的量分别为2 mol、1 mol、3 mol,则此时生成 的速率
的速率 的速率(填“>”、“<”、“=”)。
的速率(填“>”、“<”、“=”)。(2)通过研究外界条件对反应的影响,尽可能提高甲醇生成乙烯或丙烯的产率。
甲醇制烯烃的主要反应有:
Ⅰ.
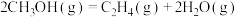
 kJ⋅mol
kJ⋅mol
Ⅱ.
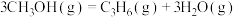
 kJ⋅mol
kJ⋅mol
Ⅲ.
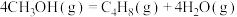
 kJ⋅mol
kJ⋅mol
①
 转化为
转化为 的热化学方程式为Ⅳ:
的热化学方程式为Ⅳ: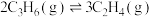
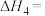
②加入
 作为稀释剂,反应Ⅰ中
作为稀释剂,反应Ⅰ中 的产率将
的产率将(3)为研究不同条件对反应的影响,测得不同温度下平衡时
 、
、 和
和 的物质的量分数变化,如图所示:
的物质的量分数变化,如图所示:
①随着温度的升高,
 的物质的量分数呈现先增大后减小的趋势。温度高于400℃时,原因是
的物质的量分数呈现先增大后减小的趋势。温度高于400℃时,原因是②体系总压为0.1 MPa,400℃时反应Ⅳ的平衡常数

您最近一年使用:0次
名校
解题方法
2 . 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
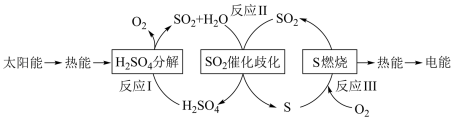
(1)反应I: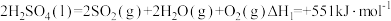
反应Ⅲ: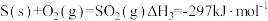
①反应I在_______ (填“高温”“低温”“任何温度”)条件下易自发进行。
②反应Ⅱ的热化学方程式:_______ 。
(2) 可以作为水溶液中
可以作为水溶液中 歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。
歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。
i.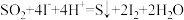
ⅱ.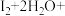
_______ 
_______ +_______ 
(3)探究(2)中i、ii反应速率与 歧化反应速率的关系,实验如下:分别将
歧化反应速率的关系,实验如下:分别将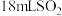 饱和溶液加入到
饱和溶液加入到 下列试剂中,密闭放置观察现象。(已知:
下列试剂中,密闭放置观察现象。(已知: 易溶解在
易溶解在 溶液中)
溶液中)
①B是A的对比实验,则
_______ 。
②比较A、B、C,可得出的结论是_______ 。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因_______ 。

(1)反应I:
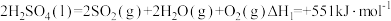
反应Ⅲ:
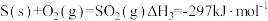
①反应I在
②反应Ⅱ的热化学方程式:
(2)
 可以作为水溶液中
可以作为水溶液中 歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。
歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。i.
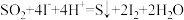
ⅱ.
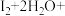


(3)探究(2)中i、ii反应速率与
 歧化反应速率的关系,实验如下:分别将
歧化反应速率的关系,实验如下:分别将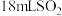 饱和溶液加入到
饱和溶液加入到 下列试剂中,密闭放置观察现象。(已知:
下列试剂中,密闭放置观察现象。(已知: 易溶解在
易溶解在 溶液中)
溶液中)| A | B | C | D | |
| 试剂组成 | 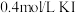 | 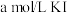 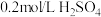 | 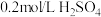 | 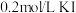 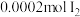 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色变成黄色,出现浑浊较A快 |

②比较A、B、C,可得出的结论是
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因
您最近一年使用:0次
名校
解题方法
3 . 下列叙述不正确的是
| A.物质发生化学变化一定会伴有能量的变化 |
| B.可逆反应的ΔH表示完全反应时的热量变化,与反应是否可逆无关 |
| C.水蒸气变为液态水时放出的能量就是该变化的反应热 |
| D.同温同压下,反应H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的ΔH相同 |
您最近一年使用:0次
名校
4 . 如图是煤的综合利用过程中化工产业链的一部分。
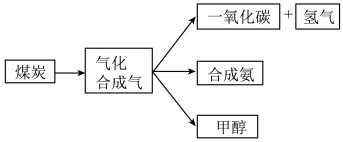
依题意回答下列问题:
(1)煤的气化发生的主要反应是:C(s)+H2O(g)=CO(g)+H2(g)
①已知:C(s)+O2(g)=CO2(g) ΔH= ̶393.0kJ·mol-1
H2(g)+ O2(g)=H2O(g) ΔH= ̶242.0kJ·mol-1
O2(g)=H2O(g) ΔH= ̶242.0kJ·mol-1
CO(g)+ O2(g)=CO2(g) ΔH= ̶283.0kJ·mol-1
O2(g)=CO2(g) ΔH= ̶283.0kJ·mol-1
煤气化时发生主要反应的热化学方程式是:C(s)+H2O(g)=CO(g)+H2(g) ∆H=_______ kJ·mol-1
②298K时,0.5mol液态CH3OH完全燃烧生成二氧化碳和液态水,放出362.8kJ的热量。写出表示CH3OH摩尔燃烧焓的热化学方程式:_______ 。
(2)在一密闭容器中发生反应:N2(g)+3H2(g)⇌2NH3(g) ΔH= ̶92.4kJ·mol-1达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。
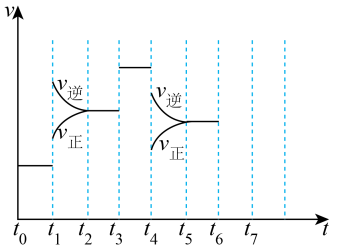
①判断t1、t4时刻分别改变的一个条件。
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加催化剂 F.充入氮气
t1时刻_______ ; t4时刻_______ 。
②依据①中的结论,下列时间段中,氨的百分含量最高的是_______ 。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(3)某温度时合成甲醇的反应:CO(g)+2H2(g)⇌CH3OH(g) ΔH= ̶ 90.8 kJ·mol-1,在容积固定的密闭容器中,各物质的浓度如下表所示:
①前2min的反应速率υ(H2) = _______ 。
②该温度下的平衡常数为_______ (可用分数表示)。

依题意回答下列问题:
(1)煤的气化发生的主要反应是:C(s)+H2O(g)=CO(g)+H2(g)
①已知:C(s)+O2(g)=CO2(g) ΔH= ̶393.0kJ·mol-1
H2(g)+
 O2(g)=H2O(g) ΔH= ̶242.0kJ·mol-1
O2(g)=H2O(g) ΔH= ̶242.0kJ·mol-1CO(g)+
 O2(g)=CO2(g) ΔH= ̶283.0kJ·mol-1
O2(g)=CO2(g) ΔH= ̶283.0kJ·mol-1煤气化时发生主要反应的热化学方程式是:C(s)+H2O(g)=CO(g)+H2(g) ∆H=
②298K时,0.5mol液态CH3OH完全燃烧生成二氧化碳和液态水,放出362.8kJ的热量。写出表示CH3OH摩尔燃烧焓的热化学方程式:
(2)在一密闭容器中发生反应:N2(g)+3H2(g)⇌2NH3(g) ΔH= ̶92.4kJ·mol-1达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。

①判断t1、t4时刻分别改变的一个条件。
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加催化剂 F.充入氮气
t1时刻
②依据①中的结论,下列时间段中,氨的百分含量最高的是
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(3)某温度时合成甲醇的反应:CO(g)+2H2(g)⇌CH3OH(g) ΔH= ̶ 90.8 kJ·mol-1,在容积固定的密闭容器中,各物质的浓度如下表所示:
浓度 时间 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | c(CH3OH)/mol•L-1 |
| 0 | 1.0 | 1.8 | 0 |
| 2min | 0.5 | c | 0.5 |
| 4min | 0.4 | 0.6 | 0.6 |
| 6min | 0.4 | 0.6 | 0.6 |
②该温度下的平衡常数为
您最近一年使用:0次
名校
解题方法
5 . 下列有关能量的判断和表示方法正确的是
| A.由C(s,石墨)=C(s,金刚石) ΔH=+1.9kJ·mol-1,可知:石墨比金刚石更稳定 |
| B.等质量的C2H5OH(g)和C2H5OH(l)分别完全燃烧,后者放出的热量更多 |
| C.由H+(aq)+OH-(aq)=H2O(l) ΔH= -57.3kJ·mol-1,可知:含1mol HCl的溶液与含1mol NH3•H2O的溶液混合,放出热量等于57.3kJ |
| D.已知2C(s)+2O2(g)=2CO2(g) ΔH1; 2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2 |
您最近一年使用:0次
名校
6 . 下列说法正确的是
A.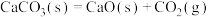 室温下不能自发进行,说明该反应的 室温下不能自发进行,说明该反应的 |
B.一定条件下  , ,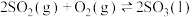  ,则 ,则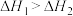 |
C.500℃、30MPa下,0.5mol (g)和1.5mol (g)和1.5mol (g)反应生成 (g)反应生成 (g)放热QkJ,其热化学方程式为 (g)放热QkJ,其热化学方程式为  |
D.已知两个平衡体系: 、 、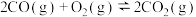 的平衡常数分别为 的平衡常数分别为 和 和 ,可推知平衡 ,可推知平衡 的平衡常数为 的平衡常数为 |
您最近一年使用:0次
名校
解题方法
7 . CO2减排能有效降低温室效应,同时CO2也是一种重要的资源,因此CO2捕集与转化技术研究备受关注。
I.CO2催化加氢制甲醇
(1)已知:①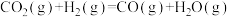
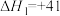 kJ·mol-1
kJ·mol-1
②
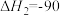 kJ·mol-1
kJ·mol-1
则CO2催化加氢制甲醇的热化学方程式为___________ 。
(2)部分物质的结构式:CO:C≡O,CO2:O=C=O,CH3OH: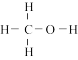 ;相关化学键的键能数据如下:
;相关化学键的键能数据如下:
则x=___________ ,主反应在___________ (填“高温”“低温”或“任意温度”)条件下能自发进行。
(3)研究CO、CO2与H2催化合成CH4对实现“碳中和”具有重要的意义。在一定条件下,CO(g)与H2(g)发生反应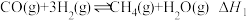 。
。
已知: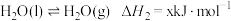 ;
;
CO(g)、H2(g)、CH4(g)的摩尔燃烧焓分别为a kJ·mol-1、b kJ·mol-1、c kJ·mol-1,
则
___________ kJ·mol-1。
Ⅱ.Me—CO2电池捕集CO2,下图是一种基于Na超离子导体固体电解质的钠-二氧化碳电池,该电池以饱和氯化钠溶液作为水系电解液,以氮掺杂单壁碳纳米角(N-SWCNH)为催化剂,其主要放电产物为NaHCO3(该体系下以“NaHCO3”形式存在)和C。

(4)B极的电极反应为___________ 。
I.CO2催化加氢制甲醇
(1)已知:①
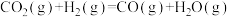
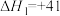 kJ·mol-1
kJ·mol-1②

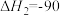 kJ·mol-1
kJ·mol-1则CO2催化加氢制甲醇的热化学方程式为
(2)部分物质的结构式:CO:C≡O,CO2:O=C=O,CH3OH:
 ;相关化学键的键能数据如下:
;相关化学键的键能数据如下:| 化学键 | C=O | H-H | C-H | C-O | O-H |
| 键能E/(kJ·mol-1) | 803 | 436 | 414 | X | 464 |
(3)研究CO、CO2与H2催化合成CH4对实现“碳中和”具有重要的意义。在一定条件下,CO(g)与H2(g)发生反应
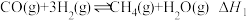 。
。已知:
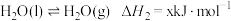 ;
;CO(g)、H2(g)、CH4(g)的摩尔燃烧焓分别为a kJ·mol-1、b kJ·mol-1、c kJ·mol-1,
则

Ⅱ.Me—CO2电池捕集CO2,下图是一种基于Na超离子导体固体电解质的钠-二氧化碳电池,该电池以饱和氯化钠溶液作为水系电解液,以氮掺杂单壁碳纳米角(N-SWCNH)为催化剂,其主要放电产物为NaHCO3(该体系下以“NaHCO3”形式存在)和C。

(4)B极的电极反应为
您最近一年使用:0次
名校
8 . 在一定的温度和压强下,将按一定比例混合的 和
和 通过装有催化剂的反应器可得到甲烷。
通过装有催化剂的反应器可得到甲烷。
已知: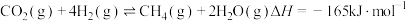

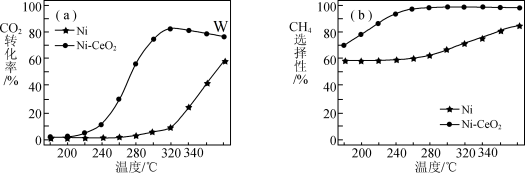
催化剂的选择是 甲烷化技术的核心。在两种不同催化剂作用下反应相同时间,测
甲烷化技术的核心。在两种不同催化剂作用下反应相同时间,测 转化率和生成
转化率和生成 选择性[
选择性[ 选择性
选择性 ]随温度变化的影响如图所示。下列有关说法正确的是
]随温度变化的影响如图所示。下列有关说法正确的是
 和
和 通过装有催化剂的反应器可得到甲烷。
通过装有催化剂的反应器可得到甲烷。已知:
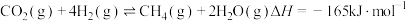

催化剂的选择是
 甲烷化技术的核心。在两种不同催化剂作用下反应相同时间,测
甲烷化技术的核心。在两种不同催化剂作用下反应相同时间,测 转化率和生成
转化率和生成 选择性[
选择性[ 选择性
选择性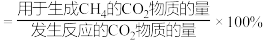 ]随温度变化的影响如图所示。下列有关说法正确的是
]随温度变化的影响如图所示。下列有关说法正确的是
A.在 间,以 间,以 为催化剂,升高温度 为催化剂,升高温度 的产率不变 的产率不变 |
B.延长 点的反应时间,一定能提高 点的反应时间,一定能提高 的转化率 的转化率 |
C.反应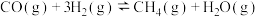 在任何温度下均不能自发进行 在任何温度下均不能自发进行 |
D.由图像分析,工业上应选择的催化剂是 ,合适温度为 ,合适温度为 |
您最近一年使用:0次
2023-09-25更新
|
98次组卷
|
2卷引用:福建省厦门市同安第一中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
9 . 二氧化碳催化加氢制甲醇,不仅有利于减少温室气体二氧化碳,而且还可以获得大量的重要有机化工原料甲醇。回答下列问题:
(1)二氧化碳加氢制甲醇的总反应可表示为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)平衡常数K,该反应一般认为通过如下步骤来实现:
CH3OH(g)+H2O(g)平衡常数K,该反应一般认为通过如下步骤来实现:
i.CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41kJ/mol 平衡常数K1
CO(g)+H2O(g) ΔH=+41kJ/mol 平衡常数K1
ii.CO(g)+2H2(g) CH3OH(g) ΔH=-90kJ/mol 平衡常数K2
CH3OH(g) ΔH=-90kJ/mol 平衡常数K2
则总反应的ΔH=___________ kJ/mol;平衡常数K=___________ (用K1、K2表示)。
(2)碳及其化合物间的转化广泛存在于自然界及人类的生产和生活中。
已知25℃,100kPa时:1mol葡萄糖[C6H12O6(s)]完全燃烧生成CO2(g)和H2O(l),放出2804kJ热量。
CO(g)+ O2(g)=CO2(g) ΔH=-283kJ·mol-1。
O2(g)=CO2(g) ΔH=-283kJ·mol-1。
回答问题:
①25℃时,CO2(g)与H2O(l)经光合作用生成葡萄糖[C6H12O6(s)]和O2(g)的热化学方程式为___________ 。
②25℃,100kPa时,气态分子断开1mol化学键的焓变称为键焓。已知O=O、C≡O键的键焓分别为495kJ·mol-1、799kJ·mol-1,CO2(g)分子中碳氧键的键焓为___________ kJ·mol-1。
(3)若T1时时将6mo1CO2和8mo1H2充入容积为2L的密闭容器中发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),H2的物质的量变化如下表所示。
CH3OH(g)+H2O(g),H2的物质的量变化如下表所示。
①在T1℃条件下0-5min内,以CO2表示的该反应速率v(CO2)=___________ ,该条件下的平衡常数K=___________ 。
②若15min时,保持T1不变,向该容器中再加入该四种反应混合物各1mol,则此时反应___________ 移动(填“正向”、“逆向”或“不”),反应速率v(CO2、正)___________ 反应速率v(CO2、逆)(填“>”、“<”、“=”)。
(1)二氧化碳加氢制甲醇的总反应可表示为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)平衡常数K,该反应一般认为通过如下步骤来实现:
CH3OH(g)+H2O(g)平衡常数K,该反应一般认为通过如下步骤来实现:i.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=+41kJ/mol 平衡常数K1
CO(g)+H2O(g) ΔH=+41kJ/mol 平衡常数K1ii.CO(g)+2H2(g)
 CH3OH(g) ΔH=-90kJ/mol 平衡常数K2
CH3OH(g) ΔH=-90kJ/mol 平衡常数K2则总反应的ΔH=
(2)碳及其化合物间的转化广泛存在于自然界及人类的生产和生活中。
已知25℃,100kPa时:1mol葡萄糖[C6H12O6(s)]完全燃烧生成CO2(g)和H2O(l),放出2804kJ热量。
CO(g)+
 O2(g)=CO2(g) ΔH=-283kJ·mol-1。
O2(g)=CO2(g) ΔH=-283kJ·mol-1。回答问题:
①25℃时,CO2(g)与H2O(l)经光合作用生成葡萄糖[C6H12O6(s)]和O2(g)的热化学方程式为
②25℃,100kPa时,气态分子断开1mol化学键的焓变称为键焓。已知O=O、C≡O键的键焓分别为495kJ·mol-1、799kJ·mol-1,CO2(g)分子中碳氧键的键焓为
(3)若T1时时将6mo1CO2和8mo1H2充入容积为2L的密闭容器中发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),H2的物质的量变化如下表所示。
CH3OH(g)+H2O(g),H2的物质的量变化如下表所示。| 物质的量/mol | T1/℃ | T2/℃ | |||||
| 0 | 5min | 10min | 15min | 20min | 25min | 30min | |
| H2 | 8.0 | 3.5 | 2.0 | 2.0 | 15 | 1.0 | 1.0 |
②若15min时,保持T1不变,向该容器中再加入该四种反应混合物各1mol,则此时反应
您最近一年使用:0次
名校
解题方法
10 . 依题意回答下列问题。
(1)标准状况下,0.3mol C2H2(g)在O2(g)中完全燃烧生成CO2(g)和H2O(l),放出389.7 kJ热量,请写出表示C2H2摩尔燃烧焓的热化学方程式:_______ 。
(2)用肼(N2H4)作燃料,四氧化二氮作氧化剂,二者反应生成氮气和气态水。已知:
①N2(g)+2O2(g)=N2O4(g) ΔH=+10.7 kJ·mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
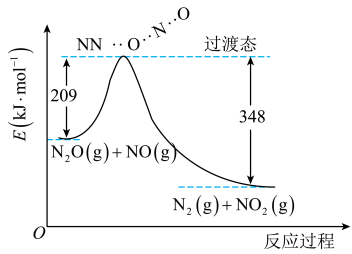
写出气态肼和N2O4反应的热化学方程式:_______ 。
(1)标准状况下,0.3mol C2H2(g)在O2(g)中完全燃烧生成CO2(g)和H2O(l),放出389.7 kJ热量,请写出表示C2H2摩尔燃烧焓的热化学方程式:
(2)用肼(N2H4)作燃料,四氧化二氮作氧化剂,二者反应生成氮气和气态水。已知:
①N2(g)+2O2(g)=N2O4(g) ΔH=+10.7 kJ·mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543 kJ·mol-1

写出气态肼和N2O4反应的热化学方程式:
您最近一年使用:0次



