名校
1 . 利用下列实验装置无法实现实验目的的是
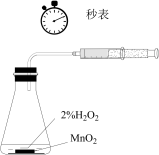 | 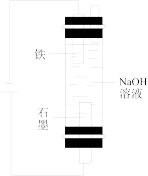 | 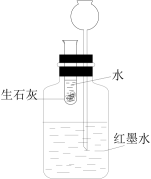 | 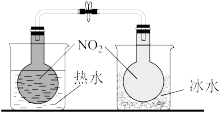 |
| ① | ② | ③ | ④ |
| A.用装置①测量2%双氧水分解生成O2的化学反应速率 |
B.用装置②制备 并能较长时间观察其颜色 并能较长时间观察其颜色 |
| C.用装置③证明生石灰与水反应是放热反应 |
| D.用装置④探究温度对化学平衡的影响 |
您最近一年使用:0次
2021-11-18更新
|
226次组卷
|
3卷引用:山东省青岛市4区市2021-2022学年高二上学期期中考试化学试题
2 . 下列实验操作不能达到实验目的的是
| 选项 | 实验操作 | 实验目的 |
| A | 向1mL2mol·L-1FeCl3溶液中加入1mL1mol·L-1KI溶液,萃取分液后向水层滴入KSCN溶液,观察溶液颜色变化 | 探究Fe3+与I-的反应是否可逆 |
| B | 向烧杯中加入70g研细的Ca(OH)2晶体和50gNH4Cl晶体,并将烧杯放在滴有水的玻璃片上,用玻璃棒迅速搅拌,观察实验现象 | 证明吸热反应不一定需要加热才能进行 |
| C | 向某溶液中滴加K3[Fe(CN)6]溶液,观察是否产生蓝色沉淀 | 证明某溶液中有Fe2+,无Fe3+ |
| D | 相同条件下,用20mL1.0mol·L-1醋酸溶液和50mL1.0mol·L-1盐酸分别做导电性实验,观察对应灯泡明暗程度 | 证明醋酸是弱电解质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 用图示实验装置进行相应实验,能达到实验目的的是
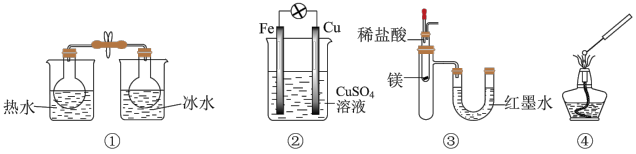

A.用图①装置探究温度对平衡 的影响 的影响 |
| B.用图②装置验证化学能与热能的转化 |
| C.用图③装置验证镁和盐酸反应是放热反应 |
| D.用图④装置验证原溶液无钾离子,用洁净铂丝蘸取待测液,在酒精灯火焰上灼烧,观察到火焰呈黄色 |
您最近一年使用:0次
4 . 在人类生产、生活对能量的需求日益增长的今天,研究化学反应及其能量变化和反应速率,合理利用常规能源和开发新能源具有十分重要的意义。能源是人类赖以生存和发展不可缺少的因素。请回答下列问题:
(1)分析如图的能量变化,则 为
为___________ (填“吸热”或“放热”)反应。下列化学反应的能量变化与 的能量变化相同的是
的能量变化相同的是___________ (填标号)。
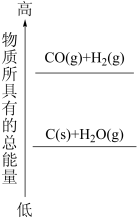
A.稀硫酸与 溶液的反应 B.点燃的镁条在氮气中继续燃烧
溶液的反应 B.点燃的镁条在氮气中继续燃烧
C.灼热的炭与二氧化碳的反应 D. 与
与 的反应
的反应
(2)断裂 键、
键、 键、
键、 键分别需要的能量是
键分别需要的能量是 、
、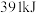 、
、 ,则生成
,则生成 放出的热量为
放出的热量为___________  。
。
(3)如如图是某同学设计的一个简易原电池装置。请回答下列问题。
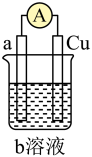
①若a电极材料为碳、b溶液为 溶液,则正极的电极反应式为
溶液,则正极的电极反应式为___________ ,当有1.6g负极材料溶解时,转移的电子个数为___________ 。
②若a电极材料为铁,b溶液为浓硝酸,电流表的指针也会偏转,则电子的流向为___________ →___________ (填电极材料,下同),溶液中的 向
向___________ 极移动。
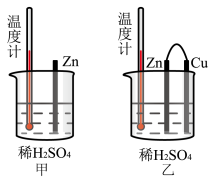
(4)为了探究化学反应中的能量变化,某同学设计了如下两个实验(如图)。有关实验现象,下列说法正确的是___________(填字母)。
(5)向某体积固定的密闭容器中加入 、
、 和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
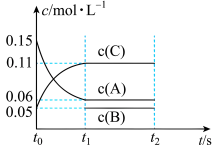
①若 ,则
,则 内反应速率
内反应速率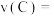
___________ ;
②写出反应的化学方程式:___________ 。
(1)分析如图的能量变化,则
 为
为 的能量变化相同的是
的能量变化相同的是
A.稀硫酸与
 溶液的反应 B.点燃的镁条在氮气中继续燃烧
溶液的反应 B.点燃的镁条在氮气中继续燃烧C.灼热的炭与二氧化碳的反应 D.
 与
与 的反应
的反应(2)断裂
 键、
键、 键、
键、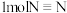 键分别需要的能量是
键分别需要的能量是 、
、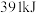 、
、 ,则生成
,则生成 放出的热量为
放出的热量为 。
。(3)如如图是某同学设计的一个简易原电池装置。请回答下列问题。

①若a电极材料为碳、b溶液为
 溶液,则正极的电极反应式为
溶液,则正极的电极反应式为②若a电极材料为铁,b溶液为浓硝酸,电流表的指针也会偏转,则电子的流向为
 向
向(4)为了探究化学反应中的能量变化,某同学设计了如下两个实验(如图)。有关实验现象,下列说法正确的是___________(填字母)。

| A.图甲和图乙的气泡均产生于锌棒表面 | B.图乙中产生气体的速率比图甲快 |
| C.图甲中温度计的示数高于图乙的示数 | D.图甲和图乙中温度计的示数相等,且均高于室温 |
 、
、 和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
①若
 ,则
,则 内反应速率
内反应速率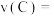
②写出反应的化学方程式:
您最近一年使用:0次
名校
5 . 化学反应过程既是物质的转化过程,也是化学能与热能,电能等其他形式能量的转化过程。请根据要求回答下列与能量转化有关的问题:
I.利用如图所示装置测定中和热,取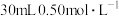 稀硫酸与
稀硫酸与 溶液进行实验,实验数据如表。
溶液进行实验,实验数据如表。
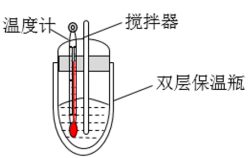
回答下列问题:
(1)若近似认为 稀硫酸与
稀硫酸与 溶液的密度均为
溶液的密度均为 (忽略溶液混合后体积变化),反应所得溶液的比热容
(忽略溶液混合后体积变化),反应所得溶液的比热容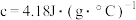 ,则实验测定中和热的数值为
,则实验测定中和热的数值为_______  (保留1位小数)。
(保留1位小数)。
(2)上述实验结果与中和热的标准数值 有偏差,产生偏差的原因不可能是因为_____。
有偏差,产生偏差的原因不可能是因为_____。
(3)如图三个装置中,不能证明“铁与稀硫酸反应是吸热反应还是放热反应”的是_______ 。
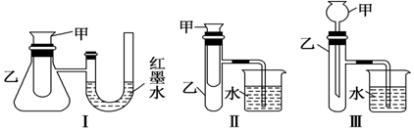
II.
(4)请用下图所示仪器装置设计一个包括:电解饱和食盐水并测定电解时产生的氢气的体积和检验氯气的氧化性的实验装置。
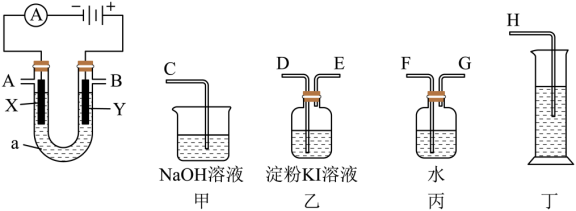
①所选仪器连接时,各接口的顺序是___________ (填各接口的字母代号):
A接______、_____接_____;B接_____、______接______;
②体现氯气的氧化性的实验现象为:_______ ,电解一段时间后,用丁测得气体体积为280mL(标准状况下);需加入_______ g(结果保留一位小数)的_______ 可使溶液复原。
| 温度 实验次数 | 起始温度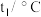 | 终止温度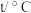 | ||
 |  | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 30.2 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 |
| 4 | 26.4 | 26.2 | 26.3 | 30.3 |
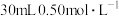 稀硫酸与
稀硫酸与 溶液进行实验,实验数据如表。
溶液进行实验,实验数据如表。
回答下列问题:
(1)若近似认为
 稀硫酸与
稀硫酸与 溶液的密度均为
溶液的密度均为 (忽略溶液混合后体积变化),反应所得溶液的比热容
(忽略溶液混合后体积变化),反应所得溶液的比热容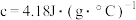 ,则实验测定中和热的数值为
,则实验测定中和热的数值为 (保留1位小数)。
(保留1位小数)。(2)上述实验结果与中和热的标准数值
 有偏差,产生偏差的原因不可能是因为_____。
有偏差,产生偏差的原因不可能是因为_____。| A.实验装置保温、隔热效果差 |
| B.用量筒量取NaOH溶液的体积时仰视读数 |
| C.分多次把NaOH溶液倒入内筒中 |
| D.测过稀硫酸的温度计未洗净直接用于测定NaOH溶液的温度 |

II.
(4)请用下图所示仪器装置设计一个包括:电解饱和食盐水并测定电解时产生的氢气的体积和检验氯气的氧化性的实验装置。

①所选仪器连接时,各接口的顺序是
A接______、_____接_____;B接_____、______接______;
②体现氯气的氧化性的实验现象为:
您最近一年使用:0次
6 . 化学电源广泛地应用于现代社会的生产和生活。请回答下列问题:
(1)原电池是一种化学能转变为电能的装置,所以原电池的设计原理与某类化学反应有关。你认为下列化学反应,可以设计成原电池的是___________(填字母)。
(2)化学反应均涉及相应的能量变化,为探究这些能量变化,某同学设计了如图两个实验,已知两个实验除了是否有导线连接两个金属棒外,其余均相同。

①该同学设计这两个实验的目的是___________ 。
②有关反应一段时间后的实验现象,下列说法正确的是___________ ( 填字母)。
A.图1中温度计的示数高于图2的示数
B.图1和图2中温度计的示数相等,且均高于室温。
C.图1和图2的气泡均产生于锌棒表面
D.图2中产生气体的速率比1慢
(3)若将用导线相连在一起,总质量为80.00 g的锌片和银片同时浸入稀硫酸中,工作一段时间后,取出金属片,进行洗涤、干燥、称量,得金属片的总质量为63.75 g,则装置工作时锌片上的电极反应式为___________ ,工作时间内装置所产生氢气的体积为 ___________ L(标准状况)。
(1)原电池是一种化学能转变为电能的装置,所以原电池的设计原理与某类化学反应有关。你认为下列化学反应,可以设计成原电池的是___________(填字母)。
| A.CaO+H2O=Ca(OH)2 |
B.C+CO2 2CO 2CO |
| C.NaOH+HCl=NaCl+H2O |
| D.2FeCl3+Cu=2FeCl2+CuCl2 |

①该同学设计这两个实验的目的是
②有关反应一段时间后的实验现象,下列说法正确的是
A.图1中温度计的示数高于图2的示数
B.图1和图2中温度计的示数相等,且均高于室温。
C.图1和图2的气泡均产生于锌棒表面
D.图2中产生气体的速率比1慢
(3)若将用导线相连在一起,总质量为80.00 g的锌片和银片同时浸入稀硫酸中,工作一段时间后,取出金属片,进行洗涤、干燥、称量,得金属片的总质量为63.75 g,则装置工作时锌片上的电极反应式为
您最近一年使用:0次
2022-05-28更新
|
991次组卷
|
5卷引用:山东省济宁市曲阜孔子高级中学2022-2023学年高一下学期4月月考化学试题
山东省济宁市曲阜孔子高级中学2022-2023学年高一下学期4月月考化学试题山西省运城市2021-2022学年高一下学期5月联考化学试题(已下线)化学(人教版2019B卷)-学易金卷:2022-2023学年高一下学期期中考前必刷卷第六章 化学反应与能量(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)(已下线)第六章 化学反应与能量【单元测试B卷】
7 . 下列实验操作、现象及解释或结论都正确的是
| 实验操作 | 实验现象 | 解释或结论 | |
| A | 工业上用SiO2与焦炭在高温条件制备 粗硅 | 生成气体CO,得到黑色固体粗硅 | 非金属性:C>Si |
| B | 某溶液中加入盐酸,并将产生的气体通入澄清石灰水 | 澄清石灰水变浑浊 | 溶液中一定含有 |
| C | 向两支试管中分别加入2mL5%的H2O2溶液和10%的H2O2溶液,再分别滴入2滴1mol·L−1FeCl3溶液 | 盛有10%的H2O2溶液的试管中产生气泡的速率快 | 其他条件相同时,浓度越大化学反应速率越快 |
| D | 往烧杯中加入约20g研细的Ba(OH)2·8H2O晶体和10gNH4Cl晶体,并将烧杯放在滴有水的玻璃片上,用玻璃棒迅速搅拌 | 有刺激性气味气体生成,烧杯底部结冰,与玻璃片粘在一起 | 吸热反应不一定要加热才能进行 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
8 . 为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:
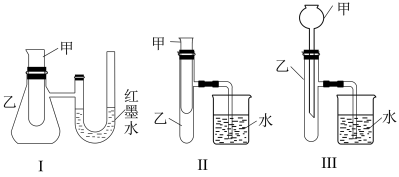
(1)某同学选用装置I进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,根据所学知识推测该反应属于_______ (填“吸热”或“放热”)反应,预测U形管中可观察到的现象是_______ 。
(2)选择装置II进行探究固体M在甲中溶于水的热效应。
①若M为 ,则实验过程中烧杯中可观察到的现象是
,则实验过程中烧杯中可观察到的现象是_______ 。
②若M为NaOH,则实验过程中烧杯中可观察到的现象为_______ 。
(3)上述3个装置中,不能用来证明“锌和稀硫酸反应是吸热反应还是放热反应”的是_______ (填序号)。理由是_______ 。
(4)至少有两种实验方法能证明过氧化钠与水的反应(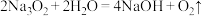 )是放热反应。
)是放热反应。
方法①:选择上述装置_______ (填“I”、“II”或“III”)进行实验。
方法②:取适量过氧化钠粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到_______ ,则说明该反应是放热反应。

(1)某同学选用装置I进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,根据所学知识推测该反应属于
(2)选择装置II进行探究固体M在甲中溶于水的热效应。
①若M为
 ,则实验过程中烧杯中可观察到的现象是
,则实验过程中烧杯中可观察到的现象是②若M为NaOH,则实验过程中烧杯中可观察到的现象为
(3)上述3个装置中,不能用来证明“锌和稀硫酸反应是吸热反应还是放热反应”的是
(4)至少有两种实验方法能证明过氧化钠与水的反应(
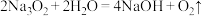 )是放热反应。
)是放热反应。方法①:选择上述装置
方法②:取适量过氧化钠粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到
您最近一年使用:0次
2022-11-21更新
|
280次组卷
|
2卷引用:山东省滨州市沾化区、阳信县2022-2023学年高一下学期期中联考化学(B)试题
9 . 将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。下列说法正确的是
| A.该反应中,热能转化为生成物的内部能量 |
| B.反应物的总能量高于生成物的总能量 |
C.由实验现象可知反应: 一定为吸热反应 一定为吸热反应 |
| D.该反应可以设计成原电池装置 |
您最近一年使用:0次
解题方法
10 . Ⅰ.(1)从能量的变化和反应的快慢等角度研究反应:2H2(g)+O2(g)=2H2O(g)。已知该反应为放热反应,下图能正确表示该反应中能量变化的是___________ 。
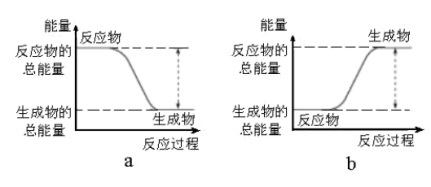
从断键和成键的角度分析上述反应中能量的变化,化学键的键能如下表所示:
则生成1molH2O(g)可以放出热量___________ kJ。
(2)下列反应中,既属于氧化还原反应,又属于放热反应的是___________
a.盐酸与烧碱溶液反应 b.柠檬酸和碳酸氢钠反应
c.氢气在氧气中燃烧生成水 d.高温煅烧石灰石使其分解
e.铝和盐酸反应 f.浓硫酸溶于水
Ⅱ.A、B、C、D 四种金属按下表中装置进行实验。
根据实验现象回答下列问题:
①装置甲中溶液中的阴离子移向___________ 极(填“A”或“B”)。
②装置乙中正极的电极反应式为___________ 。
③装置丙中溶液的pH___________ (填“变大”“变小”或“不变”)。
④四种金属活动性由强到弱的顺序是___________ 。

从断键和成键的角度分析上述反应中能量的变化,化学键的键能如下表所示:
| 化学键 | H-H | O=O | H-O |
| 键能(kJ·mol-1) | 436 | 496 | 463 |
则生成1molH2O(g)可以放出热量
(2)下列反应中,既属于氧化还原反应,又属于放热反应的是
a.盐酸与烧碱溶液反应 b.柠檬酸和碳酸氢钠反应
c.氢气在氧气中燃烧生成水 d.高温煅烧石灰石使其分解
e.铝和盐酸反应 f.浓硫酸溶于水
Ⅱ.A、B、C、D 四种金属按下表中装置进行实验。
| 装置 | 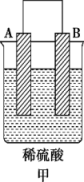 | 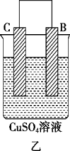 | 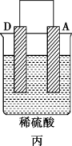 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
①装置甲中溶液中的阴离子移向
②装置乙中正极的电极反应式为
③装置丙中溶液的pH
④四种金属活动性由强到弱的顺序是
您最近一年使用:0次



