名校
1 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。CO2资源化利用对缓解碳减排压力具有重要意义。在二氧化碳催化加氢制甲烷的反应体系中,主要发生反应的热化学方程式为:
反应I:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH1=-164.7kJ·mol-1
CH4(g)+2H2O(g) ΔH1=-164.7kJ·mol-1
反应II:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
反应III:2CO(g)+2H2(g) CO2(g)+CH4(g) ΔH3=-247.1kJ·mol-1
CO2(g)+CH4(g) ΔH3=-247.1kJ·mol-1
向恒压、密闭容器中通入1molCO2和4molH2,平衡时体系内CH4、CO、CO2的物质的量(n)与温度(T)的变化关系如图所示。

(1)反应I~III中,属于吸热反应的是____ (填反应序号)。
(2)反应I的平衡常数表达式为____ 。
(3)盖斯定律的重要价值是可以利用已知反应的反应热求得未知反应的反应热,利用上述反应计算CH4(g)+H2O(g) CO(g)+3H2(g)的ΔH=
CO(g)+3H2(g)的ΔH=____ 。
(4)结合上述反应,解释图中CO的物质的量随温度的变化的原因:___ 。
(5)在实际生产中为了提高甲烷的产量,选择的反应条件为较低温度和使用合适的催化剂,从反应原理角度说明选择该反应条件的理由:____ 、____ 。
反应I:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ΔH1=-164.7kJ·mol-1
CH4(g)+2H2O(g) ΔH1=-164.7kJ·mol-1反应II:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1反应III:2CO(g)+2H2(g)
 CO2(g)+CH4(g) ΔH3=-247.1kJ·mol-1
CO2(g)+CH4(g) ΔH3=-247.1kJ·mol-1向恒压、密闭容器中通入1molCO2和4molH2,平衡时体系内CH4、CO、CO2的物质的量(n)与温度(T)的变化关系如图所示。

(1)反应I~III中,属于吸热反应的是
(2)反应I的平衡常数表达式为
(3)盖斯定律的重要价值是可以利用已知反应的反应热求得未知反应的反应热,利用上述反应计算CH4(g)+H2O(g)
 CO(g)+3H2(g)的ΔH=
CO(g)+3H2(g)的ΔH=(4)结合上述反应,解释图中CO的物质的量随温度的变化的原因:
(5)在实际生产中为了提高甲烷的产量,选择的反应条件为较低温度和使用合适的催化剂,从反应原理角度说明选择该反应条件的理由:
您最近一年使用:0次
2022-01-15更新
|
349次组卷
|
4卷引用:北京市第三十五中学2022-2023学年高三上学期 10月月考化学试题
解题方法
2 . 二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳,总反应可表示为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)+Q(Q>0)一般认为通过如下步骤来实现:①CO2(g)+H2(g)=CO(g)+H2O(g),②CO(g)+2H2(g)=CH3OH(g)。
(1)下列示意图中能体现总反应能量变化的是___ (填标号),判断的理由是___ 。
A.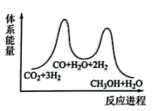 B.
B. C.
C.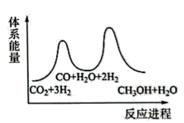
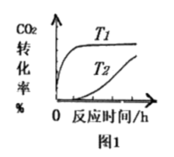
(2)在不同温度下,反应中CO2的转化率与时间的关系如图1。据图1可判断:温度T1__ T2(填“>”、“<”或“=”),理由是___ 。
总反应在起始物 =3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250℃下的x(CH3OH)~p、在p=5×105Pa下的x(CH3OH)~t如图2所示。
=3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250℃下的x(CH3OH)~p、在p=5×105Pa下的x(CH3OH)~t如图2所示。

(3)图2中对应等温过程的曲线是___ ,判断的理由是___ 。
(4)当x(CH3OH)=0.10时,CO2的平衡转化率a=___ 。反应条件可能为___ 或___ 。
(1)下列示意图中能体现总反应能量变化的是
A.
 B.
B. C.
C.
(2)在不同温度下,反应中CO2的转化率与时间的关系如图1。据图1可判断:温度T1

总反应在起始物
 =3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250℃下的x(CH3OH)~p、在p=5×105Pa下的x(CH3OH)~t如图2所示。
=3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250℃下的x(CH3OH)~p、在p=5×105Pa下的x(CH3OH)~t如图2所示。
(3)图2中对应等温过程的曲线是
(4)当x(CH3OH)=0.10时,CO2的平衡转化率a=
您最近一年使用:0次
名校
解题方法
3 . 化学链燃烧技术的基本原理是将传统燃料与空气接触反应的燃烧借助载氧剂(如 ,FeO等)的作用分解为几个气固反应,燃料与空气无须接触,由载氧剂将空气中的氧气传递给燃料。回答下列问题:
,FeO等)的作用分解为几个气固反应,燃料与空气无须接触,由载氧剂将空气中的氧气传递给燃料。回答下列问题:
(1)用Fe0作载氧剂,部分反应的1g Kp与温度的关系如图所示。[已知:平衡常数Kp是用平衡分压代替平衡浓度(平衡分压=总压×物质的量分数)]
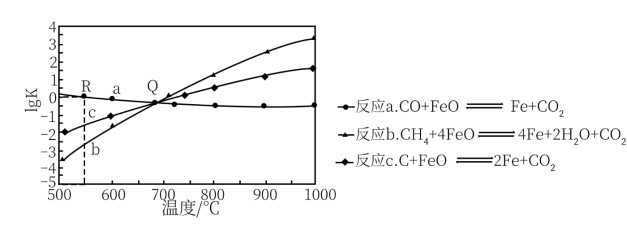
①图中涉及的反应中,属于吸热反应的是反应___________ (填字母a、b或c)。
②R点对应温度下,向某恒容密闭容器中通入1mol CO,并加入足量的FeO,只发生反应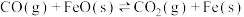 ,则CO的平衡转化率为
,则CO的平衡转化率为___________ 。
(2)在T℃下,向某恒容密闭容器中加入2mol (g)和8mol FeO(s)进行反应:
(g)和8mol FeO(s)进行反应: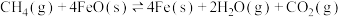 。反应起始时压强为
。反应起始时压强为 ,达到平衡状态时,容器的气体压强是起始压强的2倍。
,达到平衡状态时,容器的气体压强是起始压强的2倍。
①反应达平衡时,容器内气体的总物质的量为___________ mol;
②T℃下,该反应的Kp=___________ 。
(3)一种微胶囊吸收剂,将煤燃烧排放的 以安全、高效的方式处理掉,胶囊内部充有
以安全、高效的方式处理掉,胶囊内部充有 溶液,其原理如图所示。
溶液,其原理如图所示。
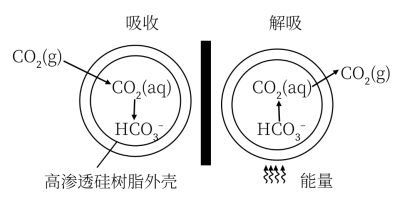
①这种微胶囊吸收 的原理是
的原理是___________ (用离子方程式表示)。
②将解吸后的 催化加氢可制取乙烯。
催化加氢可制取乙烯。
已知:
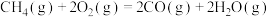
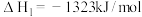

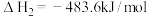
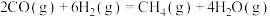

___________ 。
 ,FeO等)的作用分解为几个气固反应,燃料与空气无须接触,由载氧剂将空气中的氧气传递给燃料。回答下列问题:
,FeO等)的作用分解为几个气固反应,燃料与空气无须接触,由载氧剂将空气中的氧气传递给燃料。回答下列问题:(1)用Fe0作载氧剂,部分反应的1g Kp与温度的关系如图所示。[已知:平衡常数Kp是用平衡分压代替平衡浓度(平衡分压=总压×物质的量分数)]

①图中涉及的反应中,属于吸热反应的是反应
②R点对应温度下,向某恒容密闭容器中通入1mol CO,并加入足量的FeO,只发生反应
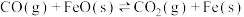 ,则CO的平衡转化率为
,则CO的平衡转化率为(2)在T℃下,向某恒容密闭容器中加入2mol
 (g)和8mol FeO(s)进行反应:
(g)和8mol FeO(s)进行反应: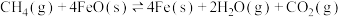 。反应起始时压强为
。反应起始时压强为 ,达到平衡状态时,容器的气体压强是起始压强的2倍。
,达到平衡状态时,容器的气体压强是起始压强的2倍。①反应达平衡时,容器内气体的总物质的量为
②T℃下,该反应的Kp=
(3)一种微胶囊吸收剂,将煤燃烧排放的
 以安全、高效的方式处理掉,胶囊内部充有
以安全、高效的方式处理掉,胶囊内部充有 溶液,其原理如图所示。
溶液,其原理如图所示。
①这种微胶囊吸收
 的原理是
的原理是②将解吸后的
 催化加氢可制取乙烯。
催化加氢可制取乙烯。已知:
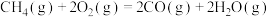
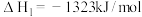

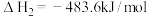
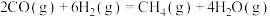

您最近一年使用:0次
2021-11-23更新
|
150次组卷
|
3卷引用:湖南省天壹名校联盟.宁乡市2021-2022学年高三11月调研考试化学试题
解题方法
4 . A~I分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出)。且已知G为主族元素的固态氧化物,F是红褐色难溶于水的沉淀,A、B、C、D、E、F六种物质中均含同一种元素。
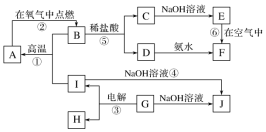
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素是___________ (填元素符号)。
(2)写出C、E、G物质的化学式:C___________ ,E ___________ ,G___________ 。
(3)写出④、⑥反应的化学方程式:反应④:___________ ;反应⑥:___________ 。
(4)从能量变化的角度看,①②③反应中属于吸热反应的是___________ (填序号)。

请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素是
(2)写出C、E、G物质的化学式:C
(3)写出④、⑥反应的化学方程式:反应④:
(4)从能量变化的角度看,①②③反应中属于吸热反应的是
您最近一年使用:0次
5 . 碳与生产、生活、环境保护等方面关系密切。
回答下列问题:
(1)利用活性炭的___________ 作用可去除水中的悬浮杂质。
(2)炭黑可以活化氧分子得到活化氧,活化氧可以快速将 氧化为
氧化为 ,其活化过程中的能量变化如下图所示:
,其活化过程中的能量变化如下图所示:

可知生成活化氧的
___________ 0(填“>”、“<”、“=”),活化过程中有水时的活化能降低了___________ eV。在酸雨的形成过程中,炭黑起___________ 作用。
(3)以焦炭为原料,在高温下与水蒸气反应可制得合成气(CO和 )。在
)。在 ℃、50MPa达平衡时,
℃、50MPa达平衡时, (g)的转化率为70%,则其分压平衡常数
(g)的转化率为70%,则其分压平衡常数
___________ MPa(计算结果保留2位小数)。
(4)合成气用于制备甲醇的反应为: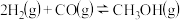
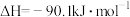 ,在
,在 ℃时,容积相同的甲、乙、丙三个恒容密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表。
℃时,容积相同的甲、乙、丙三个恒容密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表。
根据上表信息填空(填写“>”、“<”或“=”):
①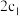
___________  ;②
;②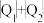
___________ 90.1;③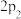
___________  ;④
;④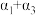
___________ 1。
回答下列问题:
(1)利用活性炭的
(2)炭黑可以活化氧分子得到活化氧,活化氧可以快速将
 氧化为
氧化为 ,其活化过程中的能量变化如下图所示:
,其活化过程中的能量变化如下图所示:
可知生成活化氧的

(3)以焦炭为原料,在高温下与水蒸气反应可制得合成气(CO和
 )。在
)。在 ℃、50MPa达平衡时,
℃、50MPa达平衡时, (g)的转化率为70%,则其分压平衡常数
(g)的转化率为70%,则其分压平衡常数
(4)合成气用于制备甲醇的反应为:
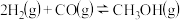
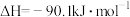 ,在
,在 ℃时,容积相同的甲、乙、丙三个恒容密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表。
℃时,容积相同的甲、乙、丙三个恒容密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表。| 容器 | 甲 | 乙 | 丙 | |
| 起始反应投入量 | 2mol  、1mol CO 、1mol CO | 1mol  | 2mol  | |
| 平衡数据 |  |  |  |  |
| 反应的能量变化/kJ |  | 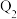 | 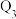 | |
| 体系压强/Pa |  |  |  | |
| 反应物转化率 | 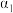 | 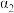 | 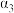 | |
①
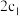
 ;②
;②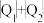
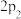
 ;④
;④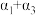
您最近一年使用:0次
名校
6 . 写出或完成下列热化学方程式。
(1)下列变化过程,属于放热反应的是____ 。
①浓H2SO4稀释;②酸碱中和反应;③H2在Cl2中燃烧;④Ba(OH)2•8H2O与NH4Cl;⑤铝热反应;⑥碳高温条件下还原CO2。
(2)0.5molCH4完全燃烧生成CO2和液态水时,放出445kJ的热量。写出CH4燃烧的热化学方程式__ 。
(3)通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。表中是一些化学键的键能。
根据键能数据估算下列反应:CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热△H为___ 。
(4)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
①Mg(s)+H2(g)=MgH2(s)ΔH1
②Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s)ΔH2
求Mg2Ni(s)+2H2(g)=Mg2NiH4(s)ΔH=____ 。
(5)已知反应:N2(g)+3H2(g) 2NH3(g)△H=-92.2kJ/mol,现取1molN2(g)和3molH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量
2NH3(g)△H=-92.2kJ/mol,现取1molN2(g)和3molH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量___ 92.2kJ(填“大于”“等于”或“小于”),原因是___ 。
(1)下列变化过程,属于放热反应的是
①浓H2SO4稀释;②酸碱中和反应;③H2在Cl2中燃烧;④Ba(OH)2•8H2O与NH4Cl;⑤铝热反应;⑥碳高温条件下还原CO2。
(2)0.5molCH4完全燃烧生成CO2和液态水时,放出445kJ的热量。写出CH4燃烧的热化学方程式
(3)通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。表中是一些化学键的键能。
| 化学键 | C—H | C—F | H—F | F—F |
| 键能kJ/mol | 414 | 489 | 565 | 155 |
(4)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
①Mg(s)+H2(g)=MgH2(s)ΔH1
②Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s)ΔH2
求Mg2Ni(s)+2H2(g)=Mg2NiH4(s)ΔH=
(5)已知反应:N2(g)+3H2(g)
 2NH3(g)△H=-92.2kJ/mol,现取1molN2(g)和3molH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量
2NH3(g)△H=-92.2kJ/mol,现取1molN2(g)和3molH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量
您最近一年使用:0次
7 . (1)下列变化中属于吸热反应的是_______
①铝片与稀盐酸的反应
②将胆矾加热变为白色粉末
③干冰汽化
④氯酸钾分解制氧气
⑤甲烷在氧气中的燃烧反应
⑥NaHCO3与盐酸的反应
(2)反应C(s)+H2O(g)⇌CO(g)+H2(g)在一个容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是_______
①增加C的量
②将容器的体积缩小一半
③保持体积不变,充入N2使体系压强增大
④保持压强不变,充入N2使容器体积变大
(3)微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示。
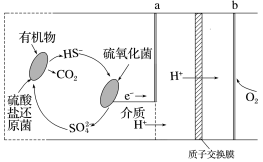
①该微生物燃料电池,负极为_______ (填“a”或“b”);
②该电池正极电极反应式为_______
③当电路中有0.5 mol电子发生转移,则有_______ mol的H+通过质子交换膜。
①铝片与稀盐酸的反应
②将胆矾加热变为白色粉末
③干冰汽化
④氯酸钾分解制氧气
⑤甲烷在氧气中的燃烧反应
⑥NaHCO3与盐酸的反应
(2)反应C(s)+H2O(g)⇌CO(g)+H2(g)在一个容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量
②将容器的体积缩小一半
③保持体积不变,充入N2使体系压强增大
④保持压强不变,充入N2使容器体积变大
(3)微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示。

①该微生物燃料电池,负极为
②该电池正极电极反应式为
③当电路中有0.5 mol电子发生转移,则有
您最近一年使用:0次
2021-06-23更新
|
88次组卷
|
2卷引用:重庆市五校2022-2023学年高三上学期联考化学试题
解题方法
8 . 综合利用研究发现,硼镁铁矿(主要成分为 ,含有SiO2、FeO、Fe2O3等杂质)可以制备硼酸、铁红和碳酸镁等常用化工试剂,工艺流程图如下:
,含有SiO2、FeO、Fe2O3等杂质)可以制备硼酸、铁红和碳酸镁等常用化工试剂,工艺流程图如下:
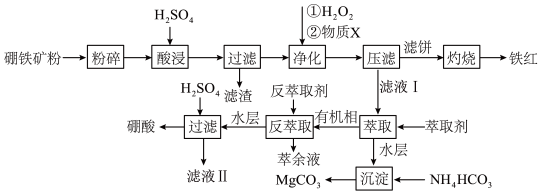
回答下列问题:
(1)硼镁矿粉碎的目的是 发生的离子反应是
发生的离子反应是
(2)为提高产品纯度,“净化”时用的试剂X为
(3)过滤所得碳酸镁需冷水洗涤后再进行干燥证明碳酸镁固体洗涤干净的具体操作为
(4)不同条件下硼酸的萃取率图象如下:
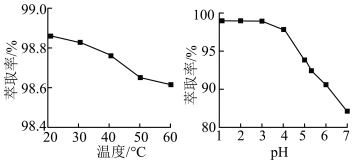
萃取过程为
您最近一年使用:0次
2021-05-23更新
|
404次组卷
|
3卷引用:山东省济南市2021届高三第三次摸底考试化学试题
9 . 汽车尾气是否为导致空气质量问题的主要原因,由此引发的“汽车限行”争议,是当前备受关注的社会性科学议题。
(1)反应
 可有效降低汽车尾气污染物的排放。一定条件下该反应经历三个基元反应阶段,反应历程如图所示(
可有效降低汽车尾气污染物的排放。一定条件下该反应经历三个基元反应阶段,反应历程如图所示( 表示过渡态、
表示过渡态、 表示中间产物)。
表示中间产物)。
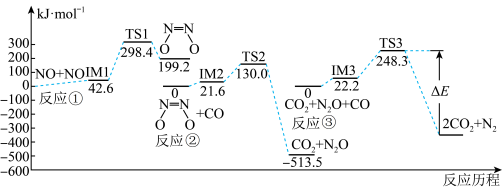
三个基元反应中,属于放热反应的是___________ (填标号);图中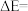
___________  。
。
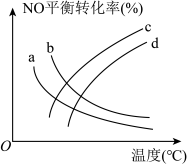
(2)探究温度、压强(2 、5
、5 )对反应
)对反应 的影响,如图所示,表示2
的影响,如图所示,表示2 的是
的是___________ (填标号)。
(3)用 可以消除
可以消除 污染:
污染:

①某条件下该反应速率 ,
,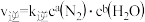 ,该反应的平衡常数
,该反应的平衡常数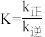 ,则
,则
___________ ,
___________ 。
②一定温度下,在体积为1L的恒容密闭容器中加入4
 和6
和6
 发生上述反应,测得
发生上述反应,测得 和
和 的物质的量随时间变化如图。
的物质的量随时间变化如图。
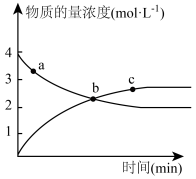
a点的正反应速率___________ c点的逆反应速率(填“大于”、“小于”或“等于”);测得平衡时体系压强为 ),则该反应温度下
),则该反应温度下
___________ 。(用含 的式子表示,只列式不用化简)。若在相同时间内测得
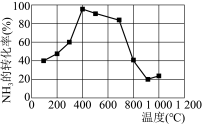
的式子表示,只列式不用化简)。若在相同时间内测得 的转化率随温度的变化曲线如下图,400℃~900℃之间
的转化率随温度的变化曲线如下图,400℃~900℃之间 的转化率下降由缓到急的原因是
的转化率下降由缓到急的原因是___________ 。
(1)反应

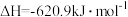 可有效降低汽车尾气污染物的排放。一定条件下该反应经历三个基元反应阶段,反应历程如图所示(
可有效降低汽车尾气污染物的排放。一定条件下该反应经历三个基元反应阶段,反应历程如图所示( 表示过渡态、
表示过渡态、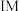 表示中间产物)。
表示中间产物)。
三个基元反应中,属于放热反应的是
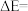
 。
。(2)探究温度、压强(2
 、5
、5 )对反应
)对反应 的影响,如图所示,表示2
的影响,如图所示,表示2 的是
的是
(3)用
 可以消除
可以消除 污染:
污染: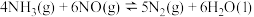

①某条件下该反应速率
 ,
,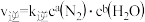 ,该反应的平衡常数
,该反应的平衡常数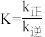 ,则
,则

②一定温度下,在体积为1L的恒容密闭容器中加入4

 和6
和6
 发生上述反应,测得
发生上述反应,测得 和
和 的物质的量随时间变化如图。
的物质的量随时间变化如图。
a点的正反应速率
 ),则该反应温度下
),则该反应温度下
 的式子表示,只列式不用化简)。若在相同时间内测得
的式子表示,只列式不用化简)。若在相同时间内测得 的转化率随温度的变化曲线如下图,400℃~900℃之间
的转化率随温度的变化曲线如下图,400℃~900℃之间 的转化率下降由缓到急的原因是
的转化率下降由缓到急的原因是
您最近一年使用:0次
2021-05-11更新
|
763次组卷
|
4卷引用:山东省青岛市2021届高三二模化学试题
山东省青岛市2021届高三二模化学试题(已下线)专题15 化学反应原理综合-备战2022年高考化学真题及地市好题专项集训【山东专用】湖北武汉市2022届高三5月第一次模拟考试化学试题山东省青岛市即墨区第一中学2022-2023学年高三上学期10月月考化学试题
解题方法
10 . CH4-CO2重整反应[CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=+247kJ/mol]在大力推进生态文明建设、“碳达峰”、“碳中和”的时代背景下,受到更为广泛的关注。
I.该反应以两种温室气体为原料,可以生成合成气。如何减少反应过程中的催化剂积炭,是研究的热点之一、某条件下,发生主反应的同时,还发生了积炭反应:
CO歧化:2CO(g)=CO2(g)+C(s) △H=-172kJ/mol
CH4裂解:CH4(g)=C(s)+2H2(g) △H=+75kJ/mol
(1)对积炭反应进行计算,得到以下温度和压强对积炭反应中平衡炭量的影响图,其中表示温度和压强对CH4裂解反应中平衡炭量影响的是(选填序号)___________ ,理由是___________ 。

(2)实验表明,在重整反应中,低温、高压时会有显著积炭产生,由此可推断,对于该重整反应而言,其积炭主要由___________ 反应产生。
综合以上分析,为抑制积炭产生,应选用高温、低压条件。
II.该重整反应也可用于太阳能、核能、高温废热等的储存,储能研究是另一研究热点。
(3)该反应可以储能的原因是___________ 。
某条件下,除发生主反应外,主要副反应为CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41kJ/mol。研究者研究反应物气体流量、CH4/CO2物质的量比对CH4转化率(XCH4)、储能效率的影响,部分数据如下所示。
【资料】储能效率:热能转化为化学能的效率,用ηchem表示。ηchem=Qchem/Q。其中,Qchem是通过化学反应吸收的热量,Q是设备的加热功率。
(4)气体流量越大,CH4转化率越低,原因是:随着流量的提高,反应物预热吸热量增多,体系温度明显降低,___________ 。
(5)对比实验___________ (填序号),可得出结论:CH4/CO2越低,CH4转化率越高。
(6)对比②、③发现,混合气中CO2占比越低,储能效率越高,原因可能是___________ (该条件下设备的加热功率视为不变)。
I.该反应以两种温室气体为原料,可以生成合成气。如何减少反应过程中的催化剂积炭,是研究的热点之一、某条件下,发生主反应的同时,还发生了积炭反应:
CO歧化:2CO(g)=CO2(g)+C(s) △H=-172kJ/mol
CH4裂解:CH4(g)=C(s)+2H2(g) △H=+75kJ/mol
(1)对积炭反应进行计算,得到以下温度和压强对积炭反应中平衡炭量的影响图,其中表示温度和压强对CH4裂解反应中平衡炭量影响的是(选填序号)

(2)实验表明,在重整反应中,低温、高压时会有显著积炭产生,由此可推断,对于该重整反应而言,其积炭主要由
综合以上分析,为抑制积炭产生,应选用高温、低压条件。
II.该重整反应也可用于太阳能、核能、高温废热等的储存,储能研究是另一研究热点。
(3)该反应可以储能的原因是
某条件下,除发生主反应外,主要副反应为CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41kJ/mol。研究者研究反应物气体流量、CH4/CO2物质的量比对CH4转化率(XCH4)、储能效率的影响,部分数据如下所示。
【资料】储能效率:热能转化为化学能的效率,用ηchem表示。ηchem=Qchem/Q。其中,Qchem是通过化学反应吸收的热量,Q是设备的加热功率。
| 序号 | 加热温度/℃ | 反应物气体流量/L·min-1 | CH4/CO2 | XCH4/% | ηchem/% |
| ① | 800 | 4 | 2:2 | 79.6 | 52.2 |
| ② | 800 | 6 | 3:3 | 64.2 | 61.9 |
| ③ | 800 | 6 | 2:4 | 81.1 | 41.6 |
(5)对比实验
(6)对比②、③发现,混合气中CO2占比越低,储能效率越高,原因可能是
您最近一年使用:0次
2021-05-10更新
|
351次组卷
|
2卷引用:北京市昌平区2021届高三下学期二模考试化学试题



