2021·全国·模拟预测
1 . CO、NOx、SO2等有毒气体会危害人体健康,破坏环境,对其进行无害处理研究一直是科技界关注的重点。请回答以下问题:
(1)研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如图所示。

①Fe++N2O→FeO++N2的反应为_______ (填“吸热”或“放热”)反应。
②若反应在恒容密闭容器中进行,温度越高,反应速率是否越快_______ (填“是”或“否”),原因是_______ 。
(2)利用反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g),可实现汽车尾气的无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比m[m= ]的关系如图所示。
]的关系如图所示。
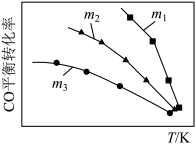
①比较m1、m2、m3的大小:_______ 。
②若m=2,反应达平衡时,NO的转化率为60%,N2的体积分数为_______ 。
③若反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)的正、逆反应速率可表示为v正=k正·c2(NO)·c2(CO);v逆=k逆·c(N2)·c2(CO2),k正、k逆分别为正、逆反应速率常数,仅与温度有关。一定温度下,在体积为1L的容器中加入2 mol NO和2 mol CO发生上述反应,测得CO和CO2物质的量浓度相等时v正:v逆=160:1,平衡常数K为_______ 。
(3)若将NO2与O2通入如图所示甲装置,D电极上有红色物质析出,则A极通入的气体是_______ ,B电极的电极反应式为_______ ,经过一段时间后,若乙中C、D两电极产生的气体体积相等(相同条件下),则加入下列_______ 物质可使溶液复原。
A.CuO B.CuCO3 C.Cu(OH)2

(4)研究表明,氮氧化物和二氧化硫等气体与雾霾的形成有关(如图所示)。
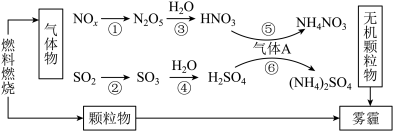
①下列说法中不正确的是_______ 。
a.化石燃料的燃烧与雾霾的形成有关 b.A是形成无机颗粒物的催化剂
c.雾霾中只有颗粒物 d.涉及的6个反应中只有2个氧化还原反应
②农村家庭常用燃料蜂窝煤,在制备蜂窝煤时常加CaO,请简述加CaO的作用:_______ 。
(1)研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如图所示。

①Fe++N2O→FeO++N2的反应为
②若反应在恒容密闭容器中进行,温度越高,反应速率是否越快
(2)利用反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g),可实现汽车尾气的无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比m[m=
 ]的关系如图所示。
]的关系如图所示。
①比较m1、m2、m3的大小:
②若m=2,反应达平衡时,NO的转化率为60%,N2的体积分数为
③若反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)的正、逆反应速率可表示为v正=k正·c2(NO)·c2(CO);v逆=k逆·c(N2)·c2(CO2),k正、k逆分别为正、逆反应速率常数,仅与温度有关。一定温度下,在体积为1L的容器中加入2 mol NO和2 mol CO发生上述反应,测得CO和CO2物质的量浓度相等时v正:v逆=160:1,平衡常数K为
(3)若将NO2与O2通入如图所示甲装置,D电极上有红色物质析出,则A极通入的气体是
A.CuO B.CuCO3 C.Cu(OH)2

(4)研究表明,氮氧化物和二氧化硫等气体与雾霾的形成有关(如图所示)。

①下列说法中不正确的是
a.化石燃料的燃烧与雾霾的形成有关 b.A是形成无机颗粒物的催化剂
c.雾霾中只有颗粒物 d.涉及的6个反应中只有2个氧化还原反应
②农村家庭常用燃料蜂窝煤,在制备蜂窝煤时常加CaO,请简述加CaO的作用:
您最近一年使用:0次
20-21高三上·江西南昌·期中
解题方法
2 . (1)乙基叔丁基醚(以ETBE表示)是一种性能优良的高辛烷值汽油调和剂。用乙醇与异丁烯(以IB表示)在催化剂HZSM-5催化下合成ETBE,反应化学方程式为:C2H5OH(g)+IB(g)=ETBE(g)△H。反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如图所示,该反应的△H=___ kJ/mol。反应历程的最优途径是____ (填C1、C2或C3)。
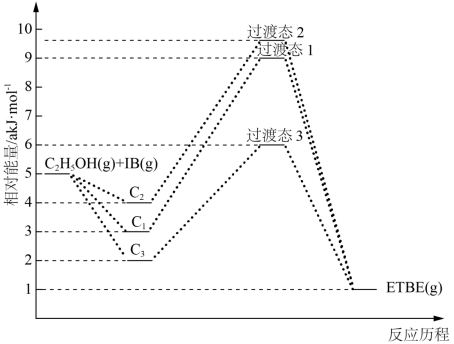
C1表示先吸附乙醇,C2表示先吸附异丁烯,C3表示乙醇和异丁烯同时吸附
(2)用NH3可消除NO污染,反应原理为:4NH3+6NO 5N2+6H2O,以n(NH3):n(NO)分别为4:1、3:1、1:3投料,得到NO脱除率随温度变化的曲线如图所示。
5N2+6H2O,以n(NH3):n(NO)分别为4:1、3:1、1:3投料,得到NO脱除率随温度变化的曲线如图所示。

①曲线a对应的n(NH3):n(NO)=___ 。
②曲线c中NO的起始浓度为4×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为____ 。
③由图可知,无论以何种比例反应,在温度超过900℃时NO脱除率都会骤然下降,可能的原因是____ (至少写两条)。
(3)已知NO2存在如下平衡:2NO2(g) N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1•p2(NO2),v(N2O4)=k2•p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1•p2(NO2),v(N2O4)=k2•p(N2O4),相应的速率与其分压关系如图所示。

一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=____ ;在上图标出点中,指出能表示反应达到平衡状态的点是___ ,理由是___ 。
(4)二氧化硫的催化氧化是工业上生产硫酸的主要反应O2(g)+2SO2(g) 2SO3(g)。
2SO3(g)。
已知:标准平衡常数Kθ= ,其中pθ为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为ω,则Kθ=
,其中pθ为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为ω,则Kθ=____ (用含ω的最简式表示)。

C1表示先吸附乙醇,C2表示先吸附异丁烯,C3表示乙醇和异丁烯同时吸附
(2)用NH3可消除NO污染,反应原理为:4NH3+6NO
 5N2+6H2O,以n(NH3):n(NO)分别为4:1、3:1、1:3投料,得到NO脱除率随温度变化的曲线如图所示。
5N2+6H2O,以n(NH3):n(NO)分别为4:1、3:1、1:3投料,得到NO脱除率随温度变化的曲线如图所示。
①曲线a对应的n(NH3):n(NO)=
②曲线c中NO的起始浓度为4×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为
③由图可知,无论以何种比例反应,在温度超过900℃时NO脱除率都会骤然下降,可能的原因是
(3)已知NO2存在如下平衡:2NO2(g)
 N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1•p2(NO2),v(N2O4)=k2•p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1•p2(NO2),v(N2O4)=k2•p(N2O4),相应的速率与其分压关系如图所示。
一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=
(4)二氧化硫的催化氧化是工业上生产硫酸的主要反应O2(g)+2SO2(g)
 2SO3(g)。
2SO3(g)。已知:标准平衡常数Kθ=
 ,其中pθ为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为ω,则Kθ=
,其中pθ为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为ω,则Kθ=
您最近一年使用:0次
3 . 雾霾已经成为部分城市发展的障碍。雾霾形成的最主要原因是人为排放,其中汽车尾气污染对雾霾的“贡献”逐年增加。回答下列问题:
(1)汽车尾气中含有NO,N2与O2生成NO的过程如下:
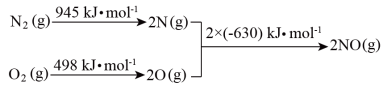
①1molO2与1molN2的总能量比2molNO的总能量______ (填“高”或“低”)。
②N2(g)+O2(g)=2NO(g) ΔH=_____ 。
(2)氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气;CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1。如图是该反应的能量变化图:
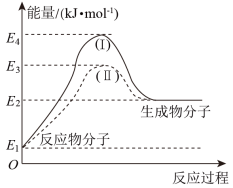
①通过图中信息可判断反应CH3OH(g)+H2O(g)=CO2(g)+3H2(g)的△H1____ 0(填“>”“=”或“<”)。
②图中途径II的条件是____ ,途径I的反应热_____ (填“>”“=”或“<”)途径II的反应热。
③已知:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H2,H2(g)+ O2(g)=H2O(g)△H3。△H1、△H2、△H3三者的关系式为
O2(g)=H2O(g)△H3。△H1、△H2、△H3三者的关系式为_____ 。
④已知25℃、101kPa,1gH2完全燃烧生成液态水时放出142.9kJ热量,则H2的燃烧热为____ 。
(1)汽车尾气中含有NO,N2与O2生成NO的过程如下:
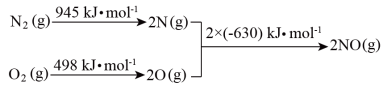
①1molO2与1molN2的总能量比2molNO的总能量
②N2(g)+O2(g)=2NO(g) ΔH=
(2)氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气;CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1。如图是该反应的能量变化图:

①通过图中信息可判断反应CH3OH(g)+H2O(g)=CO2(g)+3H2(g)的△H1
②图中途径II的条件是
③已知:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H2,H2(g)+
 O2(g)=H2O(g)△H3。△H1、△H2、△H3三者的关系式为
O2(g)=H2O(g)△H3。△H1、△H2、△H3三者的关系式为④已知25℃、101kPa,1gH2完全燃烧生成液态水时放出142.9kJ热量,则H2的燃烧热为
您最近一年使用:0次
名校
解题方法
4 . 甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样。一定条件下,在体积为 的密闭容器中,充入
的密闭容器中,充入 和
和 ,发生反应:
,发生反应: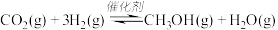 ,测得
,测得 的物质的量随时间变化如表所示,该反应的能量变化如图所示:
的物质的量随时间变化如表所示,该反应的能量变化如图所示:

(1)该反应为_____ (填放热或吸热)反应。
(2)从反应开始到5min末,用氢气浓度变化表示的平均反应速率v(H2)=___ ,容器内平衡时与起始时的压强之比为____ 。
(3)在相同温度容积不变的条件下,能说明该反应已达平衡状态的是____ (填写序号字母)。
a.容器内的平均相对分子质量保持不变 b.容器内压强保持不变
c. 的消耗速率与
的消耗速率与 的生成速率之比为3:1 d.
的生成速率之比为3:1 d.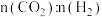 的比值保持不变
的比值保持不变
(4)将 设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。实验测得电池工作时OHˉ向B电极定向移动,则
设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。实验测得电池工作时OHˉ向B电极定向移动,则_____ (填“A”或“B”)处电极入口通甲醇,当电路中通过 电子时,理论上消耗
电子时,理论上消耗 质量为
质量为_____ 克。
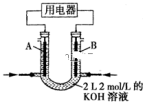
(5)下列化学电池不易造成环境污染的是____ (填字母)。
A.甲醇氧气燃料电池 B.锌锰电池 C.镍镉电池 D.铅蓄电池
铅蓄电池是最常见的二次电池,放电时的化学方程式为: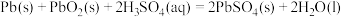 。该蓄电池放电时,正极电极反应方程式为
。该蓄电池放电时,正极电极反应方程式为__________ 。
 的密闭容器中,充入
的密闭容器中,充入 和
和 ,发生反应:
,发生反应: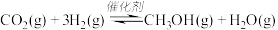 ,测得
,测得 的物质的量随时间变化如表所示,该反应的能量变化如图所示:
的物质的量随时间变化如表所示,该反应的能量变化如图所示:
 | 0 | 2 | 5 | 10 | 15 |
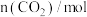 | 2 | 0.75 | 0.5 | 0.25 | 0.25 |
(1)该反应为
(2)从反应开始到5min末,用氢气浓度变化表示的平均反应速率v(H2)=
(3)在相同温度容积不变的条件下,能说明该反应已达平衡状态的是
a.容器内的平均相对分子质量保持不变 b.容器内压强保持不变
c.
 的消耗速率与
的消耗速率与 的生成速率之比为3:1 d.
的生成速率之比为3:1 d.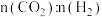 的比值保持不变
的比值保持不变(4)将
 设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。实验测得电池工作时OHˉ向B电极定向移动,则
设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。实验测得电池工作时OHˉ向B电极定向移动,则 电子时,理论上消耗
电子时,理论上消耗 质量为
质量为
(5)下列化学电池不易造成环境污染的是
A.甲醇氧气燃料电池 B.锌锰电池 C.镍镉电池 D.铅蓄电池
铅蓄电池是最常见的二次电池,放电时的化学方程式为:
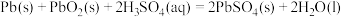 。该蓄电池放电时,正极电极反应方程式为
。该蓄电池放电时,正极电极反应方程式为
您最近一年使用:0次
2020-07-29更新
|
141次组卷
|
3卷引用: 重庆市万州第二高级中学2022-2023学年高三下学期2月月考化学试题
5 . 我们的生活离不开化学。化学物质在不同的领域发挥着重要的作用。
(1)目前科学家探索利用甲烷将氮氧化物还原为氮气和水,反应机理如下:
CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H= —574kJ•mol-1
CH4(g)+4NO(g) =2N2(g)+CO2(g)+2H2O(g) △H= —1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为__________ 。
(2)化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时发生如下分解反应: 2Mg5Al3(OH)19(H2O)4 27H2O +10MgO+3Al2O3写出该化合物作阻燃剂的两条依据:
27H2O +10MgO+3Al2O3写出该化合物作阻燃剂的两条依据:__________ 、__________ 。
(3)焦亚硫酸钠(Na2S2O5)是一种常见的食品抗氧化剂。
①焦亚硫酸钠(Na2S2O5)中硫元素的化合价为_______ 。
②向某些饮料中添加少量焦亚硫酸钠(Na2S2O5),可降低饮料中溶解氧的含量,发生反应的离子方程式为__________ 。
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示。下列说法正确的是________ 。
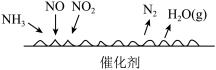
A.由图可知SCR技术中NO、NO2为氧化剂
B.若用Fe做催化剂时,在氨气足量的情况下,当c(NO2)∶c(NO)=1∶1时,脱氮率最佳
C.每生成1molN2,转移电子3mol
D.催化剂通过参与反应降低反应的活化能,提高平衡转化率
(1)目前科学家探索利用甲烷将氮氧化物还原为氮气和水,反应机理如下:
CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H= —574kJ•mol-1
CH4(g)+4NO(g) =2N2(g)+CO2(g)+2H2O(g) △H= —1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为
(2)化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时发生如下分解反应: 2Mg5Al3(OH)19(H2O)4
 27H2O +10MgO+3Al2O3写出该化合物作阻燃剂的两条依据:
27H2O +10MgO+3Al2O3写出该化合物作阻燃剂的两条依据:(3)焦亚硫酸钠(Na2S2O5)是一种常见的食品抗氧化剂。
①焦亚硫酸钠(Na2S2O5)中硫元素的化合价为
②向某些饮料中添加少量焦亚硫酸钠(Na2S2O5),可降低饮料中溶解氧的含量,发生反应的离子方程式为
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示。下列说法正确的是

A.由图可知SCR技术中NO、NO2为氧化剂
B.若用Fe做催化剂时,在氨气足量的情况下,当c(NO2)∶c(NO)=1∶1时,脱氮率最佳
C.每生成1molN2,转移电子3mol
D.催化剂通过参与反应降低反应的活化能,提高平衡转化率
您最近一年使用:0次
解题方法
6 . 目前Haber-Bosch法是工业合成氨的主要方式,其生产条件需要高温高压。为了有效降低能耗,过渡金属催化还原氮气合成氨被认为是具有巨大前景的替代方法。催化过程一般有吸附—解离—反应—脱附等过程,图示为N2和H2在固体催化剂表面合成氨反应路径的势能面图(部分数据略),其中“*”表示被催化剂吸附。
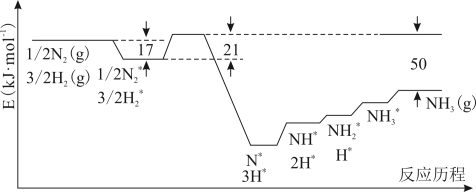
(1)氨气的脱附是____ 过程(填“吸热”或“放热”),合成氨的热化学方程式为_____
(2)合成氨的捷姆金和佩热夫速率方程式为 w= k1 p(N2) -k2
-k2 ,w为反应的瞬时总速率,为正反应和逆反应速率之差,k1、k2是正、逆反应速率常数。合成氨反应N2+3H2⇌2NH3的平衡常数Kp=
,w为反应的瞬时总速率,为正反应和逆反应速率之差,k1、k2是正、逆反应速率常数。合成氨反应N2+3H2⇌2NH3的平衡常数Kp=_________ (用k1,k2表示)(注:Kp用各物质平衡分压来表示)。
(3)若将2.0molN2和6.0molH2通入体积为1L的密闭容器中,分别在T1和T2温度下进行反应。曲线A表示T2温度下n(H2)的变化,曲线B表示T1温度下n(NH3)的变化,T2温度下反应到a点恰好达到平衡。

①温度T1___ T2 (填“>”、“<”或“=”下同),T1温度下恰好平衡时,曲线B上的点为b(m, n ),则m___ 12,n__ 2。
②T2 温度下,反应从开始到恰好平衡时平均速率v(N2) =_____ 。
③T2温度下,合成氨反应N2+3H2⇌2NH3的平衡常数的数值是____ ;若某时刻,容器内气体的压强为起始时的80%,则此时v(正)____ v(逆)(填“>”、“<”或“=”)。
(4)工业上通过降低反应后混合气体的温度而使氨气分离出来。这种分离物质的方法, 其原理类似于下列方法中的___ (填序号)。
A.过滤 B.蒸馏 C.渗析 D.萃取

(1)氨气的脱附是
(2)合成氨的捷姆金和佩热夫速率方程式为 w= k1 p(N2)
 -k2
-k2 ,w为反应的瞬时总速率,为正反应和逆反应速率之差,k1、k2是正、逆反应速率常数。合成氨反应N2+3H2⇌2NH3的平衡常数Kp=
,w为反应的瞬时总速率,为正反应和逆反应速率之差,k1、k2是正、逆反应速率常数。合成氨反应N2+3H2⇌2NH3的平衡常数Kp=(3)若将2.0molN2和6.0molH2通入体积为1L的密闭容器中,分别在T1和T2温度下进行反应。曲线A表示T2温度下n(H2)的变化,曲线B表示T1温度下n(NH3)的变化,T2温度下反应到a点恰好达到平衡。

①温度T1
②T2 温度下,反应从开始到恰好平衡时平均速率v(N2) =
③T2温度下,合成氨反应N2+3H2⇌2NH3的平衡常数的数值是
(4)工业上通过降低反应后混合气体的温度而使氨气分离出来。这种分离物质的方法, 其原理类似于下列方法中的
A.过滤 B.蒸馏 C.渗析 D.萃取
您最近一年使用:0次
7 . 丙烯是制造一次性医用口罩的重要原料。丙烷催化脱氢是工业生产丙烯的重要途径,丙烷催脱氢技术主要分为氧化脱氢和直接脱氢两种。回答下列问题:
(1)丙烷催化氧化脱氢法主要反应如下:
2C3H8(g)+O2(g) 2C3H6(g)+2H2O(g) △H1=-236kJ·mol-1(i)
2C3H6(g)+2H2O(g) △H1=-236kJ·mol-1(i)
反应过程中消耗的C3H8和 生成的C3H6的物质的量随温度的变化关系见下表。
①反应i中反应物的总能量_______ 生成物的总能量(填“大于”“小于”或“等于”)。
②分析表中数据得到丙烯的选择性随温度的升高而______ (填写“不变”“升高”“降 低”); 出现此结果的原因除生成乙烯等副产物外还可能是 _________ 。(C3H6的选择性=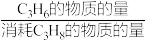 ×100%)
×100%)
(2)丙烷催化直接脱氢反应: C3H8(g) ⇌C3H6(g)+ H2(g) △H2=+124. 3kJ•mol -1 ( ii ) 副反应:C3H8 (g) ⇌C2H4 (g) + CH4(g) △H3(iii)
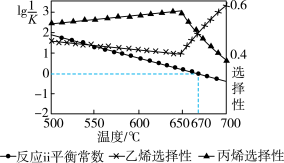
①反应 ii 的平衡常数、产物丙烯选择性、副产物乙烯选择性与温度关系如图所示, 分析工业生产中采用的温度为 650°C 左右的原因是_________ 。
②温度为 670°C 时,若在 1L 的容器中投入 8 molC3H8,充分反应后,平衡混合气体中有 2molCH4和一定量C3H8、C3H6、H2、C2H4,计算该条件下C3H6的选择性为___ %。
③欲使丙烯的产率提高,下列措施可行的是______ ( 填写序号 )
a.恒压条件下向原料气中掺杂水蒸气 b.增大氢气与丙烷的投料比 c.选择对脱氢反应更好选择性的催化剂 d.大压强
(3)科学家探索出利用无机膜催化丙烷脱氢制丙烯的新工艺,该工艺利用特定功能膜将生成的氢气从反应区一侧有选择性的及时移走,从平衡角度分析该工艺的优点______ 。
(1)丙烷催化氧化脱氢法主要反应如下:
2C3H8(g)+O2(g)
 2C3H6(g)+2H2O(g) △H1=-236kJ·mol-1(i)
2C3H6(g)+2H2O(g) △H1=-236kJ·mol-1(i)反应过程中消耗的C3H8和 生成的C3H6的物质的量随温度的变化关系见下表。
| 反应温度/℃ n(消耗)或n(生成)/mol | 535 | 550 | 575 |
| C3H8 | 6 | 13 | 33 |
| C3H6 | 4 | 8 | 17 |
①反应i中反应物的总能量
②分析表中数据得到丙烯的选择性随温度的升高而
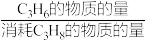 ×100%)
×100%)(2)丙烷催化直接脱氢反应: C3H8(g) ⇌C3H6(g)+ H2(g) △H2=+124. 3kJ•mol -1 ( ii ) 副反应:C3H8 (g) ⇌C2H4 (g) + CH4(g) △H3(iii)

①反应 ii 的平衡常数、产物丙烯选择性、副产物乙烯选择性与温度关系如图所示, 分析工业生产中采用的温度为 650°C 左右的原因是
②温度为 670°C 时,若在 1L 的容器中投入 8 molC3H8,充分反应后,平衡混合气体中有 2molCH4和一定量C3H8、C3H6、H2、C2H4,计算该条件下C3H6的选择性为
③欲使丙烯的产率提高,下列措施可行的是
a.恒压条件下向原料气中掺杂水蒸气 b.增大氢气与丙烷的投料比 c.选择对脱氢反应更好选择性的催化剂 d.大压强
(3)科学家探索出利用无机膜催化丙烷脱氢制丙烯的新工艺,该工艺利用特定功能膜将生成的氢气从反应区一侧有选择性的及时移走,从平衡角度分析该工艺的优点
您最近一年使用:0次
解题方法
8 . 为应对全球气候变暖,科学家在综合利用 CO2方面取得了不少研究成果。如用 CO2合成重要化工原料 CH3OH,同时生成 CO,反应如下:
反应Ⅰ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)+Q1kJ(Q1>0),
反应Ⅱ:CO2(g)+H2(g) ⇌CO(g)+H2O(g)-Q2kJ(Q2>0)。
研究催化剂等外界条件对上述反应的影响,结果如图 1、图 2
完成下列填空:
(1)一定是碳12的同位素原子是_____ (选填“A”、“B”、“C”、“D”)
A.质子数为6,中子数为8 B.质子数为8,中子数为12
C.质子数为12,中子数为6 D.质子数为12,中子数为8
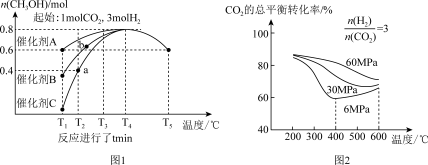
(2)分析图1:催化效果最佳的是催化剂_____ (选填“A”、“B”、“C”)。若密闭容器体积为2L,则a点测得CH3OH的平均生成速率为_____ mol·L-1·min-1。b点反应_____ (填“达到”或“未达到”)平衡状态,理由是:_____
(3)分析图2:相同温度下,增大原料气压强,反应Ⅰ平衡常数_____ (选填“增大”、“减小”、“不变”、“无法判断”);当压强为6Mpa、温度在400~600℃时,CO2的总体平衡转化率随温度升高而增大的原因是___________________________________
(4)若生成的CH3OH和CO物质的量之比为4:1,则消耗相同条件下的CO2和H2体积比是_____
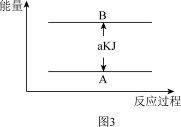
(5)若有88gCO2发生反应Ⅰ,并放出akJ热量,则图3中A为_____ ,B为_____
反应Ⅰ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)+Q1kJ(Q1>0),
反应Ⅱ:CO2(g)+H2(g) ⇌CO(g)+H2O(g)-Q2kJ(Q2>0)。
研究催化剂等外界条件对上述反应的影响,结果如图 1、图 2

完成下列填空:
(1)一定是碳12的同位素原子是
A.质子数为6,中子数为8 B.质子数为8,中子数为12
C.质子数为12,中子数为6 D.质子数为12,中子数为8
(2)分析图1:催化效果最佳的是催化剂
(3)分析图2:相同温度下,增大原料气压强,反应Ⅰ平衡常数
(4)若生成的CH3OH和CO物质的量之比为4:1,则消耗相同条件下的CO2和H2体积比是
(5)若有88gCO2发生反应Ⅰ,并放出akJ热量,则图3中A为

您最近一年使用:0次
解题方法
9 . 研究化学反应时,既要考虑物质变化与能量变化,也要关注反应的快慢与限度。回答下列问题:
I.现有反应:①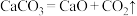 ,②
,②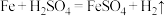 。
。
(1)两反应中属于吸热反应的是______  填序号
填序号 。
。
(2) 原电池的装置如图所示。
原电池的装置如图所示。

①溶液中 向
向______  填“铁”或“铜”
填“铁”或“铜” 电极方向移动。
电极方向移动。
②正极的现象是______ ,负极的电极反应式为______ 。
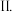 某可逆反应:
某可逆反应: 在3 种不同条件下进行,B和D的起始浓度均为0,反应物A 的浓度随反应时间的变化情况如下表:
在3 种不同条件下进行,B和D的起始浓度均为0,反应物A 的浓度随反应时间的变化情况如下表:
(3)实验1中,在 min内,以物质A表示的平均反应速率为
min内,以物质A表示的平均反应速率为______ 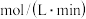 ,50min时,
,50min时,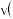 正
正
______  填“
填“ ”“
”“ ”或“
”或“ ”
”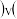 逆
逆 。
。
(4)0~20min内,实验2 比实验1的反应速率______  填“快”或“慢”
填“快”或“慢” ,其原因可能是
,其原因可能是______ 。
(5)实验3 比实验1的反应速率快,其原因是______ 。
I.现有反应:①
 ,②
,②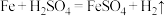 。
。(1)两反应中属于吸热反应的是
 填序号
填序号 。
。(2)
 原电池的装置如图所示。
原电池的装置如图所示。
①溶液中
 向
向 填“铁”或“铜”
填“铁”或“铜” 电极方向移动。
电极方向移动。②正极的现象是
 某可逆反应:
某可逆反应: 在3 种不同条件下进行,B和D的起始浓度均为0,反应物A 的浓度随反应时间的变化情况如下表:
在3 种不同条件下进行,B和D的起始浓度均为0,反应物A 的浓度随反应时间的变化情况如下表:| 实验序号 | 时间 浓度  温度  | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 |  | 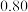 | 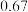 |  | 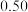 | 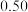 | 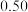 |
| 2 | 800 |  | 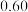 | 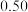 | 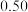 | 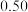 | 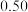 | 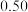 |
| 3 | 950 |  |  | 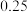 |  |  |  | 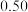 |
 min内,以物质A表示的平均反应速率为
min内,以物质A表示的平均反应速率为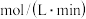 ,50min时,
,50min时,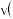 正
正
 填“
填“ ”“
”“ ”或“
”或“ ”
”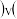 逆
逆 。
。(4)0~20min内,实验2 比实验1的反应速率
 填“快”或“慢”
填“快”或“慢” ,其原因可能是
,其原因可能是(5)实验3 比实验1的反应速率快,其原因是
您最近一年使用:0次
10 . I.NO是一种常见化合物,对其进行研究具有重要的价值和意义。
(1)2NO(g)+O2(g)=2NO2(g) △H=akJ/mol的反应历程与能量变化关系如图所示。
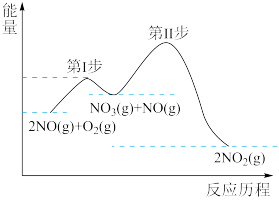
①a___ 0(填>或<)
②已知:第Ⅱ步反应为:NO3(g)+NO(g)=2NO2(g) △H=bkJ/mol
第I步反应的热化学方程式为___ 。
(2)汽车尾气中常含有NO。NH3在加热和催化剂存在的条件下能消除NO的污染。
已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=—905kJ/mol
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=—1268kJ/mol
NH3与NO反应的热化学方程式为___ 。
(3)工业上NO的重要来源是NH3,NH3也可作为燃料设计成碱性燃料电池,在碱性条件下,燃料电池产物主要为N2。燃料电池负极的电极反应式为___ 。氨气作为燃料的电池和含碳化合物作为燃料的电池相比,主要的优点是___ 。
II.含乙酸钠和对氯酚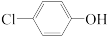 的废水可通过如下装置处理,其原理如图所示:
的废水可通过如下装置处理,其原理如图所示:
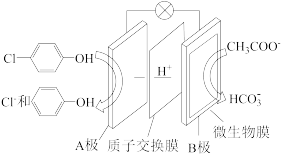
(1)写出HCO3-的电子式___ 。乙酸钠中含有的化学键类型有___ 。
(2)电池的正极是___ ,溶液中H+的移动方向是___ (填A→B或B→A)
(3)B极发生的电极反应方程式为___ 。
(1)2NO(g)+O2(g)=2NO2(g) △H=akJ/mol的反应历程与能量变化关系如图所示。

①a
②已知:第Ⅱ步反应为:NO3(g)+NO(g)=2NO2(g) △H=bkJ/mol
第I步反应的热化学方程式为
(2)汽车尾气中常含有NO。NH3在加热和催化剂存在的条件下能消除NO的污染。
已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=—905kJ/mol
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=—1268kJ/mol
NH3与NO反应的热化学方程式为
(3)工业上NO的重要来源是NH3,NH3也可作为燃料设计成碱性燃料电池,在碱性条件下,燃料电池产物主要为N2。燃料电池负极的电极反应式为
II.含乙酸钠和对氯酚
 的废水可通过如下装置处理,其原理如图所示:
的废水可通过如下装置处理,其原理如图所示:
(1)写出HCO3-的电子式
(2)电池的正极是
(3)B极发生的电极反应方程式为
您最近一年使用:0次
2019-12-31更新
|
287次组卷
|
2卷引用:华南师范大学附中2020届高三上学期第三次月考理综化学试题



