1 . Ⅰ.浓硫酸具有:①难挥发性(高沸点);②酸性;③强氧化性;④吸水性;⑤脱水性。下列各项分别表现浓硫酸的什么性质,请将序号填于空白处:
(1)蔗糖中倒入浓硫酸,蔗糖变黑,体积膨胀,且有刺激性气味的气体产生,该实验现象表明浓硫酸具有___________ 。
(2)浓硫酸使蓝色的胆矾晶体变为白色,表现的性质是___________ 。
(3)浓硫酸与FeO反应,表现的性质是___________ 。
(4)浓硫酸与食盐共热制HCl气体,表现的性质为___________ 。
Ⅱ.为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:

①上述装置中,不能用来证明“锌和稀硫酸反应是吸热反应还是放热反应”的是___________ (填序号)。
②某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡晶体与氯化铵固体搅拌反应,U形管中可观察到的现象是___________ 。
③除了图示某些装置,还有其它方法能证明超氧化钾粉末与水的反应(4KO2+2H2O=4KOH+3O2↑)是放热反应还是吸热反应:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应是___________ 反应(填“放热”或“吸热”)。
(1)蔗糖中倒入浓硫酸,蔗糖变黑,体积膨胀,且有刺激性气味的气体产生,该实验现象表明浓硫酸具有
(2)浓硫酸使蓝色的胆矾晶体变为白色,表现的性质是
(3)浓硫酸与FeO反应,表现的性质是
(4)浓硫酸与食盐共热制HCl气体,表现的性质为
Ⅱ.为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:

①上述装置中,不能用来证明“锌和稀硫酸反应是吸热反应还是放热反应”的是
②某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡晶体与氯化铵固体搅拌反应,U形管中可观察到的现象是
③除了图示某些装置,还有其它方法能证明超氧化钾粉末与水的反应(4KO2+2H2O=4KOH+3O2↑)是放热反应还是吸热反应:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应是
您最近一年使用:0次
2 . 向
 溶液中加入少量KI溶液:ⅰ.
溶液中加入少量KI溶液:ⅰ. ;ⅱ.
;ⅱ. 。
。 分解反应过程中能量变化和不同时刻测得生成
分解反应过程中能量变化和不同时刻测得生成 的体积(已折算标准状况)如下:
的体积(已折算标准状况)如下:
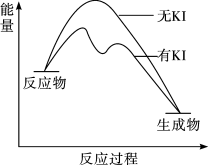
下列判断不正确 的是

 溶液中加入少量KI溶液:ⅰ.
溶液中加入少量KI溶液:ⅰ. ;ⅱ.
;ⅱ. 。
。 分解反应过程中能量变化和不同时刻测得生成
分解反应过程中能量变化和不同时刻测得生成 的体积(已折算标准状况)如下:
的体积(已折算标准状况)如下: | 0 | 5 | 10 | 15 | 20 |
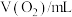 | 0.0 | 12.6 | 20.16 | 28.0 | 32.7 |

下列判断
A.从图中可以看出,KI能增大 的分解速率 的分解速率 |
| B.反应ⅰ是放热反应,反应ⅱ是吸热反应 |
C.0~10min的平均反应速率: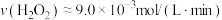 |
D. 在反应过程中既体现了氧化性,又体现了还原性 在反应过程中既体现了氧化性,又体现了还原性 |
您最近一年使用:0次
2022-04-11更新
|
354次组卷
|
14卷引用: 陕西省咸阳市武功县2021--2022学年高二上学期质量调研化学试题
陕西省咸阳市武功县2021--2022学年高二上学期质量调研化学试题【区级联考】北京市朝阳区2019届高三第一学期期末考试化学试题(已下线)2019年高考总复习巅峰冲刺-专题05 化学反应中的能量变化应试策略江西省九江市九江第一中学2019-2020高二上期期中考试化学试题江西省新余市第一中学2019-2020学年高二上学期第二次段考试化学试题北京市海淀区北京一零一中2019-2020学年高三上学期第五次统一练习化学试题北京市朝阳区陈经纶中学 2019-2020学年高二下学期期中自主检测化学试题(已下线)【南昌新东方】江西省九江第一中学2019-2020学年高二上学期期中考试化学试题北京市昌平区昌平区第一中学2020届高三下学期第三次模拟考试化学试题人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第一节 化学反应速率内蒙古通辽市开鲁县第一中学2021届高三上学期第二次阶段性考试化学试题福建省莆田第一中学2021-2022学年高二上学期期末考试化学试题北京市日坛中学2022-2023学年高二上学期期中考试化学试题陕西省洛南中学2022-2023学年高二上学期10月月考化学试题
解题方法
3 . Ⅰ.现有部分元素的性质与原子(或分子)结构如表所示:
回答下列问题:
(1)T是_______ (填元素符号)。元素X在周期表的位置_______ 。
(2)Y与Z相比,金属性较强的是_____ (填元素符号),下列表述中能证明这一事实的是_______ (填标号)。
A.Y单质的熔点比Z单质的低
B.Y的化合价比Z的低
C.Y单质与水反应比Z单质与水反应剧烈得多
(3)Z的最高价氧化物属于_______ 氧化物(“酸性”、“碱性”或“两性”),写出Y、Z最高价氧化物对应水化物反应的离子方程式____ 。
Ⅱ.2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
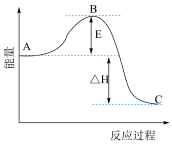
已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(4)图中A、C分别表示_______ 、_______ 。
(5)图中△H=_______ kJ·mol-1。
(6)已知单质硫的燃烧热为296KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H_______ 。
元素 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质分子为双原子分子,是空气的主要成分,分子比较稳定 |
| Y | M层比K层少一个电子 |
| Z | 有三个电子层,M层上有3个电子 |
(1)T是
(2)Y与Z相比,金属性较强的是
A.Y单质的熔点比Z单质的低
B.Y的化合价比Z的低
C.Y单质与水反应比Z单质与水反应剧烈得多
(3)Z的最高价氧化物属于
Ⅱ.2SO2(g)+O2(g)
 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(4)图中A、C分别表示
(5)图中△H=
(6)已知单质硫的燃烧热为296KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H
您最近一年使用:0次
名校
4 . 利用下列4组装置进行相应实验。其中所得结论不正确 的是


实验现象 | 结论 | |
A | 棉球变为蓝色 | 氧化性:Cl2>I2 |
B | 烧杯壁变凉 | 该反应为吸热反应 |
C | 酸性高锰酸钾溶液褪色 | 石蜡油分解产生了不同于烷烃性质的烃 |
D | 产生大量无色气泡 | 非金属性:Cl>C |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-09-20更新
|
174次组卷
|
2卷引用:四川省遂宁市射洪中学2020—2021学年高一下学期第三次月考化学试题
名校
5 . 某化学兴趣小组进行了实验:向2支试管中分别加入0.5gNa2CO3固体和0.5gNaHCO3固体,再分别加入30mL0.3mol·L-1盐酸,充分反应后,用手触摸试管,明显感觉到加Na2CO3固体的试管变热了,加NaHCO3固体的试管变冷了。甲同学由此得出结论:CO (aq)+2H+(aq)=H2O(l)+CO2(g) ΔH1<0, HCO
(aq)+2H+(aq)=H2O(l)+CO2(g) ΔH1<0, HCO (aq)+H+ (aq) =H2O(l) +CO2(g) ΔH2>0。回答下列问题:
(aq)+H+ (aq) =H2O(l) +CO2(g) ΔH2>0。回答下列问题:
(1)乙同学认为该实验不一定能得到甲同学的结论,你支持谁的观点?_______ (填“甲”或“乙”),理由是_______ 。
(2)查阅资料:
反应I :CO (aq) +2H+ (aq)=H2O(l) +CO2(g) ΔH1=-12.14kJ·mol-1;
(aq) +2H+ (aq)=H2O(l) +CO2(g) ΔH1=-12.14kJ·mol-1;
反应II :HCO (aq) +H+ (aq)=H2O(l) +CO2(g) ΔH2= +12.64 kJ·mol-1
(aq) +H+ (aq)=H2O(l) +CO2(g) ΔH2= +12.64 kJ·mol-1
①则反应III:CO (aq)+ H+ (aq)=HCO
(aq)+ H+ (aq)=HCO (aq) ΔH3=
(aq) ΔH3= _______ kJ·mol-1。
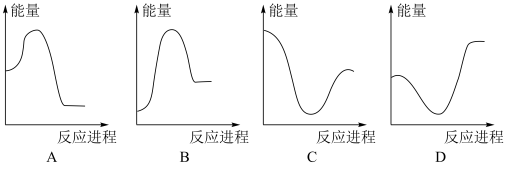
②向V mLc mol·L-1碳酸钠溶液中,逐滴加入2V mL c mol·L-1稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是_______ (填标号)。
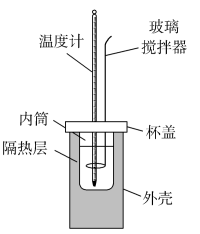
(3)该化学兴趣小组用如图所示装置设计了实验,验证碳酸钠、碳酸氢钠分别与稀盐酸反应的热效应。
表格一:
表格二:
表格三:
实验操作:将试剂1与试剂2混合,测混合后溶液的温度,静置,冷却至定温,再将试剂3与之前的混合溶液混合,再测混合溶液的温度。
①实验中玻璃搅拌器的使用方法是_______ 。
②表格二对应实验得出的结论是_______ 。
③反应IV:Na2CO3(s)+2H+(aq)=2Na+(aq)+H2O(l)+CO2(g) ΔH4;
反应V:NaHCO3(s)+H+(aq)=Na+(aq)+H2O(l)+CO2(g) ΔH5
则ΔH1_______ (填“>”、“<”或“=”,下同)ΔH4,ΔH2_______ ΔH5。
 (aq)+2H+(aq)=H2O(l)+CO2(g) ΔH1<0, HCO
(aq)+2H+(aq)=H2O(l)+CO2(g) ΔH1<0, HCO (aq)+H+ (aq) =H2O(l) +CO2(g) ΔH2>0。回答下列问题:
(aq)+H+ (aq) =H2O(l) +CO2(g) ΔH2>0。回答下列问题:(1)乙同学认为该实验不一定能得到甲同学的结论,你支持谁的观点?
(2)查阅资料:
反应I :CO
 (aq) +2H+ (aq)=H2O(l) +CO2(g) ΔH1=-12.14kJ·mol-1;
(aq) +2H+ (aq)=H2O(l) +CO2(g) ΔH1=-12.14kJ·mol-1;反应II :HCO
 (aq) +H+ (aq)=H2O(l) +CO2(g) ΔH2= +12.64 kJ·mol-1
(aq) +H+ (aq)=H2O(l) +CO2(g) ΔH2= +12.64 kJ·mol-1①则反应III:CO
 (aq)+ H+ (aq)=HCO
(aq)+ H+ (aq)=HCO (aq) ΔH3=
(aq) ΔH3= ②向V mLc mol·L-1碳酸钠溶液中,逐滴加入2V mL c mol·L-1稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是

(3)该化学兴趣小组用如图所示装置设计了实验,验证碳酸钠、碳酸氢钠分别与稀盐酸反应的热效应。

表格一:
| 试剂1 | 试剂2混合前温度/°C | 混合后温度/°C |
| 0.5 g Na2CO3 | 40mL HCl 19.0 | 21.7 |
| 0.5 g NaHCO3 | 40 mL HCl 19.0 | 18.1 |
| 试剂1 | 试剂2混合前温度/°C | 溶解后温度/°C | 静置后的温度/°C | 试剂3混合前温度/°C | 混合后温度/°C |
| 0.5gNa2CO3 | 10mLH2O19.0 | 22.3 | 19.0 | 10mLH2O19.0 | 19.0 |
| 0.5gNaHCO3 | 10mLH2O19.0 | 17.5 | 19.0 | 10mLH2O19.0 | 19.0 |
| 试剂1 | 试剂2混合前温度/°C | 溶解后温度/°C | 静置后的温度/°C | 试剂3混合前温度/°C | 混合后温度/°C |
| 0.5gNa2CO3 | 10mLH2O19.0 | 22.3 | 19.0 | 10mLHCl19.0 | 20.5 |
| 0.5gNaHCO3 | 10mLH2O19.0 | 17.5 | 19.0 | 10mLHCl19.0 | 18.3 |
①实验中玻璃搅拌器的使用方法是
②表格二对应实验得出的结论是
③反应IV:Na2CO3(s)+2H+(aq)=2Na+(aq)+H2O(l)+CO2(g) ΔH4;
反应V:NaHCO3(s)+H+(aq)=Na+(aq)+H2O(l)+CO2(g) ΔH5
则ΔH1
您最近一年使用:0次
2021-11-12更新
|
225次组卷
|
6卷引用:河北省邯郸市八校联盟(永年一中、大化一中等)2021-2022学年高二上学期期中考试化学试题
6 . 某化学兴趣小组进行了实验:向2支试管中分别加入0.5 g Na2CO3固体和0.5 gNaHCO3固体,再分别加入30 mL 0.3 mol·L-1盐酸,充分反应后,用手触摸试管,明显感觉到加Na2CO3固体的试管变热了,加NaHCO3固体的试管变冷了。甲同学由此得出结论:CO (aq) +2H+ (aq)=H2O(1) +CO2(g)△H1<0, HCO
(aq) +2H+ (aq)=H2O(1) +CO2(g)△H1<0, HCO (aq)+H+ (aq)=H2O(1) +CO2(g) △H2>0。回答下列问题:
(aq)+H+ (aq)=H2O(1) +CO2(g) △H2>0。回答下列问题:
(1)乙同学认为该实验不一定能得到甲同学的结论,你支持谁的观点?_____ (填“甲”或“乙”) ,理由是_______ 。
(2)查阅资料:
反应I :CO (aq) +2H+ (aq)=H2O(l) +CO2(g) △H1= -12.14kJ· mol-1;
(aq) +2H+ (aq)=H2O(l) +CO2(g) △H1= -12.14kJ· mol-1;
反应II :HCO (aq) +H+ (aq)=H2O(l) +CO2(g) △H2= +12.64 kJ·mol-1。
(aq) +H+ (aq)=H2O(l) +CO2(g) △H2= +12.64 kJ·mol-1。
向V mLc mol· L-1碳酸钠溶液中,逐滴加入2V mLc mol·L-1稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是 (填标号)。
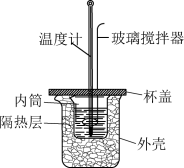
(3)该化学兴趣小组用如图所示装置设计了实验,验证碳酸钠、碳酸氢钠分别与稀盐酸反应的热效应。
表格一:
表格二:
表格三:
实验操作:将试剂1与试剂2混合,测混合后溶液的温度,静置,冷却至定温,再将试剂3与之前的混合溶液混合,再测混合溶液的温度。
①实验中玻璃搅拌器的使用方法是_______________ 。
②表格二对应实验得出的结论是________________ 。
③反应III:Na2CO3(s) +2H+ (aq)=2Na+ (aq) +H2O(1) +CO2(g) △H3;
反应IV:NaHCO3(s)+ H+ (aq)=Na+ (aq) + H2O(l) +CO2(g) △H4。
则△H1______ (填“>”、“< ”或“=”,下同) △H3,△H2______ △H4。
 (aq) +2H+ (aq)=H2O(1) +CO2(g)△H1<0, HCO
(aq) +2H+ (aq)=H2O(1) +CO2(g)△H1<0, HCO (aq)+H+ (aq)=H2O(1) +CO2(g) △H2>0。回答下列问题:
(aq)+H+ (aq)=H2O(1) +CO2(g) △H2>0。回答下列问题:(1)乙同学认为该实验不一定能得到甲同学的结论,你支持谁的观点?
(2)查阅资料:
反应I :CO
 (aq) +2H+ (aq)=H2O(l) +CO2(g) △H1= -12.14kJ· mol-1;
(aq) +2H+ (aq)=H2O(l) +CO2(g) △H1= -12.14kJ· mol-1;反应II :HCO
 (aq) +H+ (aq)=H2O(l) +CO2(g) △H2= +12.64 kJ·mol-1。
(aq) +H+ (aq)=H2O(l) +CO2(g) △H2= +12.64 kJ·mol-1。向V mLc mol· L-1碳酸钠溶液中,逐滴加入2V mLc mol·L-1稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是 (填标号)。
A.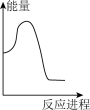 | B.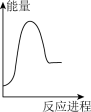 | C.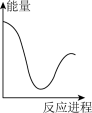 | D.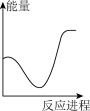 |

表格一:
试剂1 | 试剂2混合前温度/℃ | 混合后温度/℃ |
0.5 g Na2CO3 | 40mL HCl 19.0 | 21.7 |
0.5 g NaHCO3 | 40 mL HCl 19.0 | 18.1 |
表格二:
试剂1 | 试剂2混合 前温度/℃ | 溶解后温 度/℃ | 静置后的 温度/℃ | 试剂3混合 前温度/℃ | 混合后 温度/℃ |
0.5 g Na2CO3 | 10 mL H2O19.0 | 22. 3 | 19.0 | 10mL H2O 19.0 | 19.0 |
0.5 g NaHCO3 | 10 mL H2O19.0 | 17.5 | 19.0 | 10 mL H2O 19.0 | 19.0 |
表格三:
试剂1 | 试剂2混合 前温度/℃ | 溶解后温 度/℃ | 静置后的 温度/℃ | 试剂3混合 前温度/℃ | 混合后 温度/℃ |
0.5 g Na2CO3 | 10 mL H2O19.0 | 22.3 | 19.0 | 10mL HCl 19.0 | 20.5 |
0.5 g NaHCO3 | 10 mL H2O19.0 | 17.5 | 19.0 | 10 mL HCl19.0 | 18.3 |
实验操作:将试剂1与试剂2混合,测混合后溶液的温度,静置,冷却至定温,再将试剂3与之前的混合溶液混合,再测混合溶液的温度。
①实验中玻璃搅拌器的使用方法是
②表格二对应实验得出的结论是
③反应III:Na2CO3(s) +2H+ (aq)=2Na+ (aq) +H2O(1) +CO2(g) △H3;
反应IV:NaHCO3(s)+ H+ (aq)=Na+ (aq) + H2O(l) +CO2(g) △H4。
则△H1
您最近一年使用:0次
7 . 化学反应中伴随着能量变化,探究各种能量变化是一永恒的主题。
(1)下列变化属于放热反应的是___________ 。 填序号
填序号
 生石灰溶于水
生石灰溶于水  浓硫酸稀释
浓硫酸稀释  氢氧化钠固体溶于水
氢氧化钠固体溶于水  铜溶于浓硝酸
铜溶于浓硝酸  氯化铵固体与氢氧化钡晶体混合搅拌
氯化铵固体与氢氧化钡晶体混合搅拌  过氧化钠溶于水
过氧化钠溶于水
(2) 分解时的能量变化关系如下图甲所示,则
分解时的能量变化关系如下图甲所示,则 分解反应为
分解反应为 ___________ 反应 选填:吸热、放热
选填:吸热、放热 。查阅资料得知:将作为催化剂的
。查阅资料得知:将作为催化剂的 溶液加入
溶液加入 溶液后,溶液中会发生两个氧化还原反应,且两个反应中
溶液后,溶液中会发生两个氧化还原反应,且两个反应中 均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的离子方程式分别是:
均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的离子方程式分别是: 和
和 ___________ 。
(3)如下图乙是某化学兴趣小组探究不同条件下化学能转变为电能的装置。
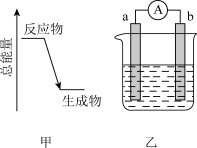
①当电极a为镁,电极b为铝,电解质溶液为氢氧化钠溶液时,该电池的负极为___________ 。 填名称
填名称
②燃料电池的工作原理是将燃料和氧化剂 反应所产生的化学能直接转化为电能。现设计一燃料电池,电极a通入氢气燃料,采用氢氧化钠溶液为电解液,b极的电极反应式为
反应所产生的化学能直接转化为电能。现设计一燃料电池,电极a通入氢气燃料,采用氢氧化钠溶液为电解液,b极的电极反应式为 ___________ 。
③质量相同的铜棒和铁棒用导线连接后插入 溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12g,则导线中通过的电子的物质的量为
溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12g,则导线中通过的电子的物质的量为 ___________ 。
(1)下列变化属于放热反应的是
 填序号
填序号
 生石灰溶于水
生石灰溶于水  浓硫酸稀释
浓硫酸稀释  氢氧化钠固体溶于水
氢氧化钠固体溶于水  铜溶于浓硝酸
铜溶于浓硝酸  氯化铵固体与氢氧化钡晶体混合搅拌
氯化铵固体与氢氧化钡晶体混合搅拌  过氧化钠溶于水
过氧化钠溶于水(2)
 分解时的能量变化关系如下图甲所示,则
分解时的能量变化关系如下图甲所示,则 分解反应为
分解反应为  选填:吸热、放热
选填:吸热、放热 。查阅资料得知:将作为催化剂的
。查阅资料得知:将作为催化剂的 溶液加入
溶液加入 溶液后,溶液中会发生两个氧化还原反应,且两个反应中
溶液后,溶液中会发生两个氧化还原反应,且两个反应中 均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的离子方程式分别是:
均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的离子方程式分别是: 和
和 (3)如下图乙是某化学兴趣小组探究不同条件下化学能转变为电能的装置。

①当电极a为镁,电极b为铝,电解质溶液为氢氧化钠溶液时,该电池的负极为
 填名称
填名称
②燃料电池的工作原理是将燃料和氧化剂
 反应所产生的化学能直接转化为电能。现设计一燃料电池,电极a通入氢气燃料,采用氢氧化钠溶液为电解液,b极的电极反应式为
反应所产生的化学能直接转化为电能。现设计一燃料电池,电极a通入氢气燃料,采用氢氧化钠溶液为电解液,b极的电极反应式为 ③质量相同的铜棒和铁棒用导线连接后插入
 溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12g,则导线中通过的电子的物质的量为
溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12g,则导线中通过的电子的物质的量为
您最近一年使用:0次
解题方法
8 . 化学物质在汽车的动力、安全等方面有着极为重要的作用。
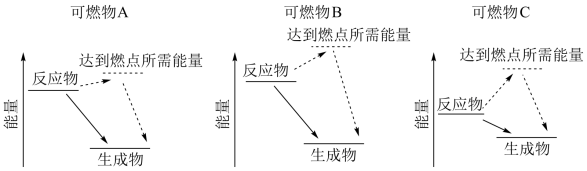
(1)某同学根据所查阅的资料,绘制了三种可燃物在空气中发生燃烧反应的能量变化示意图。根据示意图,你认为可燃物_______ (填“A”、“B”或“C”)更适合用作车用燃料。(已知:燃点是指在规定的条件下,应用外部热源使物质表面起火并持续燃烧一定时间所需的最低温度,燃点较低时存在安全隐患。)
(2)汽车尾气中含有 、
、 等污染物。其中
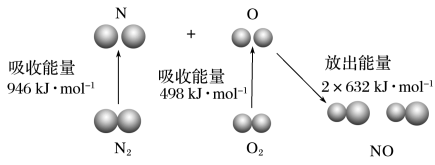
等污染物。其中 生成过程的能量变化如图,由该图数据计算可得,该反应为
生成过程的能量变化如图,由该图数据计算可得,该反应为_______ (填“吸热”或“放热”)反应。
(3)通过 传感器可监测汽车尾气中
传感器可监测汽车尾气中 的含量,其工作原理如图所示:
的含量,其工作原理如图所示:
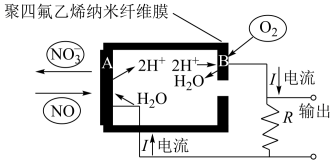
①A电极发生的是_______ 反应(填“氧化”或“还原”)。
②B电极反应为_______ 。
(4)电动汽车普遍使用锂离子电池。某锂离子电池反应为 。
。
①当有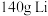 消耗时,电路中转移电子数目为
消耗时,电路中转移电子数目为_______ 。
②根据①的计算思路,分析 做电极优于
做电极优于 的原因是
的原因是_______ 。
(5)安全性是汽车发展需要解决的重要问题。汽车受到强烈撞击时,预置在安全气囊内的化学药剂发生反应产生大量气体,气囊迅速弹出。某种产气药剂主要含有 、
、 、
、 、
、 ,已知
,已知 在猛烈撞击时分解产生两种单质,并放出大量的热。
在猛烈撞击时分解产生两种单质,并放出大量的热。
①药剂中 做冷却剂原因是
做冷却剂原因是_______ 。
②根据产气药剂的组成,在设计气囊中所运用的化学反应时,需要考虑的角度有_______ (填标号)。
A.固体反应物的颜色 B.气体产物的毒性 C.反应的快慢 D.反应的能量变化
(1)某同学根据所查阅的资料,绘制了三种可燃物在空气中发生燃烧反应的能量变化示意图。根据示意图,你认为可燃物

(2)汽车尾气中含有
 、
、 等污染物。其中
等污染物。其中 生成过程的能量变化如图,由该图数据计算可得,该反应为
生成过程的能量变化如图,由该图数据计算可得,该反应为
(3)通过
 传感器可监测汽车尾气中
传感器可监测汽车尾气中 的含量,其工作原理如图所示:
的含量,其工作原理如图所示:
①A电极发生的是
②B电极反应为
(4)电动汽车普遍使用锂离子电池。某锂离子电池反应为
 。
。①当有
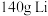 消耗时,电路中转移电子数目为
消耗时,电路中转移电子数目为②根据①的计算思路,分析
 做电极优于
做电极优于 的原因是
的原因是(5)安全性是汽车发展需要解决的重要问题。汽车受到强烈撞击时,预置在安全气囊内的化学药剂发生反应产生大量气体,气囊迅速弹出。某种产气药剂主要含有
 、
、 、
、 、
、 ,已知
,已知 在猛烈撞击时分解产生两种单质,并放出大量的热。
在猛烈撞击时分解产生两种单质,并放出大量的热。①药剂中
 做冷却剂原因是
做冷却剂原因是②根据产气药剂的组成,在设计气囊中所运用的化学反应时,需要考虑的角度有
A.固体反应物的颜色 B.气体产物的毒性 C.反应的快慢 D.反应的能量变化
您最近一年使用:0次
名校
解题方法
9 . 化学反应中伴随着能量变化,探究各种能量变化是一永恒的主题。
(1)下列变化属于放热反应的是___________ (填序号)。
a.生石灰溶于水 b.浓硫酸稀释 c.碳酸氢钠固体溶于盐酸
d.铜溶于浓硝酸 e.氯化铵固体与氢氧化钡晶体混合搅拌 f.过氧化钠溶于水
(2)H2O2分解时的能量变化关系如图所示,则H2O2分解反应为___________ 反应 (选填:吸热、放热)。
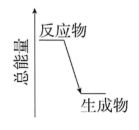
查阅资料得知:将作为催化剂的Fe2(SO4)3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的离子方程式分别是:2Fe3++H2O2=2Fe2++O2↑+2H+和___________ 。
(3)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置:
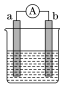
①当电极a为镁,电极b为铝,电解质溶液为氢氧化钠溶液时,该电池的负极为___________ (填名称)。
②燃料电池的工作原理是将燃料和氧化剂(O2)反应所产生的化学能直接转化为电能。现设计一燃料电池,电极a通入氢气燃料,采用氢氧化钠溶液为电解液,b极的电极反应式为___________ 。
③质量相同的铜棒和铁棒用导线连接后插入CuSO4溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12 g,则导线中通过的电子的数目为___________ 。
(1)下列变化属于放热反应的是
a.生石灰溶于水 b.浓硫酸稀释 c.碳酸氢钠固体溶于盐酸
d.铜溶于浓硝酸 e.氯化铵固体与氢氧化钡晶体混合搅拌 f.过氧化钠溶于水
(2)H2O2分解时的能量变化关系如图所示,则H2O2分解反应为

查阅资料得知:将作为催化剂的Fe2(SO4)3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的离子方程式分别是:2Fe3++H2O2=2Fe2++O2↑+2H+和
(3)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置:

①当电极a为镁,电极b为铝,电解质溶液为氢氧化钠溶液时,该电池的负极为
②燃料电池的工作原理是将燃料和氧化剂(O2)反应所产生的化学能直接转化为电能。现设计一燃料电池,电极a通入氢气燃料,采用氢氧化钠溶液为电解液,b极的电极反应式为
③质量相同的铜棒和铁棒用导线连接后插入CuSO4溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12 g,则导线中通过的电子的数目为
您最近一年使用:0次
2021-05-11更新
|
269次组卷
|
2卷引用:山东省济宁市任城区2020-2021学年高一下学期期中考试化学试题
10 . 下列说法不正确 的是
| A.自嗨锅的发热包主要成分是生石灰,其与水反应放热从而使食材加热 |
| B.抗坏血酸(即维生素C)是水果罐头中常用的抗氧化剂,是因为其具有较强的氧化性 |
| C.在食品包装袋内放入铁系保鲜剂可以防止食品因氧化而变质 |
| D.臭氧是饮用水的理想消毒剂之一,因为它杀菌能力强且不影响水质 |
您最近一年使用:0次
2022-03-09更新
|
206次组卷
|
2卷引用:四川省南充高级中学2021-2022学年高二上学期入学考试化学试题



