名校
解题方法
1 . 生产生活中的化学反应都伴随能量的变化,请回答下列问题。
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途,制作冷敷袋可以利用___________ (填“放热”或“吸热”)的化学变化或物理变化。
(2)天然气中含有的微量 会腐蚀管道和设备,在
会腐蚀管道和设备,在 下进行脱硫处理,
下进行脱硫处理, 会被氧气氧化为
会被氧气氧化为 ,并产生水蒸气。
,并产生水蒸气。
写出该反应的热化学方程式:___________
(3)汽车尾气中排放的 和
和 会污染环境,在汽车尾气系统中装置催化转化器,可有效降低
会污染环境,在汽车尾气系统中装置催化转化器,可有效降低 和
和 的排放。已知:
的排放。已知:
Ⅰ.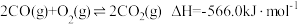
Ⅱ.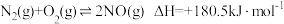
Ⅲ.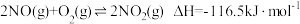
① 的燃烧热为
的燃烧热为___________  。
。
② 将
将 还原为单质的热化学方程式为
还原为单质的热化学方程式为___________ 。
③下图是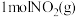 和
和 反应生成
反应生成 和
和 过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,
过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大, 的变化是
的变化是___________ (填“增大”、“减小”或“不变”,下同), 的变化是
的变化是___________ 。


(4)实验室利用如上图装置进行中和热的测定。
①图中还缺少一个玻璃仪器,名称为___________ 。
②在操作正确的前提下,提高中和热测定准确性的关键是___________ 。
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途,制作冷敷袋可以利用
(2)天然气中含有的微量
 会腐蚀管道和设备,在
会腐蚀管道和设备,在 下进行脱硫处理,
下进行脱硫处理, 会被氧气氧化为
会被氧气氧化为 ,并产生水蒸气。
,并产生水蒸气。| 化学键 | 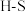 | 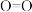 | 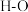 |  中共价键 中共价键 |
键能/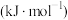 | 339 | 498 | 464 | 1083 |
写出该反应的热化学方程式:
(3)汽车尾气中排放的
 和
和 会污染环境,在汽车尾气系统中装置催化转化器,可有效降低
会污染环境,在汽车尾气系统中装置催化转化器,可有效降低 和
和 的排放。已知:
的排放。已知:Ⅰ.
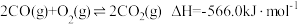
Ⅱ.
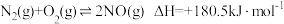
Ⅲ.
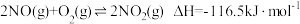
①
 的燃烧热为
的燃烧热为 。
。②
 将
将 还原为单质的热化学方程式为
还原为单质的热化学方程式为③下图是
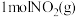 和
和 反应生成
反应生成 和
和 过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,
过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大, 的变化是
的变化是 的变化是
的变化是

(4)实验室利用如上图装置进行中和热的测定。
①图中还缺少一个玻璃仪器,名称为
②在操作正确的前提下,提高中和热测定准确性的关键是
您最近一年使用:0次
名校
解题方法
2 . 生产生活中的化学反应都伴随着能量的变化,请根据有关知识回答下列问题:
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋可以利用___________ (填“放热”或“吸热”)的化学变化或物理变化。
(2)“即热饭盒”给人们生活带来方便,它可利用下面___________ (填字母)反应释放的热量加热食物。
A.生石灰和水 B.浓硫酸和水
(3)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料: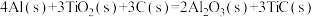
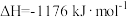 ,则反应过程中,每转移1mol电子放出的热量为
,则反应过程中,每转移1mol电子放出的热量为___________ 。
(4)肼可作为火箭发动机的燃料,与氧化剂 反应生成N2和水蒸气。
反应生成N2和水蒸气。
已知:①
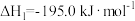
②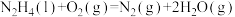
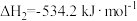
③
 ?
?
根据①与②的数据,计算 =
=___________ 。
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋可以利用
(2)“即热饭盒”给人们生活带来方便,它可利用下面
A.生石灰和水 B.浓硫酸和水
(3)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料:
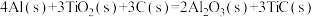
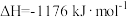 ,则反应过程中,每转移1mol电子放出的热量为
,则反应过程中,每转移1mol电子放出的热量为(4)肼可作为火箭发动机的燃料,与氧化剂
 反应生成N2和水蒸气。
反应生成N2和水蒸气。已知:①

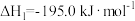
②
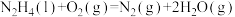
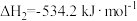
③

 ?
?根据①与②的数据,计算
 =
=
您最近一年使用:0次
3 . 现代社会生活离不开能量。
(1)I.冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋可以利用____ (填“放热”或“吸热”)的化学变化或物理变化。
(2)“即热饭盒”给人们生活带来方便,它可利用下面____ (填序号)反应释放的热量加热食物。
A.生石灰和水 B. 和
和 C.硝酸铵和水
C.硝酸铵和水
II.某实验小组为了探究化学能与热能的转化,设计了如图所示的三套实验装置。
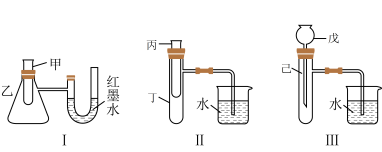
(3)某同学选用装置I进行实验(实验前U形管里液面左右相平),在甲试管中加入适量了 溶液与稀硫酸,U形管中可观察到的现象是
溶液与稀硫酸,U形管中可观察到的现象是___________ 。
(4)为探究固体M溶于水的热效应,选择装置II进行实验(反应在丙试管中进行)。
①若观察到烧杯中产生气泡,则说明M溶于水___________ (填“一定是放热反应”、“一定是吸热反应”或“可能是放热反应”)。
②若只观察到烧杯中的导管内形成一段水柱,则M可能为___________ 。
(5)上述3个装置中,能验证“铜与浓硝酸的反应是吸热反应还是放热反应”的装置是___________ (填装置序号)
(1)I.冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋可以利用
(2)“即热饭盒”给人们生活带来方便,它可利用下面
A.生石灰和水 B.
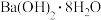 和
和 C.硝酸铵和水
C.硝酸铵和水II.某实验小组为了探究化学能与热能的转化,设计了如图所示的三套实验装置。

(3)某同学选用装置I进行实验(实验前U形管里液面左右相平),在甲试管中加入适量了
 溶液与稀硫酸,U形管中可观察到的现象是
溶液与稀硫酸,U形管中可观察到的现象是(4)为探究固体M溶于水的热效应,选择装置II进行实验(反应在丙试管中进行)。
①若观察到烧杯中产生气泡,则说明M溶于水
②若只观察到烧杯中的导管内形成一段水柱,则M可能为
(5)上述3个装置中,能验证“铜与浓硝酸的反应是吸热反应还是放热反应”的装置是
您最近一年使用:0次
4 . 冷敷袋俗称冰袋,在日常生活中有降温、保鲜和镇痛等多种用途。
(1)制作冷敷袋可以利用___________。
(2)以下是三种常见冷敷袋所盛装的主要物质,请从(1)的选项中找出其对应的主要工作原理。
①冰___________
②硝酸铵+水___________
③硝酸铵+水合碳酸钠___________
(3)请写出十水合碳酸钠( )与硝酸铵在一定条件下反应的化学方程式
)与硝酸铵在一定条件下反应的化学方程式___________ ,并从反应物、生成物总能量高低的角度解释该反应有能量变化的原因___________ 。(提示:该反应产生了两种气体。)
(4)请从使用的便捷性、安全性等角度比较上述三种冷敷袋,并与同学讨论___________ 。
(1)制作冷敷袋可以利用___________。
| A.放热的化学变化 | B.吸热的化学变化 | C.放热的物理变化 | D.吸热的物理变化 |
①冰
②硝酸铵+水
③硝酸铵+水合碳酸钠
(3)请写出十水合碳酸钠(
 )与硝酸铵在一定条件下反应的化学方程式
)与硝酸铵在一定条件下反应的化学方程式(4)请从使用的便捷性、安全性等角度比较上述三种冷敷袋,并与同学讨论
您最近一年使用:0次
名校
5 . 生产生活中的化学反应都伴随着能量的变化,请根据有关知识回答下列问题:
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋可以利用_______ (填“放热”或“吸热”)的化学变化或物理变化。
(2)“即热饭盒”给人们生活带来方便,它可利用下面_______ (填字母)反应释放的热量加热食物。
A.生石灰和水 B.浓硫酸和水
(3)已知:2mol 与足量
与足量 充分燃烧生成液态水时放出572kJ热量。
充分燃烧生成液态水时放出572kJ热量。
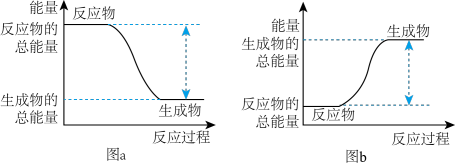
①该反应的能量变化可用图中的_______ (填字母)表示。

②写出 燃烧生成液态水的热化学反应方程式:
燃烧生成液态水的热化学反应方程式:_______ 。
(4)表中是部分共价键的键能。
根据表中的数据写出工业合成氨的热化学反应方程式:_______ 。
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋可以利用
(2)“即热饭盒”给人们生活带来方便,它可利用下面
A.生石灰和水 B.浓硫酸和水
(3)已知:2mol
 与足量
与足量 充分燃烧生成液态水时放出572kJ热量。
充分燃烧生成液态水时放出572kJ热量。①该反应的能量变化可用图中的

②写出
 燃烧生成液态水的热化学反应方程式:
燃烧生成液态水的热化学反应方程式:(4)表中是部分共价键的键能。
| 共价键 |  |  |  |
键能( ) ) | 436 | 946 | 391 |
您最近一年使用:0次
2021-09-08更新
|
896次组卷
|
5卷引用:广西崇左市高级中学2021-2022学年高二上学期开学考试化学试题
广西崇左市高级中学2021-2022学年高二上学期开学考试化学试题安徽省合肥新城高升学校2021-2022学年高二上学期第一次月考化学试题(已下线)第04讲 第一章《化学反应的热效应》单元测试(基础巩固)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)广东省深圳市观澜中学2022-2023学年高二上学期期中考试化学试题黑龙江省哈尔滨市宾县第二中学2022-2023学年高一下学期第一次月考化学试题
名校
解题方法
6 .  是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
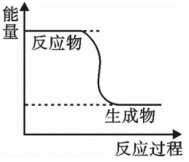
Ⅰ.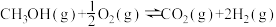 的能量变化如图所示。
的能量变化如图所示。
(1)下列说法错误的是___________(填字母)。
Ⅱ. 燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、
燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、 (电解质溶液)构成,其中负极反应式为
(电解质溶液)构成,其中负极反应式为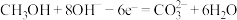 .
.
(2)下列说法正确的是___________ (填序号)。
①电池放电时通入空气的电极为正极
②电池放电时,电解质溶液的碱性逐渐增强
③电池放电时每消耗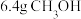 转移1.2
转移1.2 电子
电子
Ⅲ.将 转化成甲醇可有效实现碳循环。在容积为2L的恒温恒容密闭容器中,充入
转化成甲醇可有效实现碳循环。在容积为2L的恒温恒容密闭容器中,充入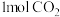 和
和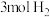 ,一定条件下发生反应:
,一定条件下发生反应: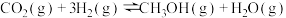
该反应一般认为通过如下分步反应来实现:
①
②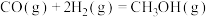
上述反应的能量变化如图所示。
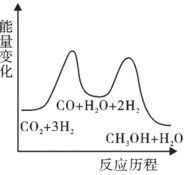
(3)则上述分步反应②为___________ (填吸热或放热)反应。
(4)测得 和
和 的物质的量随时间的变化情况如下表。
的物质的量随时间的变化情况如下表。
①a=___________ ;3~6 内,
内,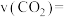
___________  。
。
②能说明上述反应达到平衡状态的是___________ (填标号)。
A.混合气体的压强不随时间的变化而变化
B.反应中 与
与 的物质的量浓度之比为1:1
的物质的量浓度之比为1:1
C.单位时间内生成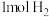 ,同时生成
,同时生成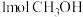
D.混合气体的平均相对分子质量不随时间的变化而变化
③上述反应12 末时,混合气体中
末时,混合气体中 和
和 的物质的量之比是
的物质的量之比是___________ , 的体积分数是
的体积分数是___________ 。
④第3 时
时
___________ (填“>”、“<”、“=”或“无法比较”)第9 时
时 。
。
 是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。Ⅰ.
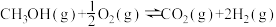 的能量变化如图所示。
的能量变化如图所示。(1)下列说法错误的是___________(填字母)。

A. 转变成 转变成 的过程是一个吸收能量的过程 的过程是一个吸收能量的过程 |
B. 的生成速率与 的生成速率与 的消耗速率之比为1:2 的消耗速率之比为1:2 |
| C.化学变化不仅有新物质生成,同时也伴随着能量变化 |
D.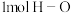 键断裂的同时有 键断裂的同时有 键断裂,则反应达到平衡状态 键断裂,则反应达到平衡状态 |
Ⅱ.
 燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、
燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、 (电解质溶液)构成,其中负极反应式为
(电解质溶液)构成,其中负极反应式为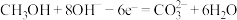 .
.(2)下列说法正确的是
①电池放电时通入空气的电极为正极
②电池放电时,电解质溶液的碱性逐渐增强
③电池放电时每消耗
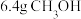 转移1.2
转移1.2 电子
电子Ⅲ.将
 转化成甲醇可有效实现碳循环。在容积为2L的恒温恒容密闭容器中,充入
转化成甲醇可有效实现碳循环。在容积为2L的恒温恒容密闭容器中,充入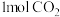 和
和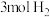 ,一定条件下发生反应:
,一定条件下发生反应: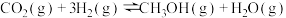
该反应一般认为通过如下分步反应来实现:
①

②
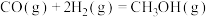
上述反应的能量变化如图所示。

(3)则上述分步反应②为
(4)测得
 和
和 的物质的量随时间的变化情况如下表。
的物质的量随时间的变化情况如下表。| 时间 | 0 | 3 | 6 | 9 | 12 |
 | 0 | 0.50 | 0.65 | 0.74 | 0.74 |
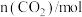 | 1 | 0.50 | a | 0.26 | 0.26 |
①a=
 内,
内,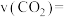
 。
。②能说明上述反应达到平衡状态的是
A.混合气体的压强不随时间的变化而变化
B.反应中
 与
与 的物质的量浓度之比为1:1
的物质的量浓度之比为1:1C.单位时间内生成
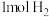 ,同时生成
,同时生成
D.混合气体的平均相对分子质量不随时间的变化而变化
③上述反应12
 末时,混合气体中
末时,混合气体中 和
和 的物质的量之比是
的物质的量之比是 的体积分数是
的体积分数是④第3
 时
时
 时
时 。
。
您最近一年使用:0次
2021-08-17更新
|
244次组卷
|
2卷引用:四川省内江市2020-2021学年高一下学期期末检测题化学(理)试题
名校
解题方法
7 . 生产生活中的化学反应都伴随着能量的变化,请根据有关知识回答下列问题:
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋可以利用______ (填“放热”或“吸热”)的化学变化或物理变化。
(2)“即热饭盒”给人们生活带来方便,它可利用下面______ (填字母)反应释放的热量加热食物。
A.生石灰和水 B.浓硫酸和水 C.钠和水
(3)已知:2molH2与足量O2充分燃烧生成液态水时放出572kJ热量。
①该反应的能量变化可用图中的_______ (填字母)表示。
②写出 燃烧生成液态水的热化学反应方程式:
燃烧生成液态水的热化学反应方程式:_______ 。
(4)表中是部分共价键的键能。
根据表中的数据写出工业合成氨的热化学反应方程式:_______ 。
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋可以利用
(2)“即热饭盒”给人们生活带来方便,它可利用下面
A.生石灰和水 B.浓硫酸和水 C.钠和水
(3)已知:2molH2与足量O2充分燃烧生成液态水时放出572kJ热量。
①该反应的能量变化可用图中的

②写出
 燃烧生成液态水的热化学反应方程式:
燃烧生成液态水的热化学反应方程式:(4)表中是部分共价键的键能。
共价键 |
|
|
|
键能(kJ/mol) | 436 | 946 | 391 |
您最近一年使用:0次
解题方法
8 . Ⅰ.(1)下列变化中,属于吸热反应的是_______ 。
①液态水汽化 ②Ba(OH)2•8H2O与固体NH4Cl混合 ③浓H2SO4稀释 ④高锰酸钾分解制O2 ⑤生石灰跟水反应生成熟石灰 ⑥将胆矾加热变为白色粉末 ⑦CO2+C 2CO ⑧CaCO3高温分解 ⑨N2+3H2
2CO ⑧CaCO3高温分解 ⑨N2+3H2  2NH3 ⑩C+H2O(g)
2NH3 ⑩C+H2O(g) CO+H2
CO+H2
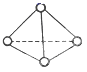
(2)如图所示,N4分子结构与白磷分子相似,呈正四面体结构。已知断裂1 mol N—N键吸收193 kJ热量,断裂1 mol N≡N键吸收941 kJ热量,则1 mol N4气体转化为N2时要_______ 填“吸收”或“放出”)热量_______ kJ。
Ⅱ.原电池是化学对人类的一项重大贡献。
(3)通过电化学循环法可将H2S转化为H2SO4和H2(如图所示)。其中氧化过程发生如下两步反应:H2S+H2SO4=SO2↑+S↓+2H2O、S+O2=SO2。
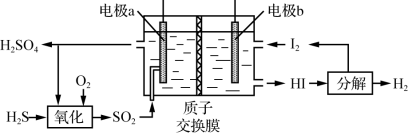
电极a上发生反应的电极反应式为_______ 。
(4)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,负极电极反应式为_______ 。
(5)一次电池碱性锌锰电池在生活中用途广泛,已知该电池的总反应为:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,写出该电池正极电极反应式_______ 。
(6)甲醇(CH3OH)是一种重要的化工原料和新型燃料。写出用氢氧化钾溶液作电解质时该甲醇燃料电池的负极电极反应式:_______ 。
①液态水汽化 ②Ba(OH)2•8H2O与固体NH4Cl混合 ③浓H2SO4稀释 ④高锰酸钾分解制O2 ⑤生石灰跟水反应生成熟石灰 ⑥将胆矾加热变为白色粉末 ⑦CO2+C
 2CO ⑧CaCO3高温分解 ⑨N2+3H2
2CO ⑧CaCO3高温分解 ⑨N2+3H2  2NH3 ⑩C+H2O(g)
2NH3 ⑩C+H2O(g) CO+H2
CO+H2(2)如图所示,N4分子结构与白磷分子相似,呈正四面体结构。已知断裂1 mol N—N键吸收193 kJ热量,断裂1 mol N≡N键吸收941 kJ热量,则1 mol N4气体转化为N2时要

Ⅱ.原电池是化学对人类的一项重大贡献。
(3)通过电化学循环法可将H2S转化为H2SO4和H2(如图所示)。其中氧化过程发生如下两步反应:H2S+H2SO4=SO2↑+S↓+2H2O、S+O2=SO2。

电极a上发生反应的电极反应式为
(4)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,负极电极反应式为
(5)一次电池碱性锌锰电池在生活中用途广泛,已知该电池的总反应为:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,写出该电池正极电极反应式
(6)甲醇(CH3OH)是一种重要的化工原料和新型燃料。写出用氢氧化钾溶液作电解质时该甲醇燃料电池的负极电极反应式:
您最近一年使用:0次
名校
解题方法
9 . 现代社会生活离不开能量。
I.(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋可以利用_______ (填“放热”或“吸热”)的化学变化或物理变化。
(2)“即热饭盒”给人们生活带来方便,它可利用下面_______ (填序号)反应释放的热量加热食物。
A.生石灰和水B.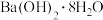 和
和 C.硝酸铵和水
C.硝酸铵和水
II.某实验小组为了探究化学能与热能的转化,设计了如图所示的三套实验装置。
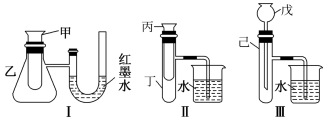
(1)某同学选用装置I进行实验(实验前U形管里液面左右相平),在甲试管中加入适量了 溶液与稀硫酸,U形管中可观察到的现象是
溶液与稀硫酸,U形管中可观察到的现象是_______ 。
(2)为探究固体M溶于水的热效应,选择装置II进行实验(反应在丙试管中进行)。
①若观察到烧杯中产生气泡,则说明M溶于水_______ (填“一定是放热反应”、“一定是吸热反应”或“可能是放热反应”)。
②若只观察到烧杯中的导管内形成一段水柱,则M可能为_______ 。
(3)上述3个装置中,能验证“铜与浓硝酸的反应是吸热反应还是放热反应”的装置是_______ (填装置序号)
III.天然气的主要成分是甲烷,甲烷是一种重要的燃料和化工原料。
(1)某种甲烷燃料电池工作原理如图1所示。
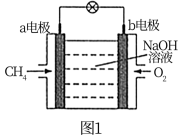
①电子移动方向为_______ (填“a→b“或“b→a“)。
②b电极的电极反应式为_______ 。
(2)甲烷可催化还原NO,反应历程如图2所示。

①该历程中,反应i为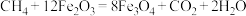 ,则反应ii的化学方程式为
,则反应ii的化学方程式为_______ 。
②工业上催化还原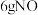 ,理论上需要
,理论上需要_______ LCH4(标准状况下)。
I.(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋可以利用
(2)“即热饭盒”给人们生活带来方便,它可利用下面
A.生石灰和水B.
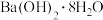 和
和 C.硝酸铵和水
C.硝酸铵和水II.某实验小组为了探究化学能与热能的转化,设计了如图所示的三套实验装置。

(1)某同学选用装置I进行实验(实验前U形管里液面左右相平),在甲试管中加入适量了
 溶液与稀硫酸,U形管中可观察到的现象是
溶液与稀硫酸,U形管中可观察到的现象是(2)为探究固体M溶于水的热效应,选择装置II进行实验(反应在丙试管中进行)。
①若观察到烧杯中产生气泡,则说明M溶于水
②若只观察到烧杯中的导管内形成一段水柱,则M可能为
(3)上述3个装置中,能验证“铜与浓硝酸的反应是吸热反应还是放热反应”的装置是
III.天然气的主要成分是甲烷,甲烷是一种重要的燃料和化工原料。
(1)某种甲烷燃料电池工作原理如图1所示。

①电子移动方向为
②b电极的电极反应式为
(2)甲烷可催化还原NO,反应历程如图2所示。

①该历程中,反应i为
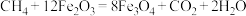 ,则反应ii的化学方程式为
,则反应ii的化学方程式为②工业上催化还原
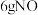 ,理论上需要
,理论上需要
您最近一年使用:0次
名校
解题方法
10 . 天然气既是高效洁净的能源,又是重要的化工原料,在生产、生活中用途广泛。
(1)下图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应。将铝片加入小试管内,然后注入足量的盐酸,U形导管中液面A_______ (填“上升”或“下降”),说明此反应是_______ (填“放热”或“吸热”)反应。 N2(g)+CO2(g)+2H2O(g)。
N2(g)+CO2(g)+2H2O(g)。
①下列措施能够使该反应速率加快的是_______ 。
a.使用催化剂 b.降低温度 c.及时分离水
d.把容器的体积缩小一倍 e.充入NO2 f.恒容下,充入Ar惰性气体
②若上述反应在恒容密闭容器中进行,下列叙述能说明该反应已达平衡状态的是_______ 。
a.正反应速率和逆反应速率相等 b.正反应速率最大,逆反应速率为0
c.容器内气体的压强不再变化 d.混合气体的质量不再变化
e.c(NO2)=2c(N2) f.单位时间内生成1molCO2同时生成2molNO2
(3)甲烷可直接应用于燃料电池,该电池采用KOH溶液为电解质,其工作原理如下图所示:_______ (填“a极到b极”或“b极到a极”)。
②a电极的电极方程式为_______ 。
(1)下图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应。将铝片加入小试管内,然后注入足量的盐酸,U形导管中液面A
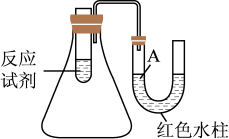
 N2(g)+CO2(g)+2H2O(g)。
N2(g)+CO2(g)+2H2O(g)。①下列措施能够使该反应速率加快的是
a.使用催化剂 b.降低温度 c.及时分离水
d.把容器的体积缩小一倍 e.充入NO2 f.恒容下,充入Ar惰性气体
②若上述反应在恒容密闭容器中进行,下列叙述能说明该反应已达平衡状态的是
a.正反应速率和逆反应速率相等 b.正反应速率最大,逆反应速率为0
c.容器内气体的压强不再变化 d.混合气体的质量不再变化
e.c(NO2)=2c(N2) f.单位时间内生成1molCO2同时生成2molNO2
(3)甲烷可直接应用于燃料电池,该电池采用KOH溶液为电解质,其工作原理如下图所示:
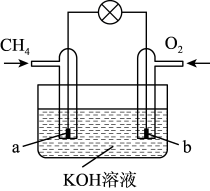
②a电极的电极方程式为
您最近一年使用:0次
2021-07-06更新
|
1197次组卷
|
3卷引用:湖南省邵阳邵东市第一中学2020-2021学年高一下学期期末考试化学试题



