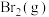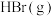1 . 研究碳及其化合物的相互转化对能源的充分利用、低碳经济有着重要的作用。
(1)已知:①CH4(g)+H2O(g) CO(g)+3H2(g) ΔH1=+206.1kJ·mol−1
CO(g)+3H2(g) ΔH1=+206.1kJ·mol−1
②2H2(g)+CO(g) CH3OH(g) ΔH2=-128.3kJ·mol−1
CH3OH(g) ΔH2=-128.3kJ·mol−1
③2H2(g)+O2(g)=2H2O(g) ΔH3=-483.6kJ·mol−1
若某反应的平衡常数表达式为:K=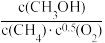 ,则此反应ΔH=
,则此反应ΔH=___________ kJ·mol−1。
(2)CH4-CO2催化重整对温室气体的减排具有重要意义。催化重整反应为:CH4(g)+CO2(g) 2CO(g)+2H2(g)ΔH=+247kJ·mol−1,平衡时CH4的转化率与温度和压强的关系如图所示。
2CO(g)+2H2(g)ΔH=+247kJ·mol−1,平衡时CH4的转化率与温度和压强的关系如图所示。___________ 。
②压强为P4时,在Y点:v正___________ v逆(填“>”、“<”或“=”)。
③图中W、X、Y、Z四点对应的反应的平衡常数K1、K2、K3、K4由大到小的顺序为___________ 。
(3)CO2加氢制备甲酸(HCOOH)可回收利用CO2,温度为T1时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g) HCOOH(g) ΔH>0,化学平衡常数K=1,实验测得:v正=k正·c(CO2)·c(H2),v逆=k逆·c(HCOOH),k正、k逆为速率常数。
HCOOH(g) ΔH>0,化学平衡常数K=1,实验测得:v正=k正·c(CO2)·c(H2),v逆=k逆·c(HCOOH),k正、k逆为速率常数。
①当HCOOH的体积分数为25%时,CO2的转化率为___________ 。
②温度为T1,反应达到平衡时,k逆=___________ (用k正表示)。改变温度至T2,若k逆=0.9k正,则T1___________ T2(填“>”、“<”或“=”)。
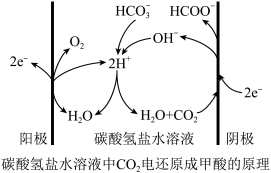
(4)采用电还原法也可将CO2转化为甲酸,在碳酸氢盐的水溶液中,CO2被还原成甲酸的原理如图所示。阴极的电极反应式是___________ 。
(1)已知:①CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH1=+206.1kJ·mol−1
CO(g)+3H2(g) ΔH1=+206.1kJ·mol−1②2H2(g)+CO(g)
 CH3OH(g) ΔH2=-128.3kJ·mol−1
CH3OH(g) ΔH2=-128.3kJ·mol−1③2H2(g)+O2(g)=2H2O(g) ΔH3=-483.6kJ·mol−1
若某反应的平衡常数表达式为:K=
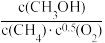 ,则此反应ΔH=
,则此反应ΔH=(2)CH4-CO2催化重整对温室气体的减排具有重要意义。催化重整反应为:CH4(g)+CO2(g)
 2CO(g)+2H2(g)ΔH=+247kJ·mol−1,平衡时CH4的转化率与温度和压强的关系如图所示。
2CO(g)+2H2(g)ΔH=+247kJ·mol−1,平衡时CH4的转化率与温度和压强的关系如图所示。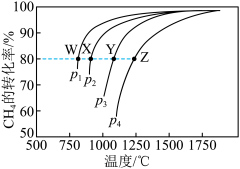
②压强为P4时,在Y点:v正
③图中W、X、Y、Z四点对应的反应的平衡常数K1、K2、K3、K4由大到小的顺序为
(3)CO2加氢制备甲酸(HCOOH)可回收利用CO2,温度为T1时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g)
 HCOOH(g) ΔH>0,化学平衡常数K=1,实验测得:v正=k正·c(CO2)·c(H2),v逆=k逆·c(HCOOH),k正、k逆为速率常数。
HCOOH(g) ΔH>0,化学平衡常数K=1,实验测得:v正=k正·c(CO2)·c(H2),v逆=k逆·c(HCOOH),k正、k逆为速率常数。①当HCOOH的体积分数为25%时,CO2的转化率为
②温度为T1,反应达到平衡时,k逆=
(4)采用电还原法也可将CO2转化为甲酸,在碳酸氢盐的水溶液中,CO2被还原成甲酸的原理如图所示。阴极的电极反应式是
您最近一年使用:0次
解题方法
2 . 甲烷干重整(DRM)是利用 和
和 在催化剂的作用下制备合成气,作为可持续替代燃料。DRM的主要反应为:
在催化剂的作用下制备合成气,作为可持续替代燃料。DRM的主要反应为:
Ⅰ.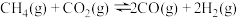
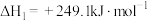
Ⅱ.
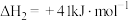
该过程中还伴随积碳反应的发生。
(1)一定压强下,由最稳定单质生成 化合物的焓变为该物质的摩尔生成焓。已知
化合物的焓变为该物质的摩尔生成焓。已知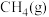 、
、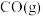 的摩尔生成焓分别为
的摩尔生成焓分别为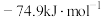 、
、 。则
。则 的摩尔生成焓为
的摩尔生成焓为_______  。
。
(2)甲烷和二氧化碳的起始物质的量均为 ,实验测得在
,实验测得在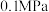 下,平衡时各组分的量随温度变化如图所示。
下,平衡时各组分的量随温度变化如图所示。_______ mol,反应Ⅱ的压强平衡常数
_______ 。
②为了消除积碳带来的影响,反应选择在_______ (填“高温”或“低温”)下进行。
(3)在不同压强下,按照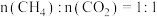 投料,假设只发生反应Ⅰ和Ⅱ。
投料,假设只发生反应Ⅰ和Ⅱ。 的平衡转化率随温度的变化关系如图所示。
的平衡转化率随温度的变化关系如图所示。 、
、 、
、 ,三者由大到小顺序为
,三者由大到小顺序为________ 。
②压强 、
、 、
、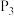 、
、 由小到大的顺序为
由小到大的顺序为________ 。
③ ,四条曲线几乎交于一点的原因是
,四条曲线几乎交于一点的原因是________ 。
 和
和 在催化剂的作用下制备合成气,作为可持续替代燃料。DRM的主要反应为:
在催化剂的作用下制备合成气,作为可持续替代燃料。DRM的主要反应为:Ⅰ.
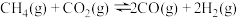
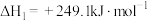
Ⅱ.

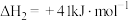
该过程中还伴随积碳反应的发生。
(1)一定压强下,由最稳定单质生成
 化合物的焓变为该物质的摩尔生成焓。已知
化合物的焓变为该物质的摩尔生成焓。已知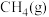 、
、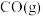 的摩尔生成焓分别为
的摩尔生成焓分别为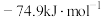 、
、 。则
。则 的摩尔生成焓为
的摩尔生成焓为 。
。(2)甲烷和二氧化碳的起始物质的量均为
 ,实验测得在
,实验测得在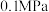 下,平衡时各组分的量随温度变化如图所示。
下,平衡时各组分的量随温度变化如图所示。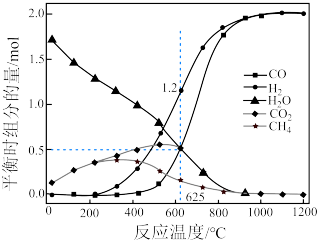

②为了消除积碳带来的影响,反应选择在
(3)在不同压强下,按照
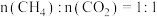 投料,假设只发生反应Ⅰ和Ⅱ。
投料,假设只发生反应Ⅰ和Ⅱ。 的平衡转化率随温度的变化关系如图所示。
的平衡转化率随温度的变化关系如图所示。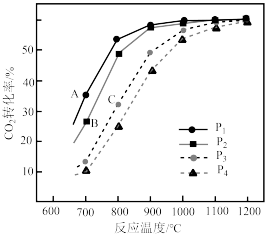
 、
、 、
、 ,三者由大到小顺序为
,三者由大到小顺序为②压强
 、
、 、
、 、
、 由小到大的顺序为
由小到大的顺序为③
 ,四条曲线几乎交于一点的原因是
,四条曲线几乎交于一点的原因是
您最近一年使用:0次
解题方法
3 . 研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义。
(1)工业上采用高温热分解H2S的方法制取H2,在膜反应器中分离H2,发生的反应为2H2S(g) 2H2(g)+S2(g) △H。
2H2(g)+S2(g) △H。
已知:①H2S(g) H2(g)+S(g) △H1;
H2(g)+S(g) △H1;
②2S(g) S2(g) △H2。
S2(g) △H2。
则△H=______ (用含△H1、△H2的式子表示)。
(2)土壤中的微生物可将大气中的H2S经两步反应氧化成SO ,两步反应的能量变化示意图如图:
,两步反应的能量变化示意图如图: (aq)的热化学方程式为
(aq)的热化学方程式为_______ 。
(3)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。______ 。
②在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有_______ 。
(4)二氧化硫—空气质子交换膜燃料电池可以利用大气中所含SO2快速启动,其装置示意图如图所示:______ (填“从A到B”或“从B到A”)。
②负极的电极反应为________ 。
(1)工业上采用高温热分解H2S的方法制取H2,在膜反应器中分离H2,发生的反应为2H2S(g)
 2H2(g)+S2(g) △H。
2H2(g)+S2(g) △H。已知:①H2S(g)
 H2(g)+S(g) △H1;
H2(g)+S(g) △H1;②2S(g)
 S2(g) △H2。
S2(g) △H2。则△H=
(2)土壤中的微生物可将大气中的H2S经两步反应氧化成SO
 ,两步反应的能量变化示意图如图:
,两步反应的能量变化示意图如图: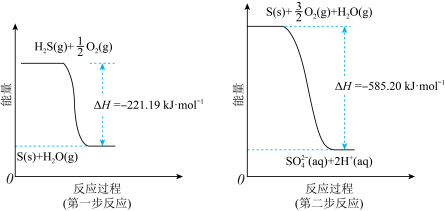
 (aq)的热化学方程式为
(aq)的热化学方程式为(3)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。
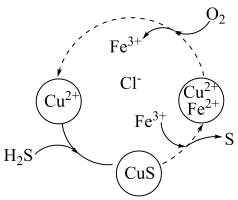
②在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有
(4)二氧化硫—空气质子交换膜燃料电池可以利用大气中所含SO2快速启动,其装置示意图如图所示:
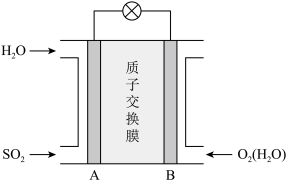
②负极的电极反应为
您最近一年使用:0次
4 . 甲烷是天然气的主要成分,是一种重要的清洁能源和化工原料。
(1)用煤制天然气时会发生多个反应,通过多种途径生成CH4。
已知: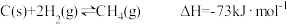
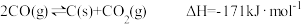
CO(g)+3H2(g) CH4(g)+H2O(g)ΔH=-203kJ·mol-1
CH4(g)+H2O(g)ΔH=-203kJ·mol-1
写出CO与H2O(g)反应生成H2和CO2的热化学方程式___________ 。
(2)工业上常用 与水蒸气在一定条件下来制取H2,其原理为:
与水蒸气在一定条件下来制取H2,其原理为: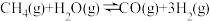 。
。
①一定温度时,在一个体积为2L的恒容密闭容器中,加入1molCH4和1.4mol水蒸气发生上述反应,5min后达平衡,生成0.2molCO,用H2表示该反应的速率为___________ ,此反应的平衡常数为___________  (结果保留到小数点后三位)。
(结果保留到小数点后三位)。
②下列说法中能说明此反应达到平衡状态的是___________ 。
A.体系的压强不再发生变化
B.生成1molCH4的同时消耗3molH2
C.体系的平均相对分子质量不再发生变化
D.体系的密度不再发生变化
E.反应速率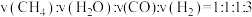
(3)一定温度下,向某密闭容器中充入适量CH3CHO(g),发生反应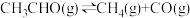 ,经过相同时间测得CH3CHO的转化率与压强的关系如图所示:
,经过相同时间测得CH3CHO的转化率与压强的关系如图所示:
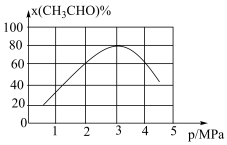
①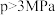 时,增大压强,CH3CHO的转化率降低,其原因是
时,增大压强,CH3CHO的转化率降低,其原因是___________ 。
②当压强为4MPa时,该反应的平衡常数Kp=___________ MPa(用各物质分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
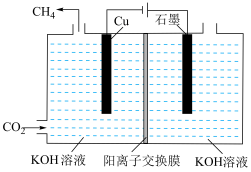
(4) 电化学制
电化学制 。下图表示以KOH溶液作电解质溶液进行电解的示意图,
。下图表示以KOH溶液作电解质溶液进行电解的示意图, 在Cu电极上可以转化为
在Cu电极上可以转化为 ,该电极反应的方程式为
,该电极反应的方程式为___________ 。
(1)用煤制天然气时会发生多个反应,通过多种途径生成CH4。
已知:
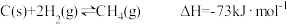
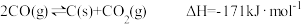
CO(g)+3H2(g)
 CH4(g)+H2O(g)ΔH=-203kJ·mol-1
CH4(g)+H2O(g)ΔH=-203kJ·mol-1写出CO与H2O(g)反应生成H2和CO2的热化学方程式
(2)工业上常用
 与水蒸气在一定条件下来制取H2,其原理为:
与水蒸气在一定条件下来制取H2,其原理为: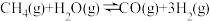 。
。①一定温度时,在一个体积为2L的恒容密闭容器中,加入1molCH4和1.4mol水蒸气发生上述反应,5min后达平衡,生成0.2molCO,用H2表示该反应的速率为
 (结果保留到小数点后三位)。
(结果保留到小数点后三位)。②下列说法中能说明此反应达到平衡状态的是
A.体系的压强不再发生变化
B.生成1molCH4的同时消耗3molH2
C.体系的平均相对分子质量不再发生变化
D.体系的密度不再发生变化
E.反应速率
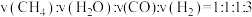
(3)一定温度下,向某密闭容器中充入适量CH3CHO(g),发生反应
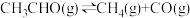 ,经过相同时间测得CH3CHO的转化率与压强的关系如图所示:
,经过相同时间测得CH3CHO的转化率与压强的关系如图所示:
①
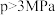 时,增大压强,CH3CHO的转化率降低,其原因是
时,增大压强,CH3CHO的转化率降低,其原因是②当压强为4MPa时,该反应的平衡常数Kp=
(4)
 电化学制
电化学制 。下图表示以KOH溶液作电解质溶液进行电解的示意图,
。下图表示以KOH溶液作电解质溶液进行电解的示意图, 在Cu电极上可以转化为
在Cu电极上可以转化为 ,该电极反应的方程式为
,该电极反应的方程式为
您最近一年使用:0次
5 . 低碳经济已成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。回答下列问题:
(1)用 催化加氢可以制取乙烯。
催化加氢可以制取乙烯。 ,该反应体系的能量随反应过程变化关系如图所示,则该反应的
,该反应体系的能量随反应过程变化关系如图所示,则该反应的
_______  (用含a、b的式子表示)。
(用含a、b的式子表示)。

(2)工业上用 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知:


则
_______  。
。
(3)在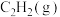 完全燃烧生成
完全燃烧生成 和液态水的反应中,每有
和液态水的反应中,每有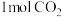 生成时,放出
生成时,放出 的热量,写出
的热量,写出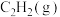 燃烧热的热化学方程式
燃烧热的热化学方程式_______ ;
(4)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。科学家提出由 制取C的太阳能工艺如图:
制取C的太阳能工艺如图:

①已知“重整系统”发生的反应中 ,则
,则 的化学式为
的化学式为_______ ,“热分解系统”中每转移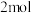 电子,需消耗
电子,需消耗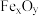
_______ mol。
(5)18-冠-6是冠醚的一种,是有机合成中重要的相转移催化剂,其结构如图A所示,回答下列问题:

18-冠-6中碳原子核外电子有_______ 种不同的空间运动状态,氧原子的杂化类型为_______ 。
(1)用
 催化加氢可以制取乙烯。
催化加氢可以制取乙烯。 ,该反应体系的能量随反应过程变化关系如图所示,则该反应的
,该反应体系的能量随反应过程变化关系如图所示,则该反应的
 (用含a、b的式子表示)。
(用含a、b的式子表示)。
(2)工业上用
 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知:

则

 。
。(3)在
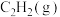 完全燃烧生成
完全燃烧生成 和液态水的反应中,每有
和液态水的反应中,每有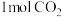 生成时,放出
生成时,放出 的热量,写出
的热量,写出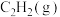 燃烧热的热化学方程式
燃烧热的热化学方程式(4)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。科学家提出由
 制取C的太阳能工艺如图:
制取C的太阳能工艺如图:
①已知“重整系统”发生的反应中
 ,则
,则 的化学式为
的化学式为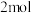 电子,需消耗
电子,需消耗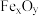
(5)18-冠-6是冠醚的一种,是有机合成中重要的相转移催化剂,其结构如图A所示,回答下列问题:

18-冠-6中碳原子核外电子有
您最近一年使用:0次
名校
解题方法
6 . 利用可见光催化还原 ,将
,将 转化为增值化学原料(HCHO、HCOOH、
转化为增值化学原料(HCHO、HCOOH、 等),这被认为是一种可持续的
等),这被认为是一种可持续的 资源化有效途径。
资源化有效途径。
(1)已知几种物质的燃烧热(△H)如表所示:
已知:
 ,则
,则

______  。
。
(2)我国学者探究了BiIn合金催化剂电化学还原 生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态),试从图分析,采用BiIn合金催化剂优于中金属Bi和单金属In催化剂的原因分别是
生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态),试从图分析,采用BiIn合金催化剂优于中金属Bi和单金属In催化剂的原因分别是______ 。 催化加氢制
催化加氢制 的反应体系中,发生的主要反应有:
的反应体系中,发生的主要反应有:
ⅰ、

ⅱ、

ⅲ、

一定压强下,往某密闭容器中按投料比 充入
充入 和
和 ,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。______ 。
A.恒温恒压时充入氦气,反应ⅱ、ⅲ的平衡均逆向移动,反应ⅰ不移动
B.增大 的比值,
的比值, 的平衡转化率增大
的平衡转化率增大
C.图中X、Y分别代表CO、
D.体系中的 的物质的量分数随温度变化不大,原因是温度变化,反应ⅰ、ⅲ的平衡移动方向相反
的物质的量分数随温度变化不大,原因是温度变化,反应ⅰ、ⅲ的平衡移动方向相反
②在上图中画出反应达到平衡时, 随温度变化趋势图(只用画220℃以后)
随温度变化趋势图(只用画220℃以后)______ 。
③在一定温度下,向容积为2L的恒容密闭容器中充入1mo1 (g)和nmol
(g)和nmol (g)。仅发生反应ⅲ。实验测得
(g)。仅发生反应ⅲ。实验测得 的平衡分压与起始投料比[
的平衡分压与起始投料比[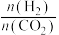 ]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数
]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数
______ 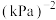 (用含p的表达式表示)。(已知:用气体分压计算的平衡常数为
(用含p的表达式表示)。(已知:用气体分压计算的平衡常数为 ,分压=总压×物质的量分数)。
,分压=总压×物质的量分数)。
 ,将
,将 转化为增值化学原料(HCHO、HCOOH、
转化为增值化学原料(HCHO、HCOOH、 等),这被认为是一种可持续的
等),这被认为是一种可持续的 资源化有效途径。
资源化有效途径。(1)已知几种物质的燃烧热(△H)如表所示:
| 物质 | HCHO(g) |  (g) (g) |
燃烧热(△H)( ) ) | -570.8 | -285.8 |

 ,则
,则

 。
。(2)我国学者探究了BiIn合金催化剂电化学还原
 生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态),试从图分析,采用BiIn合金催化剂优于中金属Bi和单金属In催化剂的原因分别是
生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态),试从图分析,采用BiIn合金催化剂优于中金属Bi和单金属In催化剂的原因分别是
 催化加氢制
催化加氢制 的反应体系中,发生的主要反应有:
的反应体系中,发生的主要反应有:ⅰ、


ⅱ、


ⅲ、


一定压强下,往某密闭容器中按投料比
 充入
充入 和
和 ,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
A.恒温恒压时充入氦气,反应ⅱ、ⅲ的平衡均逆向移动,反应ⅰ不移动
B.增大
 的比值,
的比值, 的平衡转化率增大
的平衡转化率增大C.图中X、Y分别代表CO、

D.体系中的
 的物质的量分数随温度变化不大,原因是温度变化,反应ⅰ、ⅲ的平衡移动方向相反
的物质的量分数随温度变化不大,原因是温度变化,反应ⅰ、ⅲ的平衡移动方向相反②在上图中画出反应达到平衡时,
 随温度变化趋势图(只用画220℃以后)
随温度变化趋势图(只用画220℃以后)③在一定温度下,向容积为2L的恒容密闭容器中充入1mo1
 (g)和nmol
(g)和nmol (g)。仅发生反应ⅲ。实验测得
(g)。仅发生反应ⅲ。实验测得 的平衡分压与起始投料比[
的平衡分压与起始投料比[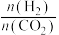 ]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数
]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数
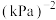 (用含p的表达式表示)。(已知:用气体分压计算的平衡常数为
(用含p的表达式表示)。(已知:用气体分压计算的平衡常数为 ,分压=总压×物质的量分数)。
,分压=总压×物质的量分数)。
您最近一年使用:0次
名校
7 . A、B、C是三种常见短周期元素的单质,常温下D为无色液体,E是一种常见的温室气体,F是化合物.其转化关系如图(反应条件和部分产物略去)。试回答:

(1)E的结构式是______ 。
(2)单质X和B或D均能反应生成黑色晶体Y,Y的化学式是;______ ;
(3)E的大量排放会引起很多环境问题.有科学家提出,用E和 合成
合成 和
和 ,对E进行综合利用。25℃,101kPa时该反应的热化学方程式是
,对E进行综合利用。25℃,101kPa时该反应的热化学方程式是______ 。
已知
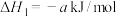
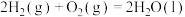
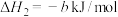
(4)已知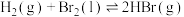
 ;蒸发1mol
;蒸发1mol 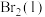 需要吸收的能量为30kJ,其它相关数据如下表。则表中a为
需要吸收的能量为30kJ,其它相关数据如下表。则表中a为______ 。
(5)以NaCl等为原料制备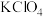 的过程如下:
的过程如下:
①在无隔膜、微酸性条件下电解,发生反应: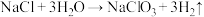 (未配平)。
(未配平)。
②在电解后溶液中加入KCl发生复分解反应,降温结晶,得
③一定条件下反应: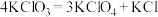 ,将产物分离得到
,将产物分离得到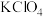 。
。
该过程制得的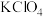 样品中含少量KCl杂质,为测定产品纯度进行如下实验:准确称取m g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使
样品中含少量KCl杂质,为测定产品纯度进行如下实验:准确称取m g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使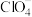 全部转化为
全部转化为 ,反应为:
,反应为: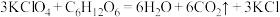 ,加入少量
,加入少量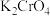 溶液作指示剂,用
溶液作指示剂,用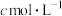
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液体积V mL。滴定达到终点时,产生砖红色
溶液体积V mL。滴定达到终点时,产生砖红色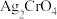 沉淀。计算
沉淀。计算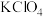 样品的纯度
样品的纯度______ (用含c、V的代数式表示)。

(1)E的结构式是
(2)单质X和B或D均能反应生成黑色晶体Y,Y的化学式是;
(3)E的大量排放会引起很多环境问题.有科学家提出,用E和
 合成
合成 和
和 ,对E进行综合利用。25℃,101kPa时该反应的热化学方程式是
,对E进行综合利用。25℃,101kPa时该反应的热化学方程式是已知

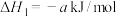
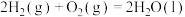
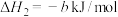
(4)已知
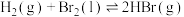
 ;蒸发1mol
;蒸发1mol 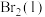 需要吸收的能量为30kJ,其它相关数据如下表。则表中a为
需要吸收的能量为30kJ,其它相关数据如下表。则表中a为物质 |
|
|
|
1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | a | 369 |
(5)以NaCl等为原料制备
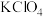 的过程如下:
的过程如下:①在无隔膜、微酸性条件下电解,发生反应:
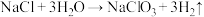 (未配平)。
(未配平)。②在电解后溶液中加入KCl发生复分解反应,降温结晶,得

③一定条件下反应:
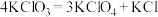 ,将产物分离得到
,将产物分离得到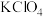 。
。该过程制得的
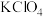 样品中含少量KCl杂质,为测定产品纯度进行如下实验:准确称取m g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使
样品中含少量KCl杂质,为测定产品纯度进行如下实验:准确称取m g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使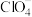 全部转化为
全部转化为 ,反应为:
,反应为: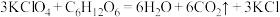 ,加入少量
,加入少量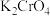 溶液作指示剂,用
溶液作指示剂,用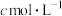
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液体积V mL。滴定达到终点时,产生砖红色
溶液体积V mL。滴定达到终点时,产生砖红色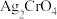 沉淀。计算
沉淀。计算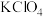 样品的纯度
样品的纯度
您最近一年使用:0次
2024-01-21更新
|
65次组卷
|
2卷引用:新疆乌鲁木齐市第九中学2023-2024学年高三上学期11月月考化学试题
名校
解题方法
8 . 硫酸有着广泛的用途。硫酸工业在国民经济中占有重要地位。
(1)实验室可用铜与浓硫酸反应制备少量 :
: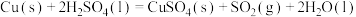
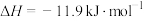 。判断该反应的自发性并说明理由
。判断该反应的自发性并说明理由___________ 。
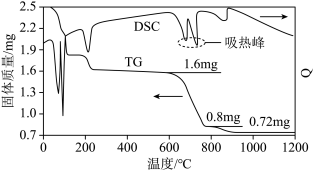
(2)我国古籍记载了硫酸的制备方法—“炼石胆( )取精华法”。
)取精华法”。
①借助现代仪器分析,该制备过程中 分解的TG曲线(热重曲线,即受热分解过程中固体质量变化曲线)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有
分解的TG曲线(热重曲线,即受热分解过程中固体质量变化曲线)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有___________ 、___________ (填化学式)和 。
。
②已知下列热化学方程式:
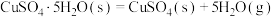
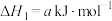

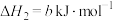
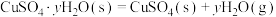

则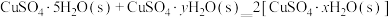 的△H=
的△H=__________  。
。
(3)接触法制硫酸的关键反应为 的催化氧化:
的催化氧化: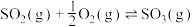
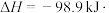

①为寻求固定投料比下不同反应阶段的最佳生产温度,绘制不同转化率( )下反应速率(数值已略去)与温度的关系如图,下列说法正确的是
)下反应速率(数值已略去)与温度的关系如图,下列说法正确的是__________ 。
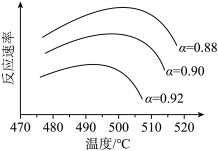
A.温度越高,反应速率越大 B.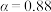 的曲线代表平衡转化率
的曲线代表平衡转化率
C. 越大,反应速率最大值对应温度越低 D.可根据不同
越大,反应速率最大值对应温度越低 D.可根据不同 下的最大速率,选择最佳生产温度
下的最大速率,选择最佳生产温度
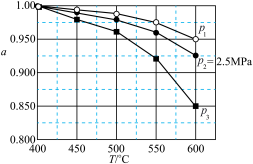
②固定投料比,在压强分别为0.5MPa、2.5MPa和5.0MPa下,得到 的平衡转化率随温度的变化如图所示。则在5.0MPa、550℃时,该反应的平衡转化率=
的平衡转化率随温度的变化如图所示。则在5.0MPa、550℃时,该反应的平衡转化率=__________ 。
③对于气体参与的反应,可用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B)来表示平衡常数 。设
。设 的平衡分压为p,
的平衡分压为p, 的平衡转化率为
的平衡转化率为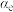 ,则上述催化氧化反应
,则上述催化氧化反应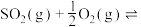
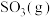 的
的
_____________ (用含p和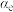 的代数式表示)。
的代数式表示)。
(1)实验室可用铜与浓硫酸反应制备少量
 :
: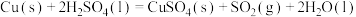
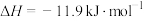 。判断该反应的自发性并说明理由
。判断该反应的自发性并说明理由(2)我国古籍记载了硫酸的制备方法—“炼石胆(
 )取精华法”。
)取精华法”。①借助现代仪器分析,该制备过程中
 分解的TG曲线(热重曲线,即受热分解过程中固体质量变化曲线)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有
分解的TG曲线(热重曲线,即受热分解过程中固体质量变化曲线)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有 。
。
②已知下列热化学方程式:
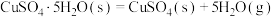
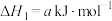

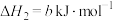
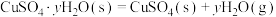

则
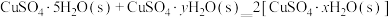 的△H=
的△H= 。
。(3)接触法制硫酸的关键反应为
 的催化氧化:
的催化氧化: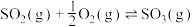
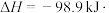

①为寻求固定投料比下不同反应阶段的最佳生产温度,绘制不同转化率(
 )下反应速率(数值已略去)与温度的关系如图,下列说法正确的是
)下反应速率(数值已略去)与温度的关系如图,下列说法正确的是
A.温度越高,反应速率越大 B.
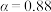 的曲线代表平衡转化率
的曲线代表平衡转化率C.
 越大,反应速率最大值对应温度越低 D.可根据不同
越大,反应速率最大值对应温度越低 D.可根据不同 下的最大速率,选择最佳生产温度
下的最大速率,选择最佳生产温度②固定投料比,在压强分别为0.5MPa、2.5MPa和5.0MPa下,得到
 的平衡转化率随温度的变化如图所示。则在5.0MPa、550℃时,该反应的平衡转化率=
的平衡转化率随温度的变化如图所示。则在5.0MPa、550℃时,该反应的平衡转化率=
③对于气体参与的反应,可用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B)来表示平衡常数
 。设
。设 的平衡分压为p,
的平衡分压为p, 的平衡转化率为
的平衡转化率为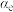 ,则上述催化氧化反应
,则上述催化氧化反应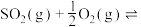
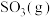 的
的
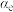 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
9 .  催化剂能催化
催化剂能催化 脱除烟气中的NO,反应为
脱除烟气中的NO,反应为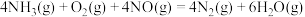

(1)催化剂___________ 改变ΔH(填“能”或“不能”)
(2)催化剂的制备。将预先制备的一定量的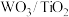 粉末置于80℃的水中,在搅拌下加入一定量的
粉末置于80℃的水中,在搅拌下加入一定量的 溶液,经蒸发焙烧等工序得到颗粒状
溶液,经蒸发焙烧等工序得到颗粒状 催化剂。在水溶液中
催化剂。在水溶液中 水解为
水解为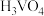 沉淀的离子方程式为
沉淀的离子方程式为___________ ;
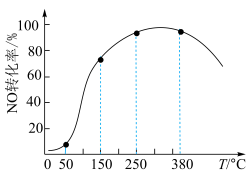
(3)催化剂的应用。将一定物质的量浓度的NO、 、
、 (其余为
(其余为 )气体匀速通过装有
)气体匀速通过装有 催化剂的反应器,测得NO的转化率随温度的变化如题图所示。反应温度在50~150℃范围内,NO转化为
催化剂的反应器,测得NO的转化率随温度的变化如题图所示。反应温度在50~150℃范围内,NO转化为 的转化率迅速上升,原因是:
的转化率迅速上升,原因是:___________
(4)废催化剂的回收。回收 催化剂并制备
催化剂并制备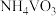 的过程可表示为
的过程可表示为

①酸浸时,加料完成后,以一定速率搅拌反应。提高钒元素浸出率的方法还有___________ 。
②向pH=8的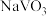 溶液中加入过量的
溶液中加入过量的 溶液,生成
溶液,生成 沉淀。已知
沉淀。已知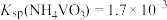 ,加过量
,加过量 溶液的目的是
溶液的目的是___________ 。
(5)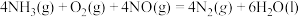 ΔH
ΔH___________  (填“>”“<”或“=”)
(填“>”“<”或“=”)
 催化剂能催化
催化剂能催化 脱除烟气中的NO,反应为
脱除烟气中的NO,反应为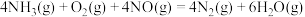

(1)催化剂
(2)催化剂的制备。将预先制备的一定量的
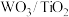 粉末置于80℃的水中,在搅拌下加入一定量的
粉末置于80℃的水中,在搅拌下加入一定量的 溶液,经蒸发焙烧等工序得到颗粒状
溶液,经蒸发焙烧等工序得到颗粒状 催化剂。在水溶液中
催化剂。在水溶液中 水解为
水解为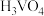 沉淀的离子方程式为
沉淀的离子方程式为(3)催化剂的应用。将一定物质的量浓度的NO、
 、
、 (其余为
(其余为 )气体匀速通过装有
)气体匀速通过装有 催化剂的反应器,测得NO的转化率随温度的变化如题图所示。反应温度在50~150℃范围内,NO转化为
催化剂的反应器,测得NO的转化率随温度的变化如题图所示。反应温度在50~150℃范围内,NO转化为 的转化率迅速上升,原因是:
的转化率迅速上升,原因是:
(4)废催化剂的回收。回收
 催化剂并制备
催化剂并制备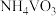 的过程可表示为
的过程可表示为
①酸浸时,加料完成后,以一定速率搅拌反应。提高钒元素浸出率的方法还有
②向pH=8的
 溶液中加入过量的
溶液中加入过量的 溶液,生成
溶液,生成 沉淀。已知
沉淀。已知 ,加过量
,加过量 溶液的目的是
溶液的目的是(5)
 ΔH
ΔH (填“>”“<”或“=”)
(填“>”“<”或“=”)
您最近一年使用:0次
名校
解题方法
10 . 在催化剂作用下H2(g)可将烟气中的SO2(g)还原成S(s)。回答下列问题:
(1)已知:O2(g)+2H2(g) 2H2O(l) ΔH1=-571.6 kJ /mol
2H2O(l) ΔH1=-571.6 kJ /mol
S(s)+O2(g) SO2(g) ΔH2=-296.9 kJ /mol
SO2(g) ΔH2=-296.9 kJ /mol
则H2(g)还原烟气中的SO2(g)的热化学方程式为___________ 。
(2)在容积为10 L的容器中充入1 mol SO2(g)与2 mol H2(g)的混合气体,发生反应SO2(g)+2H2(g) S(s)+2H2O(g) ΔH<0。
S(s)+2H2O(g) ΔH<0。
①恒容时,反应经过4s后达到平衡,此时测得H2O(g)的物质的量为1.2mol。则0~4s内,v(H2)=___________ mol·L-1·s-1,平衡时,c(SO2)=___________ mol·L-1;若平衡后升高温度,SO2的转化率将___________ (填“增大”、“减小”或“不变”)。
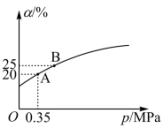
② 恒温时,压强p与SO2的平衡转化率α如图所示,该温度下,该反应的平衡常数Kp=___________ MPa-1 (用平衡分压代替平衡浓度计算,气体分压=气体总压强×气体的物质的量分数);平衡状态由A变到B,平衡常数K(A)___________ (填“>”、“<”或“=”) K(B)。
③ 若在恒温恒容密闭容器中发生上述反应,下列可作为该反应达到平衡状态的标志是___________ (填标号)。
A.压强不再变化
B.气体的密度不再变化
C.气体的平均相对分子质量不再变化
D.SO2的消耗速率与H2O(g)的生成速率之比为1∶2
(1)已知:O2(g)+2H2(g)
 2H2O(l) ΔH1=-571.6 kJ /mol
2H2O(l) ΔH1=-571.6 kJ /molS(s)+O2(g)
 SO2(g) ΔH2=-296.9 kJ /mol
SO2(g) ΔH2=-296.9 kJ /mol则H2(g)还原烟气中的SO2(g)的热化学方程式为
(2)在容积为10 L的容器中充入1 mol SO2(g)与2 mol H2(g)的混合气体,发生反应SO2(g)+2H2(g)
 S(s)+2H2O(g) ΔH<0。
S(s)+2H2O(g) ΔH<0。①恒容时,反应经过4s后达到平衡,此时测得H2O(g)的物质的量为1.2mol。则0~4s内,v(H2)=
② 恒温时,压强p与SO2的平衡转化率α如图所示,该温度下,该反应的平衡常数Kp=

③ 若在恒温恒容密闭容器中发生上述反应,下列可作为该反应达到平衡状态的标志是
A.压强不再变化
B.气体的密度不再变化
C.气体的平均相对分子质量不再变化
D.SO2的消耗速率与H2O(g)的生成速率之比为1∶2
您最近一年使用:0次