1 . 用 还原
还原 可合成
可合成 。回答下列问题:
。回答下列问题:
(1)利用 光解水制
光解水制 具有重要的经济价值,原理如图所示。
具有重要的经济价值,原理如图所示。 表面发生的电极反应式为
表面发生的电极反应式为_____ 。
写出 还原
还原 生成
生成 和
和 的热化学方程式:
的热化学方程式:_____ 。
(3)一定条件下,向某恒容密闭容器中充入2
 和3
和3
 反应生成
反应生成 和
和 ,起始时压强为
,起始时压强为 ,测得在相同时间内不同温度下
,测得在相同时间内不同温度下 的转化率如图所示。
的转化率如图所示。_____ 。
② K时,该反应的平衡常数
K时,该反应的平衡常数
_____ (列出计算式即可,不必化简。以分压代替浓度,分压=总压×物质的量分数)。
(4)为了探究浓度对反应速率的影响,473K时,向某恒容密闭容器中充入 和
和 进行实验,实验数据如下表所示:
进行实验,实验数据如下表所示:
该反应速率的通式为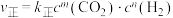 ,
,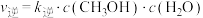 (
( 、
、 是只与温度有关的速率常数)。由表中数据可确定反应速率通式中
是只与温度有关的速率常数)。由表中数据可确定反应速率通式中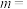
_____ 、
_____ 。实验发现,当实验1中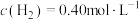 时达到平衡,请计算该温度下此反应的
时达到平衡,请计算该温度下此反应的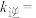
_____ 。
 还原
还原 可合成
可合成 。回答下列问题:
。回答下列问题:(1)利用
 光解水制
光解水制 具有重要的经济价值,原理如图所示。
具有重要的经济价值,原理如图所示。 表面发生的电极反应式为
表面发生的电极反应式为
| 共价键 |  |  |  |  |  |
键能/( ) ) | 464 | 358 | 799 | 432 | 411 |
 还原
还原 生成
生成 和
和 的热化学方程式:
的热化学方程式:(3)一定条件下,向某恒容密闭容器中充入2

 和3
和3
 反应生成
反应生成 和
和 ,起始时压强为
,起始时压强为 ,测得在相同时间内不同温度下
,测得在相同时间内不同温度下 的转化率如图所示。
的转化率如图所示。
②
 K时,该反应的平衡常数
K时,该反应的平衡常数
(4)为了探究浓度对反应速率的影响,473K时,向某恒容密闭容器中充入
 和
和 进行实验,实验数据如下表所示:
进行实验,实验数据如下表所示:| 实验 | 起始浓度/( ) ) | 初始速率/( ) ) | |
 |  | ||
| 1 | 0.25 | 1.00 | 0.45 |
| 2 | 0.25 | 2.00 | 3.60 |
| 3 | 2.00 | 1.00 | 3.6 |
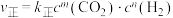 ,
,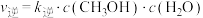 (
( 、
、 是只与温度有关的速率常数)。由表中数据可确定反应速率通式中
是只与温度有关的速率常数)。由表中数据可确定反应速率通式中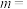

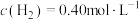 时达到平衡,请计算该温度下此反应的
时达到平衡,请计算该温度下此反应的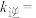
您最近一年使用:0次
2024-05-12更新
|
88次组卷
|
2卷引用:2024届青海省西宁市大通县高三下学期第二次模拟考试理科综合试题-高中化学
名校
解题方法
2 . 某研究团队以NO和H2为原料,在Fe基催化下有效地合成NH3.回答下列问题:
已知:①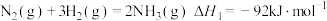
②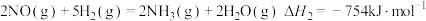
(1)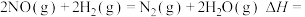
___________  。
。
(2)在一定温度下,向一恒容密闭容器中充入0.2molNO(g)和0.5molH2(g),只发生反应②,达到平衡时生成1.7gNH3(g)。下列叙述正确的是___________ (填标号)。
A.当容器内总压强不变时,该反应达到平衡
B.达到平衡时,反应体系放出的热量为37.7kJ
C.平衡后再充入0.2molNO(g)和0.5molH2(g),NO平衡转化率减小
(3)研究发现, 分两步进行:
分两步进行:
第1步: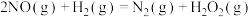 (慢反应);
(慢反应);
第2步:___________ (补充)(快反应)。
加入催化剂,主要是降低第___________ (填“1”或“2”)步反应活化能。
(4) 的反应速率方程式为
的反应速率方程式为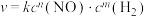 (其中,k为常数,只与温度和催化剂有关)。为了测定反应级数m、n,实验结果如下:
(其中,k为常数,只与温度和催化剂有关)。为了测定反应级数m、n,实验结果如下:
根据上述数据计算:m=___________ ,n=___________ ,c=___________ 。
(5)在一密闭反应器中充入2molNO(g)和5molH2(g),在催化剂10Fe﹣8Cu/TiO2作用下发生反应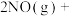
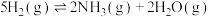 ,
, ,实验测得NO转化率和NH3选择性与温度的关系如图所示。
,实验测得NO转化率和NH3选择性与温度的关系如图所示。

温度高于350℃时,NO转化率增大,但NH3选择性降低,主要原因是___________ 。a点时生成NH3的物质的量为___________ (结果保留3位有效数字)。
(6)某温度下,保持总压强为100kPa,向反应器中充入2molNO(g)和6molH2(g),只发生反应:(a)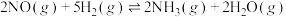 ,(b)
,(b) ,达到平衡时NO转化率为60%,NH3选择性为80%。反应(b)的平衡常数
,达到平衡时NO转化率为60%,NH3选择性为80%。反应(b)的平衡常数
___________  (计算结果保留三位有效数字)。
(计算结果保留三位有效数字)。
已知:①
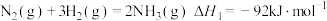
②
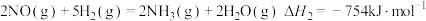
(1)
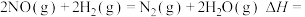
 。
。(2)在一定温度下,向一恒容密闭容器中充入0.2molNO(g)和0.5molH2(g),只发生反应②,达到平衡时生成1.7gNH3(g)。下列叙述正确的是
A.当容器内总压强不变时,该反应达到平衡
B.达到平衡时,反应体系放出的热量为37.7kJ
C.平衡后再充入0.2molNO(g)和0.5molH2(g),NO平衡转化率减小
(3)研究发现,
 分两步进行:
分两步进行:第1步:
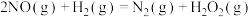 (慢反应);
(慢反应);第2步:
加入催化剂,主要是降低第
(4)
 的反应速率方程式为
的反应速率方程式为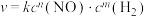 (其中,k为常数,只与温度和催化剂有关)。为了测定反应级数m、n,实验结果如下:
(其中,k为常数,只与温度和催化剂有关)。为了测定反应级数m、n,实验结果如下:| 序号 | 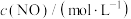 | 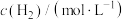 | 速率 |
| I | 0.1 | 0.1 | v |
| II | 0.2 | 0.1 | 4v |
| III | 0.2 | 0.2 | 8v |
| IV | c | 0.4 | 36v |
(5)在一密闭反应器中充入2molNO(g)和5molH2(g),在催化剂10Fe﹣8Cu/TiO2作用下发生反应
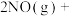
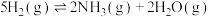 ,
, ,实验测得NO转化率和NH3选择性与温度的关系如图所示。
,实验测得NO转化率和NH3选择性与温度的关系如图所示。
温度高于350℃时,NO转化率增大,但NH3选择性降低,主要原因是
(6)某温度下,保持总压强为100kPa,向反应器中充入2molNO(g)和6molH2(g),只发生反应:(a)
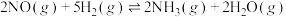 ,(b)
,(b) ,达到平衡时NO转化率为60%,NH3选择性为80%。反应(b)的平衡常数
,达到平衡时NO转化率为60%,NH3选择性为80%。反应(b)的平衡常数
 (计算结果保留三位有效数字)。
(计算结果保留三位有效数字)。
您最近一年使用:0次
2024-01-19更新
|
161次组卷
|
3卷引用:2024届青海省协作联考高三上学期一模理综试题
名校
3 . H2S的转化是资源利用和环境保护的重要研究课题。回答下列问题:
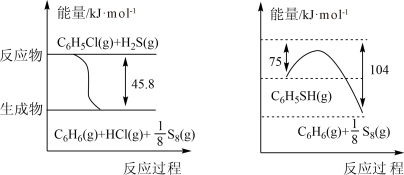
(1)苯硫酚(C6H5SH)是一种重要的有机合成中间体,工业上常用氯苯(C6H5Cl)和硫化氢(H2S)来制备苯硫酚。已知下列两个反应的能量关系如图所示,则C6H5Cl与H2S反应生成C6H5SH的热化学方程式为_______ 。
(2)H2S与CO2在高温下反应制得的羰基硫(COS)可用于合成除草剂。在610K时,将0.40molH2S与0.10molCO2充入2.5L的空钢瓶中,发生反应:H2S(g)+CO2(g)⇌COS(g)+H2O(g)ΔH=+35kJ/mol,反应达平衡后水蒸气的物质的量分数为0.02。
①在610K时,反应经2min达到平衡,则0~2min的平均反应速率v(H2S)=_______ 。
②实验测得上述反应的速率方程为:v正=k正·c(H2S)·c(CO2),v逆=k逆·c(COS)·c(H2O),k正、k逆分别为正、逆反应速率常数,速率常数k随温度升高而增大。则达到平衡后,仅升高温度,k正增大的倍数_______ (填“>”“<”或“=”)k逆增大的倍数。
③该条件下,容器中反应达到化学平衡状态的依据是_______ (填字母)。
A.容器内混合气体密度不再变化 B.v正(H2S)=v逆(COS)
C.容器内的压强不再变化 D.H2S与CO2的质量之比不变
(3)工业上可以通过硫化氢分解制得H2和硫蒸气。在密闭容器中充入一定量H2S气体,反应原理:2H2S(g)⇌2H2(g)+S2(g),H2S气体的平衡转化率与温度、压强的关系如图所示。
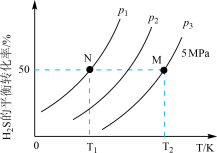
①图中压强(P1、P2、P3)的大小顺序为_______ ,理由是_______ 。
②如果要进一步提高H2S的平衡转化率,除改变温度、压强外,还可以采取的措施有_______ 。
③在温度T2、P3=5MPa条件下,该反应的平衡常数Kp=_______ MPa(已知:用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(1)苯硫酚(C6H5SH)是一种重要的有机合成中间体,工业上常用氯苯(C6H5Cl)和硫化氢(H2S)来制备苯硫酚。已知下列两个反应的能量关系如图所示,则C6H5Cl与H2S反应生成C6H5SH的热化学方程式为

(2)H2S与CO2在高温下反应制得的羰基硫(COS)可用于合成除草剂。在610K时,将0.40molH2S与0.10molCO2充入2.5L的空钢瓶中,发生反应:H2S(g)+CO2(g)⇌COS(g)+H2O(g)ΔH=+35kJ/mol,反应达平衡后水蒸气的物质的量分数为0.02。
①在610K时,反应经2min达到平衡,则0~2min的平均反应速率v(H2S)=
②实验测得上述反应的速率方程为:v正=k正·c(H2S)·c(CO2),v逆=k逆·c(COS)·c(H2O),k正、k逆分别为正、逆反应速率常数,速率常数k随温度升高而增大。则达到平衡后,仅升高温度,k正增大的倍数
③该条件下,容器中反应达到化学平衡状态的依据是
A.容器内混合气体密度不再变化 B.v正(H2S)=v逆(COS)
C.容器内的压强不再变化 D.H2S与CO2的质量之比不变
(3)工业上可以通过硫化氢分解制得H2和硫蒸气。在密闭容器中充入一定量H2S气体,反应原理:2H2S(g)⇌2H2(g)+S2(g),H2S气体的平衡转化率与温度、压强的关系如图所示。

①图中压强(P1、P2、P3)的大小顺序为
②如果要进一步提高H2S的平衡转化率,除改变温度、压强外,还可以采取的措施有
③在温度T2、P3=5MPa条件下,该反应的平衡常数Kp=
您最近一年使用:0次
2023-06-19更新
|
339次组卷
|
4卷引用:青海省西宁市大通回族土族自治县2023-2024学年高三上学期期中考试理综试题
解题方法
4 . 无论是在环境保护还是工农业生产方面,氮及其化合物一直是我国科研重点。
已知:反应i. 6NO(g)+4NH3(g)⇌5N2(g)+6H2O(g) ΔH1=−1808kJ·mol−1;
反应ii. N2(g)+3H2(g)⇌2NH3(g) ΔH2=−91.4kJ·mol−1。
部分化学键键能如下表所示:
回答下列问题:
(1)NO中氮氧键键能为_______ 。
(2)向2L刚性密闭容器中充入0.06molNO(g)和0.04molNH3(g),发生反应i.不同温度下,测得10min时NO的转化率如图1所示。

①T1K下反应i的平均反应速率v(NO)=_______ mol·L-1·min-1(用含α1的代数式表示);
②NH3和NO(g)的有效碰撞几率M_______ N(填“>”“=”或“<”)原因为_______ ;
③NO转化率先升高后降低的原因为_______ ;
(3)固氮在工农业生产中具有重要意义:
①反应i是工业固氮的反应原理合成氨的速率公式为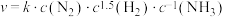 。其中k为反应速率常数:下列条件能影响k值大小的是
。其中k为反应速率常数:下列条件能影响k值大小的是_______ (填选项字母)
A.反应温度 B.反应物的浓度 C.反应压强 D.催化剂
②某固氮反应机理如图2所示:
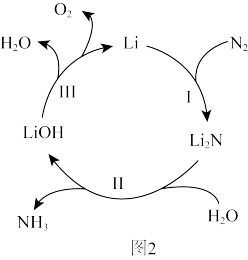
该固氮的总反应方程式为_______ ;已知三步反应的活化能由大到小的顺序为Ⅲ>Ⅰ>Ⅱ则该固氮过程的决速步骤为_______ (填“I”“Ⅱ”或“Ⅲ”);
已知:反应i. 6NO(g)+4NH3(g)⇌5N2(g)+6H2O(g) ΔH1=−1808kJ·mol−1;
反应ii. N2(g)+3H2(g)⇌2NH3(g) ΔH2=−91.4kJ·mol−1。
部分化学键键能如下表所示:
| 化学键 | N—H |  | H—O |
| 键能/ kJ·mol−1 | 390 | 946 | 463 |
(1)NO中氮氧键键能为
(2)向2L刚性密闭容器中充入0.06molNO(g)和0.04molNH3(g),发生反应i.不同温度下,测得10min时NO的转化率如图1所示。

①T1K下反应i的平均反应速率v(NO)=
②NH3和NO(g)的有效碰撞几率M
③NO转化率先升高后降低的原因为
(3)固氮在工农业生产中具有重要意义:
①反应i是工业固氮的反应原理合成氨的速率公式为
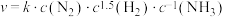 。其中k为反应速率常数:下列条件能影响k值大小的是
。其中k为反应速率常数:下列条件能影响k值大小的是A.反应温度 B.反应物的浓度 C.反应压强 D.催化剂
②某固氮反应机理如图2所示:

该固氮的总反应方程式为
您最近一年使用:0次
名校
5 . 为早日实现“碳达峰”、“碳中和”,我国科学家利用 作为催化剂,实现了常温下
作为催化剂,实现了常温下 加氢制
加氢制 ,主反应为
,主反应为
 ,伴随发生副反应
,伴随发生副反应
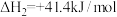
(1)已知
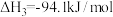 ,则
,则
_______  。
。
(2)在恒温恒容的密闭容器中,加入 和
和 ,同时发生主、副反应。体系中
,同时发生主、副反应。体系中 的选择性(指转化为
的选择性(指转化为 的
的 占发生反应的
占发生反应的 的百分比)随温度、压强的变化曲线如图所示:
的百分比)随温度、压强的变化曲线如图所示:

①
_______  。
。
② 的选择性随温度升高而降低的原因可能是
的选择性随温度升高而降低的原因可能是_______ 。
③下列说法正确的是_______ 。
A.增大压强,体系中副反应平衡逆向移动
B.体系中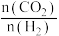 不再变化,代表反应达到平衡
不再变化,代表反应达到平衡
C.及时分离出 可以加快主反应的反应速率
可以加快主反应的反应速率
D.更换合适的催化剂可提高 的选择性
的选择性
④某温度下,若容器体积为1L,40min后,2个反应均达到平衡,此时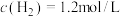 ,
, ,则
,则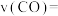
_______  ,主反应的平衡常数的计算式为
,主反应的平衡常数的计算式为_______ ,此时 的选择性为
的选择性为_______ (保留3位有效数字)。
(3)我国某研究团队发现,当选用某种Cu作催化剂时,主反应的中间体为 。此时反应分为两步:
。此时反应分为两步:
第一步:
第二步:
其中第一步的反应历程如下图所示(*表示吸附态,即该物种吸附在催化剂表面)
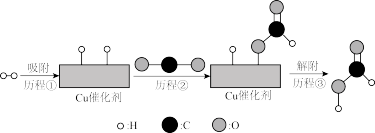
历程①: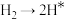
历程②:_______ (写方程式);
历程③:
我国科学家发现利用太阳能驱动 转化也可以实现上述第一步反应,原理如图所示:
转化也可以实现上述第一步反应,原理如图所示:
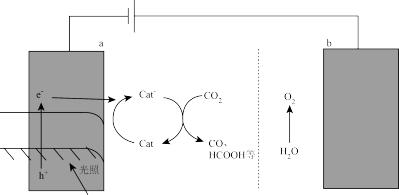
a的电极反应式为_______ ,该装置能量转化的主要形式是_______ 。
 作为催化剂,实现了常温下
作为催化剂,实现了常温下 加氢制
加氢制 ,主反应为
,主反应为
 ,伴随发生副反应
,伴随发生副反应
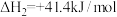
(1)已知

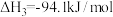 ,则
,则
 。
。(2)在恒温恒容的密闭容器中,加入
 和
和 ,同时发生主、副反应。体系中
,同时发生主、副反应。体系中 的选择性(指转化为
的选择性(指转化为 的
的 占发生反应的
占发生反应的 的百分比)随温度、压强的变化曲线如图所示:
的百分比)随温度、压强的变化曲线如图所示:
①

 。
。②
 的选择性随温度升高而降低的原因可能是
的选择性随温度升高而降低的原因可能是③下列说法正确的是
A.增大压强,体系中副反应平衡逆向移动
B.体系中
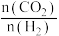 不再变化,代表反应达到平衡
不再变化,代表反应达到平衡C.及时分离出
 可以加快主反应的反应速率
可以加快主反应的反应速率D.更换合适的催化剂可提高
 的选择性
的选择性④某温度下,若容器体积为1L,40min后,2个反应均达到平衡,此时
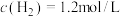 ,
, ,则
,则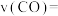
 ,主反应的平衡常数的计算式为
,主反应的平衡常数的计算式为 的选择性为
的选择性为(3)我国某研究团队发现,当选用某种Cu作催化剂时,主反应的中间体为
 。此时反应分为两步:
。此时反应分为两步:第一步:

第二步:

其中第一步的反应历程如下图所示(*表示吸附态,即该物种吸附在催化剂表面)

历程①:
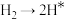
历程②:
历程③:

我国科学家发现利用太阳能驱动
 转化也可以实现上述第一步反应,原理如图所示:
转化也可以实现上述第一步反应,原理如图所示:
a的电极反应式为
您最近一年使用:0次
2022-10-29更新
|
437次组卷
|
3卷引用:青海师范大学附属实验中学2022-2023学年高三上学期12月月考化学试题
6 . 实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),如图表示该反应过程中能量(单位为kJ·mol-1)的变化:

(1)关于该反应的下列说法中,正确的是___________(填字母)。
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
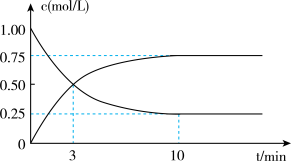
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH)=___________ ;H2的转化率w(H2) =___________ 。
②该反应的平衡常数表达式K=___________ 。
③下列措施中能使化学平衡向正反应方向移动的是___________ (填字母)。
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l molCO2和4 molH2
(3)25℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式:___________ 。

(1)关于该反应的下列说法中,正确的是___________(填字母)。
| A.∆H>0,∆S>0 | B.∆H>0,∆S<0 |
| C.∆H<0,∆S<0 | D.∆H<0,∆S>0 |

①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH)=
②该反应的平衡常数表达式K=
③下列措施中能使化学平衡向正反应方向移动的是
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l molCO2和4 molH2
(3)25℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式:
您最近一年使用:0次
7 . 烯烃是重要的化工原料。回答下列问题:
(1)在浓硫酸的作用下,2—丁醇发生消去反应:
① (l)
(l)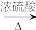 CH3CH2CH=CH2(1-丁烯,g)+H2O(g) ΔH1
CH3CH2CH=CH2(1-丁烯,g)+H2O(g) ΔH1
② (l)
(l)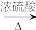 CH3CH=CHCH3(2-丁烯,g)+H2O(g) ΔH2
CH3CH=CHCH3(2-丁烯,g)+H2O(g) ΔH2
则1—丁烯转化为2—丁烯的热化学方程式为___________ 。
(2)某温度下,向一体积为10L的恒容密闭容器中充入1mol溴蒸气和1mol1—丁烯,发生反应:CH3CH2CH=CH2(g)+Br2(g) CH2=CHCH=CH2(g)+2HBr(g) △H>0,10min后,反应达到平衡,此时容器中物质的总物质的量为2.5mol。
CH2=CHCH=CH2(g)+2HBr(g) △H>0,10min后,反应达到平衡,此时容器中物质的总物质的量为2.5mol。
①达到平衡后,欲增大CH2=CHCH=CH2的产率,可采取的措施为___________ 。
②平衡时,溴蒸气的转化率为___________ ,0~10min内,v(HBr)=___________ mol·L·min-1。
③该温度下,反应的平衡常数K=___________ 。
(3)1,3—丁二烯在苯溶液中能发生聚合反应生成二聚体,该反应为可逆反应。不同温度下,溶液中1,3—丁二烯的浓度与反应时间的关系如图所示,下列说法正确的是___________(填标号)。

(4)工业上用电解丁醛的方法制备1—丁醇和丁酸的总反应为2CH3CH2CH2CHO+H2O CH3CH2CH2COOH+CH3CH2CH2CH2OH,电解装置示意图如图,阴极的电极反应式为
CH3CH2CH2COOH+CH3CH2CH2CH2OH,电解装置示意图如图,阴极的电极反应式为___________ ,生成的a为___________ (填名称)。

(1)在浓硫酸的作用下,2—丁醇发生消去反应:
①
 (l)
(l)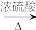 CH3CH2CH=CH2(1-丁烯,g)+H2O(g) ΔH1
CH3CH2CH=CH2(1-丁烯,g)+H2O(g) ΔH1②
 (l)
(l)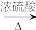 CH3CH=CHCH3(2-丁烯,g)+H2O(g) ΔH2
CH3CH=CHCH3(2-丁烯,g)+H2O(g) ΔH2则1—丁烯转化为2—丁烯的热化学方程式为
(2)某温度下,向一体积为10L的恒容密闭容器中充入1mol溴蒸气和1mol1—丁烯,发生反应:CH3CH2CH=CH2(g)+Br2(g)
 CH2=CHCH=CH2(g)+2HBr(g) △H>0,10min后,反应达到平衡,此时容器中物质的总物质的量为2.5mol。
CH2=CHCH=CH2(g)+2HBr(g) △H>0,10min后,反应达到平衡,此时容器中物质的总物质的量为2.5mol。①达到平衡后,欲增大CH2=CHCH=CH2的产率,可采取的措施为
②平衡时,溴蒸气的转化率为
③该温度下,反应的平衡常数K=
(3)1,3—丁二烯在苯溶液中能发生聚合反应生成二聚体,该反应为可逆反应。不同温度下,溶液中1,3—丁二烯的浓度与反应时间的关系如图所示,下列说法正确的是___________(填标号)。

| A.T1>T2 |
| B.c点的正反应速率小于c点的逆反应速率 |
| C.a点的正反应速率大于b点的逆反应速率 |
| D.b点时二聚体的浓度为0.45mol·L-1 |
 CH3CH2CH2COOH+CH3CH2CH2CH2OH,电解装置示意图如图,阴极的电极反应式为
CH3CH2CH2COOH+CH3CH2CH2CH2OH,电解装置示意图如图,阴极的电极反应式为
您最近一年使用:0次
2022-01-08更新
|
253次组卷
|
2卷引用:青海省海东市2022届高考一模理科综合化学试题
8 . 碘及其化合物在生产、生活和科技等方面都有着重要的应用。回答下列问题:
(1)已知:①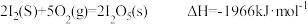
②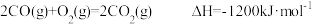
则 的
的
_______ 。
(2)碘不易溶于水,但易溶于碘化钾溶液并生成多碘离子,反应如下:①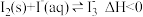 ;②
;②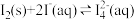 。温度降低时,反应①的平衡常数将
。温度降低时,反应①的平衡常数将_______ (填“增大”“减小”或“不变”);反应②的平衡常数的表达式为K=_______ 。
(3)碘与钨在一定温度下,可发生如下可逆反应: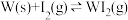 。现准确称取
。现准确称取 碘和
碘和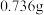 金属钨放置于
金属钨放置于 的密闭容器中,并加热使其反应。如图是混合气体中的
的密闭容器中,并加热使其反应。如图是混合气体中的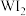 蒸气的物质的量随时间变化关系的图象
蒸气的物质的量随时间变化关系的图象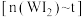 ,其中曲线Ⅰ(
,其中曲线Ⅰ( 时间段)的反应温度为
时间段)的反应温度为 ,曲线Ⅱ(从
,曲线Ⅱ(从 时刻开始)的反应温度为
时刻开始)的反应温度为 。
。
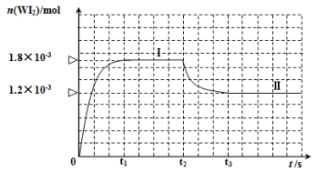
①该反应
_______ 0(填“>”或“<”);判断理由是_______ 。
②反应从开始到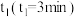 时间内
时间内 的平均反应速率
的平均反应速率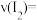
_______ 。
③能够说明上述反应已经达到平衡状态的有_______ (填选项字母)。
A. 与
与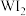 的浓度相等B.容器内各气体的浓度不再改变
的浓度相等B.容器内各气体的浓度不再改变
C.容器内混合气体的密度不再改变D.容器内气体压强不发生改变
(1)已知:①
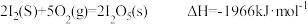
②
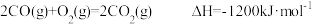
则
 的
的
(2)碘不易溶于水,但易溶于碘化钾溶液并生成多碘离子,反应如下:①
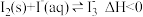 ;②
;②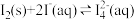 。温度降低时,反应①的平衡常数将
。温度降低时,反应①的平衡常数将(3)碘与钨在一定温度下,可发生如下可逆反应:
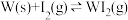 。现准确称取
。现准确称取 碘和
碘和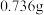 金属钨放置于
金属钨放置于 的密闭容器中,并加热使其反应。如图是混合气体中的
的密闭容器中,并加热使其反应。如图是混合气体中的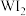 蒸气的物质的量随时间变化关系的图象
蒸气的物质的量随时间变化关系的图象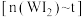 ,其中曲线Ⅰ(
,其中曲线Ⅰ( 时间段)的反应温度为
时间段)的反应温度为 ,曲线Ⅱ(从
,曲线Ⅱ(从 时刻开始)的反应温度为
时刻开始)的反应温度为 。
。
①该反应

②反应从开始到
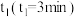 时间内
时间内 的平均反应速率
的平均反应速率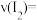
③能够说明上述反应已经达到平衡状态的有
A.
 与
与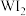 的浓度相等B.容器内各气体的浓度不再改变
的浓度相等B.容器内各气体的浓度不再改变C.容器内混合气体的密度不再改变D.容器内气体压强不发生改变
您最近一年使用:0次
名校
解题方法
9 . 根据题意完成下列问题:
(1)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g) CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:_______________________________________ 。
(2)随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NO x、SO2、CO等大气污染气体的处理具有重要意义。用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①则从反应开始到20min时,以NO表示的平均反应速率=________ ,该温度下该反应的平衡常数K=____ (保留两位小数)
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是_____ (写一条即可)。
③下列描述中能说明上述反应已达平衡的是__________ ;
A、容器内气体的平均摩尔质量保持不变
B、2v(NO)正=v(N2)逆
C、容器中气体的压强保持不变
D、单位时间内生成nmolCO2的同时生成2nmolNO
(3)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-, 而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为_______________
(4)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。
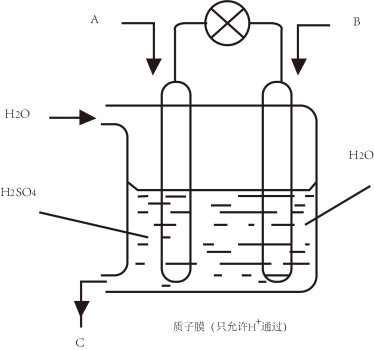
若A为SO2,B为O2,C为H2SO4,则负极反应式为_______________________________ ,电池总反应式为________________________ 。
(1)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)
 CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:
(2)随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NO x、SO2、CO等大气污染气体的处理具有重要意义。用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g)
 N2(g)+CO2(g)。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:| 浓度/mol·L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
①则从反应开始到20min时,以NO表示的平均反应速率=
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是
③下列描述中能说明上述反应已达平衡的是
A、容器内气体的平均摩尔质量保持不变
B、2v(NO)正=v(N2)逆
C、容器中气体的压强保持不变
D、单位时间内生成nmolCO2的同时生成2nmolNO
(3)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-, 而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为
(4)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。

若A为SO2,B为O2,C为H2SO4,则负极反应式为
您最近一年使用:0次
2018-09-28更新
|
934次组卷
|
5卷引用:【全国百强校】青海省西宁市第四高级中学2019届高三上学期第一次模拟考试理科综合化学试题
10 . 减少工业和生活废弃物的排放并合理开发利用,近年来受到了人们的普遍关注。
Ⅰ.利用工业废水中的CO2制取甲醇,反应为CO2+3H2 CH3OH+H2O。
CH3OH+H2O。
(1)已知下列反应的能量变化如图所示:
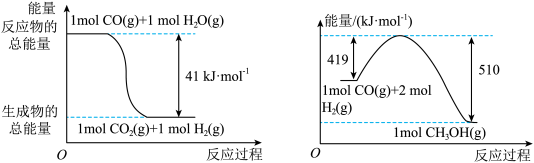
由二氧化碳和氢气制备甲醇的热化学方程式为____________________________ 。
Ⅱ.利用工业废气CO合成甲醇,反应为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
(2)一定条件下,在1 L密闭容器中充入0.6 mol CO和1.4 mol H2,8 min后达到平衡,CO的转化率为50%,则8 min内H2的平均反应速率为__________________ 。
(3)若反应原料是来自煤的气化,已知该反应的平衡常数表达式为K=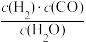 ,每生成1 mol H2需要吸收131.3 kJ的热量。写出该反应的热化学方程式
,每生成1 mol H2需要吸收131.3 kJ的热量。写出该反应的热化学方程式____________________________ 。
(4)T ℃时,能发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g)。已知反应平衡常数为400,此温度下,在1 L密闭容器中加入一定量的甲醇,反应到某时刻测得各组分的物质的量浓度如表:
CH3OCH3(g)+H2O(g)。已知反应平衡常数为400,此温度下,在1 L密闭容器中加入一定量的甲醇,反应到某时刻测得各组分的物质的量浓度如表:
此刻正、逆反应速率的关系是v(正)_______ (填“>”、“<”或“=”)v(逆),平衡时c(CH3OCH3)是___________ 。
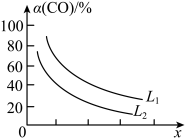
(5)已知反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g),CO的平衡转化率α(CO)与温度、压强的关系如图所示。图中X表示
CH3OCH3(g)+CO2(g),CO的平衡转化率α(CO)与温度、压强的关系如图所示。图中X表示_________ (填“温度”或“压强”),判断的理由是_______________________ 。
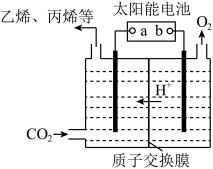
(6)强酸性电解质溶液中,用惰性电极电解CO2可转化为多种燃料,其原理如图所示。b为电源的_____ 极。电解时,生成乙烯的电极反应式为_________________________ 。
Ⅰ.利用工业废水中的CO2制取甲醇,反应为CO2+3H2
 CH3OH+H2O。
CH3OH+H2O。(1)已知下列反应的能量变化如图所示:

由二氧化碳和氢气制备甲醇的热化学方程式为
Ⅱ.利用工业废气CO合成甲醇,反应为CO(g)+2H2(g)
 CH3OH(g)。
CH3OH(g)。(2)一定条件下,在1 L密闭容器中充入0.6 mol CO和1.4 mol H2,8 min后达到平衡,CO的转化率为50%,则8 min内H2的平均反应速率为
(3)若反应原料是来自煤的气化,已知该反应的平衡常数表达式为K=
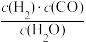 ,每生成1 mol H2需要吸收131.3 kJ的热量。写出该反应的热化学方程式
,每生成1 mol H2需要吸收131.3 kJ的热量。写出该反应的热化学方程式(4)T ℃时,能发生反应:2CH3OH(g)
 CH3OCH3(g)+H2O(g)。已知反应平衡常数为400,此温度下,在1 L密闭容器中加入一定量的甲醇,反应到某时刻测得各组分的物质的量浓度如表:
CH3OCH3(g)+H2O(g)。已知反应平衡常数为400,此温度下,在1 L密闭容器中加入一定量的甲醇,反应到某时刻测得各组分的物质的量浓度如表:| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol·L-1) | 0.46 | 1.0 | 1.0 |
此刻正、逆反应速率的关系是v(正)

(5)已知反应3CO(g)+3H2(g)
 CH3OCH3(g)+CO2(g),CO的平衡转化率α(CO)与温度、压强的关系如图所示。图中X表示
CH3OCH3(g)+CO2(g),CO的平衡转化率α(CO)与温度、压强的关系如图所示。图中X表示
(6)强酸性电解质溶液中,用惰性电极电解CO2可转化为多种燃料,其原理如图所示。b为电源的
您最近一年使用:0次
2017-04-12更新
|
348次组卷
|
4卷引用:青海省西宁市2017届高三下学期复习检测一(一模)理综-化学试题
青海省西宁市2017届高三下学期复习检测一(一模)理综-化学试题(已下线)2019年5月1日 《每日一题》三轮复习-化学反应原理综合题(已下线)2019年5月16日 《每日一题》四轮复习——押高考化学第28题(1)新疆维吾尔自治区和田地区洛浦县2022-2023学年高二上学期11月期中考试化学试题



