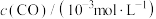名校
1 . 化学反应过程不仅发生了物质变化,还存在能量的变化,最主要的能量形式为热能和电能,根据题目要求回答以下问题:
(1)工业合成氨的反应 是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂,已知断裂1mol相应化学键需要的能量如下,若反应生成1.5mol
是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂,已知断裂1mol相应化学键需要的能量如下,若反应生成1.5mol  (g),可
(g),可___________ (填“吸收”或“放出”)热量___________ kJ。
(2)在100℃时,将0.4mol  放入2L的真空容器中发生反应:
放入2L的真空容器中发生反应: 。测得容器内气体的物质的量随时间变化如下表:
。测得容器内气体的物质的量随时间变化如下表:
①上述条件下。前20s内以 表示的平均化学反应速率为
表示的平均化学反应速率为___________ ;达到平衡状态时, 的转化率是
的转化率是___________ 。
②
___________  (填“>”、=”、“<”)。
(填“>”、=”、“<”)。
(3)铅蓄电池是常用的化学电源。汽车中的电瓶使用的就是铅酸电池,工作时电池总反应为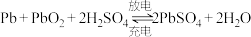 ,下列说法正确的是___________(请用相应字母填空)
,下列说法正确的是___________(请用相应字母填空)
(4)甲醇( )—空气燃料电池是一种高效能、轻污染的车载电池,以KOH为电解质溶液。通入氧气的电极为感料电池的
)—空气燃料电池是一种高效能、轻污染的车载电池,以KOH为电解质溶液。通入氧气的电极为感料电池的___________ (填“正”或“负”)极,负极发生的电极反应式为___________ 。
(1)工业合成氨的反应
 是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂,已知断裂1mol相应化学键需要的能量如下,若反应生成1.5mol
是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂,已知断裂1mol相应化学键需要的能量如下,若反应生成1.5mol  (g),可
(g),可| 化学键 | H—H | N—H | N≡N |
| 能量 | 436kJ | 391kJ | 946kJ |
 放入2L的真空容器中发生反应:
放入2L的真空容器中发生反应: 。测得容器内气体的物质的量随时间变化如下表:
。测得容器内气体的物质的量随时间变化如下表:| 时间/s | 0 | 20 | 40 | 60 | 80 |
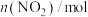 | 0.4 |  | 0.26 | 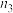 | 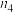 |
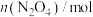 | 0 | 0.05 | 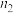 | 0.08 | 0.08 |
 表示的平均化学反应速率为
表示的平均化学反应速率为 的转化率是
的转化率是②
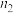
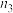 (填“>”、=”、“<”)。
(填“>”、=”、“<”)。(3)铅蓄电池是常用的化学电源。汽车中的电瓶使用的就是铅酸电池,工作时电池总反应为
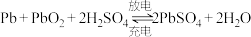 ,下列说法正确的是___________(请用相应字母填空)
,下列说法正确的是___________(请用相应字母填空)A.放电时,负极的电极反应式为: |
| B.放电时,正极附近溶液pH增大 |
| C.充电时,理论上每消耗30.3g硫酸铅,外电路中转移的电子为0.2mol |
| D.放电时,电池两电极的质量均增加 |
 )—空气燃料电池是一种高效能、轻污染的车载电池,以KOH为电解质溶液。通入氧气的电极为感料电池的
)—空气燃料电池是一种高效能、轻污染的车载电池,以KOH为电解质溶液。通入氧气的电极为感料电池的
您最近一年使用:0次
名校
2 . 反应 在四种不同情况下的反应速率如下,其中反应速率最快的是
在四种不同情况下的反应速率如下,其中反应速率最快的是
 在四种不同情况下的反应速率如下,其中反应速率最快的是
在四种不同情况下的反应速率如下,其中反应速率最快的是A. | B. |
C. | D. |
您最近一年使用:0次
3 . 将CO或CO2转化为高附加值化学品是颇具前景的合成路线。
(1)工业上用CO2和H2反应合成二甲醚。
已知:
 ;
;

 。
。
写出 和
和 转化为
转化为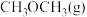 和
和 的热化学方程式:
的热化学方程式:_______________ ,该反应在________ (填“高温”或“低温”)条件下能自发进行。
(2)CO2催化加氢合成乙醇的反应原理为
 ,设m为起始时的投料比,即
,设m为起始时的投料比,即 。
。________________ 。
②图1右图表示在总压为5MPa的恒压条件下,且m=3时,平衡状态下各物质的物质的量分数与温度的关系,则曲线d代表的物质为________ (填化学式)。
(3)一种利用焦炉气中的H2和工业废气捕获的CO2生产绿色燃料甲醇的原理为 、
、 。
。
在研究该反应历程时发现,反应气中水蒸气含量会影响CH3OH的产率。为了研究水分子对该反应机制的内在影响,科学家利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响,如图3所示(吸附在催化剂表面上的物种用*标注)。________________ 。
②资料显示:水也可以使催化剂活化点位减少。结合资料、上图及学过的知识推测,在反应气中添加水蒸气将如何影响甲醇产率及产生这种影响的原因:________________ (任答两点)。
(4)一定条件下,利用CO2和H2还可制得甲烷: ,主要副反应为
,主要副反应为 。一定温度下,向恒容密闭容器中充入CO2和H2(物质的量之比为1:4)发生反应,容器内气体的压强随时间的变化如表所示:
。一定温度下,向恒容密闭容器中充入CO2和H2(物质的量之比为1:4)发生反应,容器内气体的压强随时间的变化如表所示:
①用单位时间内气体分压的变化表示反应 的速率,则前120min内CH4的平均反应速率
的速率,则前120min内CH4的平均反应速率
________ 。
②该温度下,平衡时CO的体积分数为8%,反应 的平衡常数
的平衡常数
________ ( 为以分压表示的平衡常数,保留小数点后2位)。
为以分压表示的平衡常数,保留小数点后2位)。
(1)工业上用CO2和H2反应合成二甲醚。
已知:

 ;
;
 。
。写出
 和
和 转化为
转化为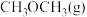 和
和 的热化学方程式:
的热化学方程式:(2)CO2催化加氢合成乙醇的反应原理为

 ,设m为起始时的投料比,即
,设m为起始时的投料比,即 。
。
②图1右图表示在总压为5MPa的恒压条件下,且m=3时,平衡状态下各物质的物质的量分数与温度的关系,则曲线d代表的物质为
(3)一种利用焦炉气中的H2和工业废气捕获的CO2生产绿色燃料甲醇的原理为
 、
、 。
。在研究该反应历程时发现,反应气中水蒸气含量会影响CH3OH的产率。为了研究水分子对该反应机制的内在影响,科学家利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响,如图3所示(吸附在催化剂表面上的物种用*标注)。

②资料显示:水也可以使催化剂活化点位减少。结合资料、上图及学过的知识推测,在反应气中添加水蒸气将如何影响甲醇产率及产生这种影响的原因:
(4)一定条件下,利用CO2和H2还可制得甲烷:
 ,主要副反应为
,主要副反应为 。一定温度下,向恒容密闭容器中充入CO2和H2(物质的量之比为1:4)发生反应,容器内气体的压强随时间的变化如表所示:
。一定温度下,向恒容密闭容器中充入CO2和H2(物质的量之比为1:4)发生反应,容器内气体的压强随时间的变化如表所示:时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 100 | 93.8 | 88.0 | 83.4 | 79.4 | 75.0 | 75.0 |
 的速率,则前120min内CH4的平均反应速率
的速率,则前120min内CH4的平均反应速率
②该温度下,平衡时CO的体积分数为8%,反应
 的平衡常数
的平衡常数
 为以分压表示的平衡常数,保留小数点后2位)。
为以分压表示的平衡常数,保留小数点后2位)。
您最近一年使用:0次
解题方法
4 . 利用 生产高能燃料和高附加值化学品,有利于实现碳资源的有效循环。
生产高能燃料和高附加值化学品,有利于实现碳资源的有效循环。
Ⅰ. 催化加氢合成甲醇是重要的碳捕获利用与封存技术,该过程主要发生如下反应:
催化加氢合成甲醇是重要的碳捕获利用与封存技术,该过程主要发生如下反应:
i
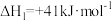
ii
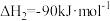
iii

回答下列问题:
(1)反应iii的
_______  。
。
(2)将 和
和 的混合气体充入一恒容密闭容器,加入催化剂发生反应。平衡时,
的混合气体充入一恒容密闭容器,加入催化剂发生反应。平衡时, 转化率、
转化率、 产率及
产率及 选择性随温度的变化如图。
选择性随温度的变化如图。
已知: 选择性
选择性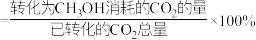
 平衡产率随温度变化的曲线为
平衡产率随温度变化的曲线为_______ (填“a”或“b”)。
②图中 转化率随温度升高而增大的原因可能是
转化率随温度升高而增大的原因可能是_______ 。
③已知反应i的正反应速率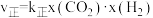 ,逆反应速率
,逆反应速率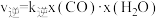 (
( 、
、 为速率常数,
为速率常数, 为物质的量分数)。
为物质的量分数)。 温度下,平衡时
温度下,平衡时 ,
, 温度下,平衡时
温度下,平衡时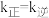 。由此推知,
。由此推知,
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
④原料气的平均相对分子质量为26,270℃时, 平衡产率为12.5%,反应i的
平衡产率为12.5%,反应i的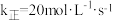 ,平衡时反应i的
,平衡时反应i的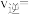
_______  (保留三位有效数字);反应ii的
(保留三位有效数字);反应ii的
_______ 。
Ⅱ. 催化加氢制备低碳烯烃(2~4个C的烯烃)
催化加氢制备低碳烯烃(2~4个C的烯烃)
某研究小组使用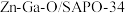 双功能催化剂实现了
双功能催化剂实现了 合成低碳烯烃,其可能的反应历程如图。
合成低碳烯烃,其可能的反应历程如图。 在
在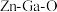 表面解离产生的
表面解离产生的 参与
参与 的还原过程,SAPO-34将催化生成的甲醇转化为低碳烯烃(
的还原过程,SAPO-34将催化生成的甲醇转化为低碳烯烃(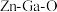 无催化活性,形成氧空位后有助于
无催化活性,形成氧空位后有助于 的活化)。
的活化)。
(3)理论上,反应历程中消耗的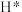 与
与 的物质的量之比为
的物质的量之比为_______ 。
(4)若原料气中 比例过低会减弱催化剂活性,原因是
比例过低会减弱催化剂活性,原因是_______ 。
 生产高能燃料和高附加值化学品,有利于实现碳资源的有效循环。
生产高能燃料和高附加值化学品,有利于实现碳资源的有效循环。Ⅰ.
 催化加氢合成甲醇是重要的碳捕获利用与封存技术,该过程主要发生如下反应:
催化加氢合成甲醇是重要的碳捕获利用与封存技术,该过程主要发生如下反应:i

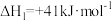
ii

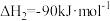
iii


回答下列问题:
(1)反应iii的

 。
。(2)将
 和
和 的混合气体充入一恒容密闭容器,加入催化剂发生反应。平衡时,
的混合气体充入一恒容密闭容器,加入催化剂发生反应。平衡时, 转化率、
转化率、 产率及
产率及 选择性随温度的变化如图。
选择性随温度的变化如图。已知:
 选择性
选择性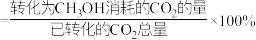

 平衡产率随温度变化的曲线为
平衡产率随温度变化的曲线为②图中
 转化率随温度升高而增大的原因可能是
转化率随温度升高而增大的原因可能是③已知反应i的正反应速率
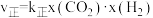 ,逆反应速率
,逆反应速率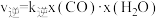 (
( 、
、 为速率常数,
为速率常数, 为物质的量分数)。
为物质的量分数)。 温度下,平衡时
温度下,平衡时 ,
, 温度下,平衡时
温度下,平衡时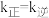 。由此推知,
。由此推知,
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。④原料气的平均相对分子质量为26,270℃时,
 平衡产率为12.5%,反应i的
平衡产率为12.5%,反应i的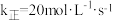 ,平衡时反应i的
,平衡时反应i的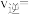
 (保留三位有效数字);反应ii的
(保留三位有效数字);反应ii的
Ⅱ.
 催化加氢制备低碳烯烃(2~4个C的烯烃)
催化加氢制备低碳烯烃(2~4个C的烯烃)某研究小组使用
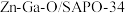 双功能催化剂实现了
双功能催化剂实现了 合成低碳烯烃,其可能的反应历程如图。
合成低碳烯烃,其可能的反应历程如图。 在
在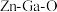 表面解离产生的
表面解离产生的 参与
参与 的还原过程,SAPO-34将催化生成的甲醇转化为低碳烯烃(
的还原过程,SAPO-34将催化生成的甲醇转化为低碳烯烃(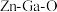 无催化活性,形成氧空位后有助于
无催化活性,形成氧空位后有助于 的活化)。
的活化)。
(3)理论上,反应历程中消耗的
 与
与 的物质的量之比为
的物质的量之比为(4)若原料气中
 比例过低会减弱催化剂活性,原因是
比例过低会减弱催化剂活性,原因是
您最近一年使用:0次
名校
5 . 回答下列问题:
I.硫酸是重要的化工原料,工业制硫酸的其中一步重要反应是
 放热反应
放热反应
一定条件下,恒容密闭容器中发生该反应,各物质浓度随时间变化的曲线如下图所示。 的平均反应速率为
的平均反应速率为_______ 。
(2)图中a点,正反应速率_______ 逆反应速率(填“>”“<”或“=”)。
(3)当反应达到平衡时, 的转化率为
的转化率为_______ %。
(4)下列能说明反应一定已达平衡的是_______(填标号)。
(5)下列说法错误的是_______(填标号)。
II.燃料电池能有效提高能源利用率。
(6)写出甲醇 空气燃料电池在碱性条件(KOH溶液)中的负极电极反应式
空气燃料电池在碱性条件(KOH溶液)中的负极电极反应式_______ 。
I.硫酸是重要的化工原料,工业制硫酸的其中一步重要反应是
 放热反应
放热反应一定条件下,恒容密闭容器中发生该反应,各物质浓度随时间变化的曲线如下图所示。

 的平均反应速率为
的平均反应速率为(2)图中a点,正反应速率
(3)当反应达到平衡时,
 的转化率为
的转化率为(4)下列能说明反应一定已达平衡的是_______(填标号)。
| A.混合气体的密度不再变化 | B. 质量保持不变 质量保持不变 |
C. | D. 、 、 和 和 的物质的量之比为2:1:2 的物质的量之比为2:1:2 |
(5)下列说法错误的是_______(填标号)。
| A.提高反应时的温度,正反应的速率加快,逆反应的速率减慢 |
B.提高反应时的温度,可以实现 的完全转化 的完全转化 |
| C.通过调控反应条件,可以提高该反应进行的程度 |
| D.使用催化剂是为了增大反应速率,提高生产效率 |
II.燃料电池能有效提高能源利用率。
(6)写出甲醇
 空气燃料电池在碱性条件(KOH溶液)中的负极电极反应式
空气燃料电池在碱性条件(KOH溶液)中的负极电极反应式
您最近一年使用:0次
6 .  时,向
时,向 的
的 溶液中一次性加入
溶液中一次性加入 的
的 溶液(混合溶液的体积近似等于所加溶液体积之和),发生反应
溶液(混合溶液的体积近似等于所加溶液体积之和),发生反应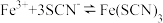 ,混合溶液中
,混合溶液中 与反应时间(t)的变化如图所示。下列说法错误的是
与反应时间(t)的变化如图所示。下列说法错误的是
 时,向
时,向 的
的 溶液中一次性加入
溶液中一次性加入 的
的 溶液(混合溶液的体积近似等于所加溶液体积之和),发生反应
溶液(混合溶液的体积近似等于所加溶液体积之和),发生反应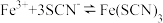 ,混合溶液中
,混合溶液中 与反应时间(t)的变化如图所示。下列说法错误的是
与反应时间(t)的变化如图所示。下列说法错误的是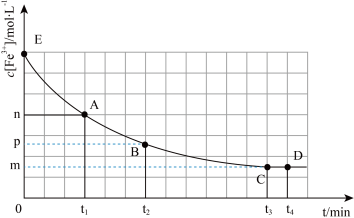
A.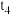 时向溶液中加入 时向溶液中加入 溶液,平衡逆向移动。 溶液,平衡逆向移动。 |
B.E点对应的坐标为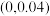 |
C. 过程中平均反应速率 过程中平均反应速率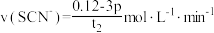 |
D.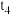 时加入少量 时加入少量 固体,溶液红色加深,说明上述反应是可逆反应 固体,溶液红色加深,说明上述反应是可逆反应 |
您最近一年使用:0次
名校
解题方法
7 . 氮的氧化物 是大气污染物之一,含有氮氧化物的尾气需处理后才能排放。
是大气污染物之一,含有氮氧化物的尾气需处理后才能排放。
(1) 能形成酸雨,写出
能形成酸雨,写出 溶于水生成
溶于水生成 的化学方程式:
的化学方程式:__________ 。
(2)NO和 可用NaOH溶液吸收,主要反应:
可用NaOH溶液吸收,主要反应: ,
,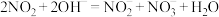 。将NO、
。将NO、 通入石灰乳中可制备重要的工业原料
通入石灰乳中可制备重要的工业原料 。该工艺需控制NO和
。该工艺需控制NO和 物质的量之比接近1∶1.若
物质的量之比接近1∶1.若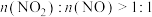 ,则会导致
,则会导致__________ ,若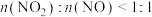 ,则会导致
,则会导致__________ 。
(3)在汽车尾气系统中,安装催化转化器可有效降低 的排放。实验室为了模拟反应
的排放。实验室为了模拟反应 在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用现代传感技术测得不同时间NO和CO的浓度如下表:
在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用现代传感技术测得不同时间NO和CO的浓度如下表:
①前2s的平均反应速率
____________ ,4s时NO的转化率为__________ 。
②若已知该反应的瞬时速率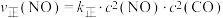 ,其中
,其中 为速率常数,
为速率常数,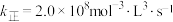 ,当NO的浓度变为原来的
,当NO的浓度变为原来的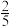 时,
时,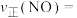
__________ 。
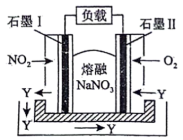
(4)由 、
、 、熔融盐
、熔融盐 组成的燃料电池如图所示,在使用过程中石墨Ⅰ电极反应生成氮的最高价氧化物Y。
组成的燃料电池如图所示,在使用过程中石墨Ⅰ电极反应生成氮的最高价氧化物Y。
①石墨Ⅱ电极为_____________ (填“正极”或“负极”)。
②写出石墨Ⅰ电极反应式_____________ 。
 是大气污染物之一,含有氮氧化物的尾气需处理后才能排放。
是大气污染物之一,含有氮氧化物的尾气需处理后才能排放。(1)
 能形成酸雨,写出
能形成酸雨,写出 溶于水生成
溶于水生成 的化学方程式:
的化学方程式:(2)NO和
 可用NaOH溶液吸收,主要反应:
可用NaOH溶液吸收,主要反应: ,
,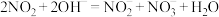 。将NO、
。将NO、 通入石灰乳中可制备重要的工业原料
通入石灰乳中可制备重要的工业原料 。该工艺需控制NO和
。该工艺需控制NO和 物质的量之比接近1∶1.若
物质的量之比接近1∶1.若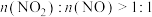 ,则会导致
,则会导致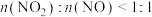 ,则会导致
,则会导致(3)在汽车尾气系统中,安装催化转化器可有效降低
 的排放。实验室为了模拟反应
的排放。实验室为了模拟反应 在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用现代传感技术测得不同时间NO和CO的浓度如下表:
在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用现代传感技术测得不同时间NO和CO的浓度如下表:时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| 10.00 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |

②若已知该反应的瞬时速率
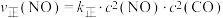 ,其中
,其中 为速率常数,
为速率常数,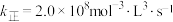 ,当NO的浓度变为原来的
,当NO的浓度变为原来的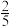 时,
时,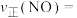
(4)由
 、
、 、熔融盐
、熔融盐 组成的燃料电池如图所示,在使用过程中石墨Ⅰ电极反应生成氮的最高价氧化物Y。
组成的燃料电池如图所示,在使用过程中石墨Ⅰ电极反应生成氮的最高价氧化物Y。①石墨Ⅱ电极为
②写出石墨Ⅰ电极反应式
您最近一年使用:0次
解题方法
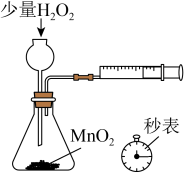
8 . 下列实验操作、装置和试剂均正确并能达到实验目的的是
|
|
| A.保存白磷 | B.测定 的分解速率 的分解速率 |
|
|
C. 含量滴定 含量滴定 | D.制取少量氯气 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
9 . 甲醛释氢对氢能源和含甲醛污水处理有重要意义。
(1) 电催化释氢
电催化释氢
催化电解含较低浓度的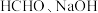 混合溶液,可获得
混合溶液,可获得 与
与 (如图所示)、其中电极b表面覆盖一种
(如图所示)、其中电极b表面覆盖一种 与P形成的化合物(晶胞结构如图所示)作催化剂。
与P形成的化合物(晶胞结构如图所示)作催化剂。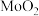 与
与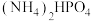 混合物与
混合物与 高温灼烧制得(反应中N元素化合价不变),该反应的化学方程式为
高温灼烧制得(反应中N元素化合价不变),该反应的化学方程式为___________ 。
②电解时,电极b上同时产生 与
与 的物质的量之比为
的物质的量之比为 、则电极b上的电极反应式为
、则电极b上的电极反应式为___________ ,此种情况下,电解过程中每产生 ,通过阴离子交换膜的
,通过阴离子交换膜的 为
为___________  。
。
(2) 水化释氧
水化释氧
45℃时,碱性条件下 作催化剂可将甲醛转化为
作催化剂可将甲醛转化为 ,反应的机理如图所示:
,反应的机理如图所示: 颗粒负载在
颗粒负载在 表面以防止纳米
表面以防止纳米 团聚,其他条件不变,反应相同时间,
团聚,其他条件不变,反应相同时间, 浓度对氢气产生快慢的影响如图所示:
浓度对氢气产生快慢的影响如图所示: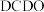 ,得到的氢气产物为
,得到的氢气产物为___________ (填化学式)。
②若 浓度过大,
浓度过大,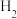 的产生迅速减慢的原因可能是
的产生迅速减慢的原因可能是___________ 。
(3)氢气在化学工业中应用广泛,一定条件下,在某恒容密闭容器中,按投料比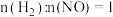 发生如下反应:
发生如下反应: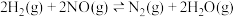
①下列能够说明该反应已达到化学平衡状态的是___________ (填标号)。
A. B.混合气体的密度不再变化
B.混合气体的密度不再变化
C.容器内总压强不再变化 D.混合气体的平均相对分子质量不再变化
②研究表明该反应速率方程式为 ,其中k为速率常数。与温度、活化能有关,若投料比
,其中k为速率常数。与温度、活化能有关,若投料比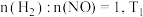 时的初始速率为
时的初始速率为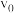 ,当
,当 转化率为
转化率为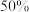 时,反应速率为
时,反应速率为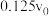 ,由此可知
,由此可知
___________ ;设此时反应的活化能为 ,不同温度
,不同温度 条件下对应的速率常数分别为
条件下对应的速率常数分别为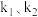 ,存在关系:
,存在关系: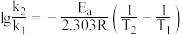 (R为常数),据此推测:升高一定温度,活化能越大,速率常数增大倍数
(R为常数),据此推测:升高一定温度,活化能越大,速率常数增大倍数___________ (填“越大”“越小”或“不变”)。
(1)
 电催化释氢
电催化释氢催化电解含较低浓度的
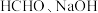 混合溶液,可获得
混合溶液,可获得 与
与 (如图所示)、其中电极b表面覆盖一种
(如图所示)、其中电极b表面覆盖一种 与P形成的化合物(晶胞结构如图所示)作催化剂。
与P形成的化合物(晶胞结构如图所示)作催化剂。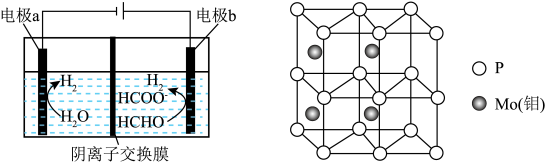
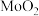 与
与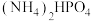 混合物与
混合物与 高温灼烧制得(反应中N元素化合价不变),该反应的化学方程式为
高温灼烧制得(反应中N元素化合价不变),该反应的化学方程式为②电解时,电极b上同时产生
 与
与 的物质的量之比为
的物质的量之比为 、则电极b上的电极反应式为
、则电极b上的电极反应式为 ,通过阴离子交换膜的
,通过阴离子交换膜的 为
为 。
。(2)
 水化释氧
水化释氧45℃时,碱性条件下
 作催化剂可将甲醛转化为
作催化剂可将甲醛转化为 ,反应的机理如图所示:
,反应的机理如图所示: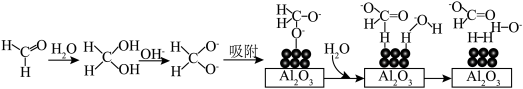
 颗粒负载在
颗粒负载在 表面以防止纳米
表面以防止纳米 团聚,其他条件不变,反应相同时间,
团聚,其他条件不变,反应相同时间, 浓度对氢气产生快慢的影响如图所示:
浓度对氢气产生快慢的影响如图所示: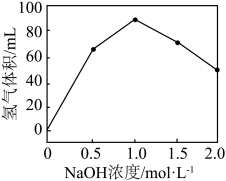
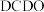 ,得到的氢气产物为
,得到的氢气产物为②若
 浓度过大,
浓度过大,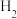 的产生迅速减慢的原因可能是
的产生迅速减慢的原因可能是(3)氢气在化学工业中应用广泛,一定条件下,在某恒容密闭容器中,按投料比
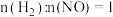 发生如下反应:
发生如下反应: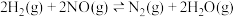
①下列能够说明该反应已达到化学平衡状态的是
A.
 B.混合气体的密度不再变化
B.混合气体的密度不再变化C.容器内总压强不再变化 D.混合气体的平均相对分子质量不再变化
②研究表明该反应速率方程式为
 ,其中k为速率常数。与温度、活化能有关,若投料比
,其中k为速率常数。与温度、活化能有关,若投料比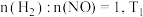 时的初始速率为
时的初始速率为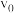 ,当
,当 转化率为
转化率为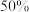 时,反应速率为
时,反应速率为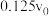 ,由此可知
,由此可知
 ,不同温度
,不同温度 条件下对应的速率常数分别为
条件下对应的速率常数分别为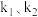 ,存在关系:
,存在关系: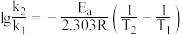 (R为常数),据此推测:升高一定温度,活化能越大,速率常数增大倍数
(R为常数),据此推测:升高一定温度,活化能越大,速率常数增大倍数
您最近一年使用:0次
10 .  具备高储氢密度和低成本优势,被认为是极具应用潜力的储氢材料。请回答:
具备高储氢密度和低成本优势,被认为是极具应用潜力的储氢材料。请回答:
(1) 通过水解反应可高效制氢,反应有:
通过水解反应可高效制氢,反应有:
反应1: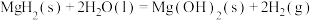
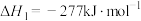
反应2: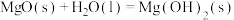
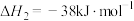
反应3:
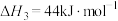
则: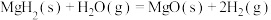

________ 
(2)等质量的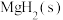 在不同环境下发生反应I的产氢率如下图所示:
在不同环境下发生反应I的产氢率如下图所示: 下发生水解,前3min放出
下发生水解,前3min放出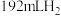 (已换算为标准状况),则水解反应中
(已换算为标准状况),则水解反应中 消耗速率为
消耗速率为________ 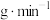 (计算结果保留3位小数)。
(计算结果保留3位小数)。
② 在
在 溶液中的产氢率明显快于纯水,已知该现象只与
溶液中的产氢率明显快于纯水,已知该现象只与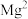 有关。
有关。 溶液能加快
溶液能加快 产氢速率的原因是
产氢速率的原因是________ 。
(3)在300-400℃和2.4~4MPa氢气压强下,Mg可与 反应:
反应: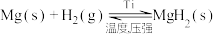 。
。
①恒容密闭容器中加入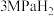 及足量
及足量 ,在四种温度下反应5min,
,在四种温度下反应5min, 的转化率如下表所示:
的转化率如下表所示:
400℃时,压强平衡常数
________  (
( 是用组分的平衡压强代替浓度而求得的平衡常数),下列说法正确的是
是用组分的平衡压强代替浓度而求得的平衡常数),下列说法正确的是________ (填序号)。
A.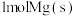 与
与 的总能量低于
的总能量低于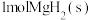 的能量
的能量
B.若在350℃下反应5min, 转化率大于50%
转化率大于50%
C.若360℃时反应持续至10min, 转化率增大
转化率增大
D.将 中的化学能转化为电能时,
中的化学能转化为电能时, 参与负极反应
参与负极反应
②贮氢合金中氢镁原子个数比为 ,当氢镁原子个数比为
,当氢镁原子个数比为 时恒温压缩容器,请画出气体压强p与x的变化曲线
时恒温压缩容器,请画出气体压强p与x的变化曲线_________ 。
 具备高储氢密度和低成本优势,被认为是极具应用潜力的储氢材料。请回答:
具备高储氢密度和低成本优势,被认为是极具应用潜力的储氢材料。请回答:(1)
 通过水解反应可高效制氢,反应有:
通过水解反应可高效制氢,反应有:反应1:
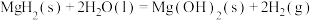
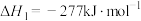
反应2:
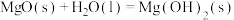
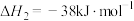
反应3:

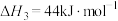
则:
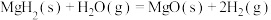


(2)等质量的
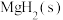 在不同环境下发生反应I的产氢率如下图所示:
在不同环境下发生反应I的产氢率如下图所示: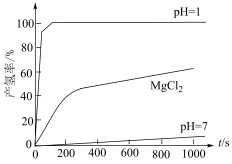
 下发生水解,前3min放出
下发生水解,前3min放出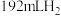 (已换算为标准状况),则水解反应中
(已换算为标准状况),则水解反应中 消耗速率为
消耗速率为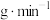 (计算结果保留3位小数)。
(计算结果保留3位小数)。②
 在
在 溶液中的产氢率明显快于纯水,已知该现象只与
溶液中的产氢率明显快于纯水,已知该现象只与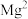 有关。
有关。 溶液能加快
溶液能加快 产氢速率的原因是
产氢速率的原因是(3)在300-400℃和2.4~4MPa氢气压强下,Mg可与
 反应:
反应: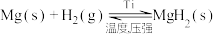 。
。①恒容密闭容器中加入
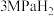 及足量
及足量 ,在四种温度下反应5min,
,在四种温度下反应5min, 的转化率如下表所示:
的转化率如下表所示:温度/℃ | 300 | 330 | 360 | 400 |
| 10% | 50% | 50% | 33.3% |

 (
( 是用组分的平衡压强代替浓度而求得的平衡常数),下列说法正确的是
是用组分的平衡压强代替浓度而求得的平衡常数),下列说法正确的是A.
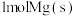 与
与 的总能量低于
的总能量低于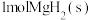 的能量
的能量B.若在350℃下反应5min,
 转化率大于50%
转化率大于50%C.若360℃时反应持续至10min,
 转化率增大
转化率增大D.将
 中的化学能转化为电能时,
中的化学能转化为电能时, 参与负极反应
参与负极反应②贮氢合金中氢镁原子个数比为
 ,当氢镁原子个数比为
,当氢镁原子个数比为 时恒温压缩容器,请画出气体压强p与x的变化曲线
时恒温压缩容器,请画出气体压强p与x的变化曲线
您最近一年使用:0次