1 . 下列叙述正确的是
| A.测定中和热时,将NaOH溶液分次缓慢倒入装有盐酸的量热计中,搅拌测其温度 |
B. 在常温下能自发进行,则该反应的△H>0 在常温下能自发进行,则该反应的△H>0 |
| C.活化能越大,改变温度对反应速率的影响程度就越小 |
| D.工业合成氨使用催化剂,反应的△H不变,但可以提高平衡前某段时间N2的转化率 |
您最近一年使用:0次
2022-01-21更新
|
278次组卷
|
2卷引用:湖北省荆州中学2022-2023学年高二上学期期末考试化学试题
名校
2 . 下列说法错误的是
| A.某吸热反应能自发进行,因此该反应是熵增反应 |
B. 水溶液中含有 水溶液中含有 ,因此 ,因此 溶液不能存放于玻璃试剂瓶中 溶液不能存放于玻璃试剂瓶中 |
C.反应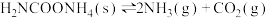 在恒温恒容密闭容器中进行,当混合气体的平均相对分子质量不变时,该反应达到化学平衡状态 在恒温恒容密闭容器中进行,当混合气体的平均相对分子质量不变时,该反应达到化学平衡状态 |
D.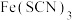 溶液中加入固体 溶液中加入固体 后颜色变深的原因可用勒夏特列原理来解释 后颜色变深的原因可用勒夏特列原理来解释 |
您最近一年使用:0次
2022-01-21更新
|
258次组卷
|
2卷引用:湖北省荆州中学2022-2023学年高二上学期期末考试化学试题
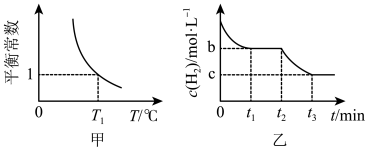
3 . 如图,向 的但容密闭装置中充入
的但容密闭装置中充入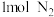 和
和 ,在温度维持在
,在温度维持在 时进行合成氨反应:
时进行合成氨反应: ,达到平衡后,在
,达到平衡后,在 时刻只改变一个条件,在
时刻只改变一个条件,在 时刻重新达到平衡。下列有关说法正确的是
时刻重新达到平衡。下列有关说法正确的是
 的但容密闭装置中充入
的但容密闭装置中充入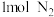 和
和 ,在温度维持在
,在温度维持在 时进行合成氨反应:
时进行合成氨反应: ,达到平衡后,在
,达到平衡后,在 时刻只改变一个条件,在
时刻只改变一个条件,在 时刻重新达到平衡。下列有关说法正确的是
时刻重新达到平衡。下列有关说法正确的是
| A.合成氨反应为放热反应,属于高温自发反应 |
B. 时刻, 时刻,  |
C. 时刻和 时刻和 时刻,平衡常数都等于1 时刻,平衡常数都等于1 |
D. 时刻的反应速率大于 时刻的反应速率大于 时刻的反应速率 时刻的反应速率 |
您最近一年使用:0次
名校
解题方法
4 . 在图甲中的A、B两容器里,分别收集着两种互不作用的理想气体。若将中间活塞打开(如图乙所示),两种气体分子立即都分布在两个容器中。这是一个不伴随能量变化的自发过程。关于此过程的下列说法不正确的是。
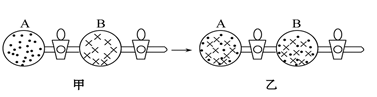

| A.此过程为混乱程度小向混乱程度大的方向的变化过程,即熵增大的过程 |
| B.此过程为自发过程,而且没有热量的吸收或放出 |
| C.此过程从有序到无序,混乱度增大 |
| D.此过程是自发可逆的 |
您最近一年使用:0次
2022-01-17更新
|
315次组卷
|
24卷引用:2014-2015学年湖北省枣阳市高级中学高二下学期期末化学试卷
2014-2015学年湖北省枣阳市高级中学高二下学期期末化学试卷湖北省部分高中联考协作体2021-2022学年高二上学期期中考试化学试题(已下线)同步君 选修4 第2章 第4节 化学反应进行的方向(已下线)2018年9月26日《每日一题》人教选修4-化学反应方向的判断人教版高二化学选修4 第二章 第四节 化学反应进行的方向练习题(已下线)2.2.1 化学反应的方向(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第1节 化学反应的方向高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第三节 化学反应的方向辽宁省联合校2020-2021学年高二上学期第一次月考化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第1节 化学反应的方向新疆生产建设兵团第四师第一中学2020-2021学年高二上学期期中考试化学试题人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第三节 化学反应的方向辽宁省大连市普兰店区第三十八中学2020-2021学年高二上学期期末考试化学试题(已下线)作业05 化学反应的方向-2021年高二化学暑假作业(人教版2019)选择性必修1(SJ)专题2第二单元课时1 化学反应的方向选择性必修1 专题2 第二单元 课时1 化学反应的方向(已下线)2.3 化学反应的方向(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)第05练 化学反应的方向-2022年【寒假分层作业】高二化学(人教版2019选择性必修1)(已下线)2.2.1 化学反应的方向(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)山东省德州市2020-2021学年高二上学期反应原理月考(A)化学试题(已下线)2.1 化学反应的方向-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)云南省文山州第一中学2021-2022学年高二下学期3月份考试化学试题2.2.1化学反应的方向 课中高中化学人教版 选修四 第二章 化学反应速率和化学平衡 第四节 化学反应进行的方向 化学反应进行的方向
名校
5 . 下列在常温下能自发进行的反应,既能用焓判据解释又能用熵判据解释的是
A. |
B. |
C. |
D. |
您最近一年使用:0次
2022-01-05更新
|
87次组卷
|
2卷引用:湖北省石首市第一中学2021-2022学年高二上学期10月月考化学试题
6 . 从下列事实所得出的解释或结论正确的是
| 选项 | 实验事实 | 解释或结论 |
| A | 2N2O5 (g)=4NO2 (g)+O2(g) ΔH>0在室温下能自发进行 | 这是一个熵减的反应 |
| B | 压缩针筒内的NO2和N2O4混合气体,颜色先变深后变浅 | 增大压强,平衡向生成N2O4的方向移动,新平衡比旧平衡压强小 |
| C | 锌与稀硫酸反应过程中,开始反应后速率逐渐增大 | 该反应是放热反应 |
| D | 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 | 反应物的浓度一定降低 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-12-13更新
|
142次组卷
|
2卷引用:湖北省十堰市2016-2017学年高二上学期期末调研考试化学试题
名校
7 . 以下说法中正确的是
A.已知: 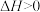 ,则该反应在任何条件都可以自发进行 ,则该反应在任何条件都可以自发进行 |
| B.对于有气体参加的可逆反应,加压可增大单位体积活化分子百分数,从而加快反应速率 |
| C.冰在室温下自动融化成水,是熵增的重要结果 |
| D.吸热反应都必须加热才能发生 |
您最近一年使用:0次
2021-12-09更新
|
401次组卷
|
4卷引用:湖北省武汉市新洲区第一中学2024届高二上学期12月诊断测试化学试题
湖北省武汉市新洲区第一中学2024届高二上学期12月诊断测试化学试题重庆市育才中学2021-2022学年度高二上学期期中测试化学试题重庆市万州第二高级中学2020-2021学年高二上学期期末考试化学试题(已下线)寒假作业04 化学反应的方向及调控-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)
解题方法
8 . 在某一恒压的密闭容器中,充入一定量的H2和CO2发生反应:
 。实验测得在不同温度下,反应体系中CO2的平衡转化率与压强的关系如图所示。回答下列问题:
。实验测得在不同温度下,反应体系中CO2的平衡转化率与压强的关系如图所示。回答下列问题:
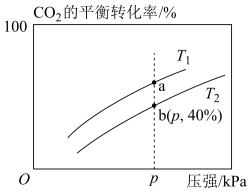
(1)经测得,每生成0.5molH2O(g)时,反应放出的热量为24.5kJ,则
_______ 。
(2)_______ (填“高温”或“低温”)有利于该反应自发进行,判断的理由是_______ 。
(3)判断平衡常数Ka与Kb的大小关系:Ka_______ Kb(填“<”、“>”或“=”)。
(4)在T2和p的条件下,往该容器中充入1.5molH2和0.5molCO2,该反应在第5min时达到平衡,此时容器的体积为2L。
①反应达到平衡时,c(CH3OH)=_______  ,H2O(g)的物质的量分数为
,H2O(g)的物质的量分数为_______ %。
②该反应在此温度下的平衡常数为_______ (保留两位有效数字)。
③反应达到平衡后,保持其他条件不变,再往该容器中充入0.1molH2和0.1molH2O(g),此时平衡_______ (填“向正反应方向”、“向逆反应方向”或“不”)移动。

 。实验测得在不同温度下,反应体系中CO2的平衡转化率与压强的关系如图所示。回答下列问题:
。实验测得在不同温度下,反应体系中CO2的平衡转化率与压强的关系如图所示。回答下列问题:
(1)经测得,每生成0.5molH2O(g)时,反应放出的热量为24.5kJ,则

(2)
(3)判断平衡常数Ka与Kb的大小关系:Ka
(4)在T2和p的条件下,往该容器中充入1.5molH2和0.5molCO2,该反应在第5min时达到平衡,此时容器的体积为2L。
①反应达到平衡时,c(CH3OH)=
 ,H2O(g)的物质的量分数为
,H2O(g)的物质的量分数为②该反应在此温度下的平衡常数为
③反应达到平衡后,保持其他条件不变,再往该容器中充入0.1molH2和0.1molH2O(g),此时平衡
您最近一年使用:0次
解题方法
9 . I.实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验。请完成下列填空:
(1)配制400mL0.10mol/LNaOH标准溶液,需要用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管、___________ 。
(2)取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下:
①量取待测溶液时,应用下图中的___________ (填“甲”或“乙”)量取。

②滴定达到终点的标志是___________ 。
③根据上述数据,可计算出该盐酸的浓度约为___________ (保留两位有效数字)。
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏低的有,___________ 。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
II.某温度(T)下的溶液中,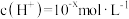 ,
,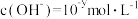 ,x与y的关系如图所示,请回答下列问题:
,x与y的关系如图所示,请回答下列问题:
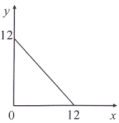
(3)此温度下,水的离子积Kw为______ ,则该温度T________ 25℃(填“>”“<”或“=”)。
(4)在此温度下,向 溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示:
溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示:
假设溶液混合前后的体积变化忽略不计,则a=______ ,实验②中由水电离产生的
___________  。
。
(5)在此温度下,将0.1 的
的 溶液与0.1
溶液与0.1 的
的 溶液按下表中甲、乙、丙、丁四种不同方式混合:
溶液按下表中甲、乙、丙、丁四种不同方式混合:
①按丁方式混合后,所得溶液显___________ (填“酸”“碱”或“中”)性。
②写出按乙方式混合反应的离子方程式:___________ 。
③按甲方式混合后所得溶液的pH为___________ 。
III.
(6)催化剂在一定条件下可直接光催化分解 ,发生反应:
,发生反应: ,该反应的
,该反应的
______ (填“>”或“<”,下同)0,
______ 0,在低温下,该反应_______ (填“能”或“不能”)自发进行。
(7)已知在100kPa、298K时石灰石分解反应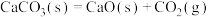 的△H>0、△S>0。
的△H>0、△S>0。
①常温下,该反应___________ (填“能”或“不能”自发进行。
②据本题反应数据分析温度___________ (填“能”或“不能”)成为反应进行方向的决定因素。
(1)配制400mL0.10mol/LNaOH标准溶液,需要用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管、
(2)取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下:
| 实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 24.02 | 20.00 |
| 2 | 0.10 | 24.18 | 20.00 |
| 3 | 0.10 | 24.10 | 20.00 |

②滴定达到终点的标志是
③根据上述数据,可计算出该盐酸的浓度约为
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏低的有,
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
II.某温度(T)下的溶液中,
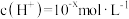 ,
,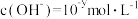 ,x与y的关系如图所示,请回答下列问题:
,x与y的关系如图所示,请回答下列问题:
(3)此温度下,水的离子积Kw为
(4)在此温度下,向
 溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示:
溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示:| 实验序号 |  溶液的体积/mL 溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |

 。
。(5)在此温度下,将0.1
 的
的 溶液与0.1
溶液与0.1 的
的 溶液按下表中甲、乙、丙、丁四种不同方式混合:
溶液按下表中甲、乙、丙、丁四种不同方式混合:| 甲 | 乙 | 丙 | 丁 | |
0.1  溶液体积/mL 溶液体积/mL | 10 | 10 | 10 | 10 |
0.1  溶液体积/mL 溶液体积/mL | 5 | 10 | 15 | 20 |
②写出按乙方式混合反应的离子方程式:
③按甲方式混合后所得溶液的pH为
III.
(6)催化剂在一定条件下可直接光催化分解
 ,发生反应:
,发生反应: ,该反应的
,该反应的

(7)已知在100kPa、298K时石灰石分解反应
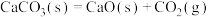 的△H>0、△S>0。
的△H>0、△S>0。①常温下,该反应
②据本题反应数据分析温度
您最近一年使用:0次
10 . 对于化学反应能否自发进行,下列说法错误的是
| A.需要加热才能够进行的反应肯定不是自发反应 |
B.若 , , ,则任何温度下都能自发进行 ,则任何温度下都能自发进行 |
C.若 , , ,则任何温度下都不能自发进行 ,则任何温度下都不能自发进行 |
| D.非自发反应在一定条件下可能变成自发反应 |
您最近一年使用:0次



