解题方法
1 . 我国在应对气候变化工作中取得显著成效,并向国际社会承诺2030年实现“碳达峰”,2060年实现“碳中和”。因此将CO2转化为高附加值化学品成为科学家研究的重要课题。工业上在Cu-ZnO催化下利用CO2发生如下反应Ⅰ生产甲醇,同时伴有反应Ⅱ发生。
Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2kJ∙mol-1
CO(g)+H2O(g) ΔH2=+41.2kJ∙mol-1
回答下列问题:
(1)①已知:CO(g)+2H2(g) CH3OH(g) ΔH2=-90.6kJ∙mol-1,则ΔH1为
CH3OH(g) ΔH2=-90.6kJ∙mol-1,则ΔH1为___________ 。
②一定条件下反应Ⅱ能自发进行原因是___________ 。
(2)向密闭容器中加入CO2(g)和H2(g)合成CH3OH(g)。已知反应Ⅰ的正反应速率可表示为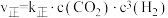 ,逆反应速率可表示为
,逆反应速率可表示为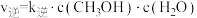 ,其中K正、K逆为速率常数。
,其中K正、K逆为速率常数。
①如图中能够代表k逆的曲线为___________ 。(填“L1”、“L2”、“L3”或“L4”)。
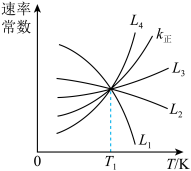
②温度为T1时,反应Ⅰ的化学平衡常数K=___________ 。
③对于上述反应体系,下列说法正确的是___________ 。
A.增大CO2的浓度,反应Ⅰ、Ⅱ的正反应速率均增加
B.加入催化剂,H2的平衡转化率不变
C.恒容密闭容器中当气体密度不变时,反应达到平衡状态
(3)不同条件下,按照n(CO2):n(H2)=1:3投料,CO2的平衡转化率如下图所示。
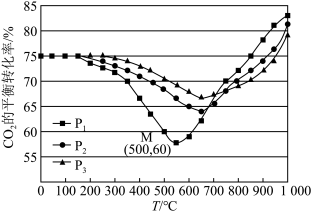
①压强P1、P2、P3由大到小的顺序是___________ ,在P1压强下,200℃~550℃时反应以___________ (填“Ⅰ”或“Ⅱ”)为主,原因是___________ 。
②压强为P2时,温度高于660℃之后,随着温度升高CO2平衡转化率增大的原因___________ 。
Ⅰ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1Ⅱ.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.2kJ∙mol-1
CO(g)+H2O(g) ΔH2=+41.2kJ∙mol-1回答下列问题:
(1)①已知:CO(g)+2H2(g)
 CH3OH(g) ΔH2=-90.6kJ∙mol-1,则ΔH1为
CH3OH(g) ΔH2=-90.6kJ∙mol-1,则ΔH1为②一定条件下反应Ⅱ能自发进行原因是
(2)向密闭容器中加入CO2(g)和H2(g)合成CH3OH(g)。已知反应Ⅰ的正反应速率可表示为
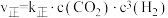 ,逆反应速率可表示为
,逆反应速率可表示为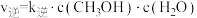 ,其中K正、K逆为速率常数。
,其中K正、K逆为速率常数。①如图中能够代表k逆的曲线为

②温度为T1时,反应Ⅰ的化学平衡常数K=
③对于上述反应体系,下列说法正确的是
A.增大CO2的浓度,反应Ⅰ、Ⅱ的正反应速率均增加
B.加入催化剂,H2的平衡转化率不变
C.恒容密闭容器中当气体密度不变时,反应达到平衡状态
(3)不同条件下,按照n(CO2):n(H2)=1:3投料,CO2的平衡转化率如下图所示。

①压强P1、P2、P3由大到小的顺序是
②压强为P2时,温度高于660℃之后,随着温度升高CO2平衡转化率增大的原因
您最近一年使用:0次
名校
2 . 有关下列图像的分析正确的是

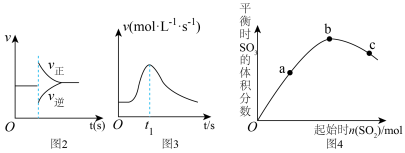


| A.图1所示图中的阴影部分面积的含义是某物质的物质的量的变化量 |
B.图2表示在N2 + 3H2  2NH3达到平衡后,减少NH3浓度时速率的变化 2NH3达到平衡后,减少NH3浓度时速率的变化 |
| C.图3表示铝片与稀硫酸反应的速率随反应时间变化的曲线,说明t1时刻溶液的温度最高 |
D.图4表示反应2SO2(g) +O2(g) 2SO3(g) △H<0 ,a、b、c三点中,a点时SO2的转化率最高 2SO3(g) △H<0 ,a、b、c三点中,a点时SO2的转化率最高 |
您最近一年使用:0次
名校
3 . 氯酸钾和亚硫酸氢钾溶液能发生氧化还原反应: 。已知该反应的速率随
。已知该反应的速率随 的增大而加快。如图为用
的增大而加快。如图为用 在单位时间内物质的量浓度变化表示的该反应
在单位时间内物质的量浓度变化表示的该反应 图。下列说法中不正确的是
图。下列说法中不正确的是
 。已知该反应的速率随
。已知该反应的速率随 的增大而加快。如图为用
的增大而加快。如图为用 在单位时间内物质的量浓度变化表示的该反应
在单位时间内物质的量浓度变化表示的该反应 图。下列说法中不正确的是
图。下列说法中不正确的是
A.反应开始时速率增大可能是 所致 所致 |
B.纵坐标为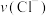 的 的 曲线与图中曲线完全重合 曲线与图中曲线完全重合 |
C.图中阴影部分的面积表示 时间内 时间内 的物质的量的减少量 的物质的量的减少量 |
| D.后期反应速率下降的主要原因是反应物浓度减少 |
您最近一年使用:0次
2023-06-08更新
|
568次组卷
|
5卷引用:广东省广州真光中学2021-2022学年高二上学期期中考试化学试题
名校
4 . 向恒温恒容的密闭容器中加入固体M(足量),发生反应:反应I为 、反应II为
、反应II为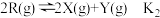 。反应经过t min达到平衡,此时测得
。反应经过t min达到平衡,此时测得 ,
,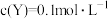 。下列说法不正确的是
。下列说法不正确的是
 、反应II为
、反应II为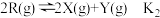 。反应经过t min达到平衡,此时测得
。反应经过t min达到平衡,此时测得 ,
,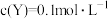 。下列说法不正确的是
。下列说法不正确的是A.反应I中,0~t min的平均反应速率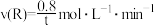 |
B.反应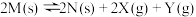 的平衡常数 的平衡常数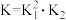 |
C.X(g)的体积分数为 |
| D.tmin后再加入一定量的M(s)和R(g),反应I的逆反应速率增大,平衡逆向移动 |
您最近一年使用:0次
2021-07-15更新
|
729次组卷
|
5卷引用:河南省2020-2021学年高二下学期期末考试化学试题
5 . 二氧化钛在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害。某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示。下列判断不正确的是
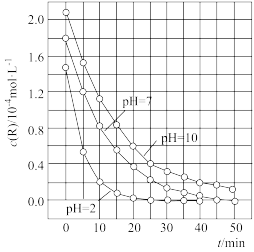

| A.在0~20min之间,pH=7时R的降解速率为7×10-6mol·L-1·min-1 |
| B.R的起始浓度不同,无法判断溶液的酸碱性对R的降解速率的影响 |
| C.在这三种pH条件下,二氧化钛对pH=2的R溶液催化降解效率最好 |
| D.在0~50 min之间,R的降解百分率pH=2等于pH=7 |
您最近一年使用:0次
2019-06-01更新
|
626次组卷
|
2卷引用:【校级联考】浙江省台州市联谊五校2018-2019学年高二下学期期中考试化学试题
名校
解题方法
6 . 二氧化钛在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害。某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示。下列判断正确的是
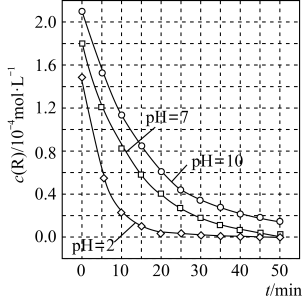

| A.在0~20min之间,pH=7时R的降解速率为0.07mol·L-1·min-1 |
| B.R的起始浓度不同,无法判断溶液的酸碱性对R的降解速率的影响 |
| C.二氧化钛对pH=2的R溶液催化效率好 |
| D.在0~50 min之间,R的降解百分率pH=2大于pH=7 |
您最近一年使用:0次
2019-03-22更新
|
1890次组卷
|
9卷引用:黑龙江省黑河市嫩江县高级中学2019-2020学年高二下学期第一次月考化学试题
黑龙江省黑河市嫩江县高级中学2019-2020学年高二下学期第一次月考化学试题(已下线)练习5 化学反应的方向与调控-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)河北省任丘一中2021-2022学年高二上学期阶段考试(一)化学试题第二章化学反应速率与化学平衡浙江省临海市白云高级中学2019届高三3月月考化学试题(已下线)第17讲 化学平衡计算与图像-2021年高考化学一轮复习名师精讲练(已下线)【省级联考】金丽衢十二校2018学年高三第三次联考化学试题广东省广大附中、铁一、广外三校2020-2021学年高一下学期期中联考化学试题广东省江门市蓬江区三校2020-2021学年高一下学期期中联考化学试题
名校
解题方法
7 . 我国煤炭资源丰富,通过煤的气化和液化。能使煤炭得以更广泛的应用。
I.先将煤转化为CO,再利用CO和水蒸气反应制取H2,反应为CO(g)+H2O(g)⇌CO2(g)+H2(g)
(1)向2L恒容密闭容器中充入CO和水蒸气,800℃时测得部分数据:
从反应开始到2min时,υ(H2)为___________________ ;该温度下反应的平衡常数K=__________ 。
(2)相同条件下,向2L恒容密闭容器中充入1molCO、3mol水蒸气、2molCO2、2mol H2,此时υ正____ υ逆(填“>”、“<”或“=”)。
II.利用CO生产燃料甲醇(CH3OH),一定条件下发生反应:CO(g)+2H2(g) CH3OH(g),图a表示反应中能量的变化,图b表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH的浓度随时间的变化:
CH3OH(g),图a表示反应中能量的变化,图b表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH的浓度随时间的变化:
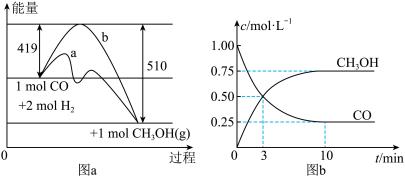
(1)在图a中,曲线_____ (填“a”或“b”)表示使用了催化剂;该反应属于_______ 反应(填“吸热”或“放热”);若保持其他条件不变,将反应体系升温,则该反应的平衡常数将______ (填“变大”、“变小”或“不变”)。
(2)下列说法正确的是_______ (填序号)。
① 起始充入的CO为2mol
② 增加CO浓度,CO的转化率增大
③ 当混合气体的密度不变时,反应达到平衡
④ 保持温度和容积不变,再充入2molCO和4mol H2,再次达平衡时 会减小
会减小
(3)若在相同情况下,最初向容器中充入____ mol CH3OH(g),可以达到上述同样的平衡状态。
(4)请在下图中画出平衡时甲醇的百分含量随压强的变化曲线,要求画温度不同的2条曲线(在曲线上标出T1、T2且T1<T2)。____________
 。
。
I.先将煤转化为CO,再利用CO和水蒸气反应制取H2,反应为CO(g)+H2O(g)⇌CO2(g)+H2(g)
(1)向2L恒容密闭容器中充入CO和水蒸气,800℃时测得部分数据:
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(CO)/mol | 0.80 | 0.64 | 0.50 | 0.20 | 0.20 |
| n(H2O)/mol | 1.20 | 1.04 | 0.90 | 0.60 | 0.60 |
从反应开始到2min时,υ(H2)为
(2)相同条件下,向2L恒容密闭容器中充入1molCO、3mol水蒸气、2molCO2、2mol H2,此时υ正
II.利用CO生产燃料甲醇(CH3OH),一定条件下发生反应:CO(g)+2H2(g)
 CH3OH(g),图a表示反应中能量的变化,图b表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH的浓度随时间的变化:
CH3OH(g),图a表示反应中能量的变化,图b表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH的浓度随时间的变化:
(1)在图a中,曲线
(2)下列说法正确的是
① 起始充入的CO为2mol
② 增加CO浓度,CO的转化率增大
③ 当混合气体的密度不变时,反应达到平衡
④ 保持温度和容积不变,再充入2molCO和4mol H2,再次达平衡时
 会减小
会减小(3)若在相同情况下,最初向容器中充入
(4)请在下图中画出平衡时甲醇的百分含量随压强的变化曲线,要求画温度不同的2条曲线(在曲线上标出T1、T2且T1<T2)。
 。
。
您最近一年使用:0次
8 . C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)目前工业上有一种方法是用CO,和H2在230℃,催化剂条件下转化生成甲醇蒸汽和水蒸气。
图一表示恒压容器中0.5molCO2和1.5molH2转化率达80%时的能量变化示意图。写出该反应的热化学方程式_____________ 。
(2) “亚硫酸盐法”吸收烟气中的SO2。室温条件下,将烟气通入(NH4)2SO4溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图二所示。

请写出a点时n(HSO3-):n(H2SO3)=______ ,b点时溶液pH=7,则n(NH4+):n(HSO3-)=___ 。
(3)催化氧化法去除NO,一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO 5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图三所示:
5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图三所示:
① 请写出N2的电子式________ 。
② 曲线c对应NH3与NO的物质的量之比是______ 。
③ 曲线a中NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____ mg/(m3·s)。
(4)间接电化学法可除NO。其原理如图四所示,写出电解池阴极的电极反应式(阴极室溶液呈酸性):_________________ 。
(1)目前工业上有一种方法是用CO,和H2在230℃,催化剂条件下转化生成甲醇蒸汽和水蒸气。
图一表示恒压容器中0.5molCO2和1.5molH2转化率达80%时的能量变化示意图。写出该反应的热化学方程式
(2) “亚硫酸盐法”吸收烟气中的SO2。室温条件下,将烟气通入(NH4)2SO4溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图二所示。

请写出a点时n(HSO3-):n(H2SO3)=
(3)催化氧化法去除NO,一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO
 5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图三所示:
5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图三所示:① 请写出N2的电子式
② 曲线c对应NH3与NO的物质的量之比是
③ 曲线a中NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为
(4)间接电化学法可除NO。其原理如图四所示,写出电解池阴极的电极反应式(阴极室溶液呈酸性):
您最近一年使用:0次
2017-06-01更新
|
429次组卷
|
2卷引用:【全国百强校】福建省厦门外国语学校2017-2018学年高二6月月考化学试题
名校
9 . 臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)已知①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g) ΔH1=+571.6 kJ·mol–1
②焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g) ΔH2=+131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH3=+206.1kJ·mol–1
则反应CH4(g)=C(s)+2H2(g)的ΔH=_______________ kJ·mol–1
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示。已知:O3的起始浓度为 0.0216 mol/L。
①pH增大能加速O3分解,表明对O3分解起催化作用的是____ 。
②在30 ℃、pH=4.0条件下,O3的分解速率为_____ mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________ (填字母)
a.40 ℃、pH=3.0 b.10 ℃、pH=4.0 c.30 ℃、pH=7.0

(3)O3可由臭氧发生器(原理如图)电解稀硫酸制得。
①图中阴极为____ (填“A或B”),
②若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况),则E处收集的气体中O3所占的体积分数为____ (用含x 、y的代数式表示)。(忽略O3的分解)
(1)已知①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g) ΔH1=+571.6 kJ·mol–1
②焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g) ΔH2=+131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH3=+206.1kJ·mol–1
则反应CH4(g)=C(s)+2H2(g)的ΔH=
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示。已知:O3的起始浓度为 0.0216 mol/L。
| pH t /min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
①pH增大能加速O3分解,表明对O3分解起催化作用的是
②在30 ℃、pH=4.0条件下,O3的分解速率为
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为
a.40 ℃、pH=3.0 b.10 ℃、pH=4.0 c.30 ℃、pH=7.0

(3)O3可由臭氧发生器(原理如图)电解稀硫酸制得。
①图中阴极为
②若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况),则E处收集的气体中O3所占的体积分数为
您最近一年使用:0次
10-11高二下·浙江杭州·期中
解题方法
10 . 材料1.某温度时,在2L密闭容器中有X、Y、Z三种气态物质。实验测得不同时刻各物质的量如下表所示,同时测得至3min时吸收热量75kJ。
(1)写出该反应的热化学反应方程式:______________________________ 。
(2)该温度下反应的平衡常数K=____________________ 。
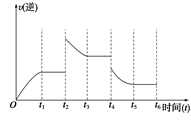
(3)若该反应的逆反应速率与时间的关系如上图所示,则:
① t2~t3时平衡向________ (填“正”或“逆”)反应方向移动。
②t4时被改变的外界条件是________ (选择一个正确选项)
A.升温 B.降温 C.降压 D.移去部分反应物 E.加入负催化剂
材料2.另有实验,利用镁与盐酸或醋酸在不同温度下反应,探究外界条件对反应速率的影响。部分实验用表如下:
(4)请完成上工作表(填写实验④⑤的空格)。
(5)上表实验①中,镁条消失的时间为20s。实验过程中,镁条剩余质量与时间关系图如图。
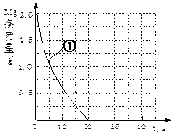
Ⅰ. 假设反应过程中盐酸体积不变,则要计算该反应的速率v(HCl),尚缺少的数据是___________ 。
Ⅱ.若反应温度每升高10℃,反应速率增大到原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在图中大致画出“实验②”、“实验④中醋酸实验”的镁条质量与时间关系曲线,并用②或④注明曲线代表的实验(假设实验中所用镁完全相同,且镁均能完全溶解)。______________
t/min | X/mol | Y/mol | Z/mol |
0 | 1.00 | 1.00 | 0.00 |
3 | 0.75 | 0.50 | 0.50 |
5 | 0.65 | 0.30 | 0.70 |
9 | 0.60 | 0.20 | 0.80 |
14 | 0.60 | 0.20 | 0.80 |
(1)写出该反应的热化学反应方程式:
(2)该温度下反应的平衡常数K=

(3)若该反应的逆反应速率与时间的关系如上图所示,则:
① t2~t3时平衡向
②t4时被改变的外界条件是
A.升温 B.降温 C.降压 D.移去部分反应物 E.加入负催化剂
材料2.另有实验,利用镁与盐酸或醋酸在不同温度下反应,探究外界条件对反应速率的影响。部分实验用表如下:
实验 编号 | 温度/K | 盐酸浓度 /mol•L-1 | 醋酸浓度/mol•L-1 | 实验目的 |
① | 298 | 0.20 | a.实验①和②,探究温度对反应速率的影响; b.实验①和③,探究浓度对反应速率的影响; c.实验④⑤,探究温度对镁与盐酸反应和镁与醋酸反应速率的影响,哪个更大一些. | |
② | 308 | 0.20 | ||
③ | 298 | 0.40 | ||
④ | 0.20 | |||
⑤ | 0.20 |
(4)请完成上工作表(填写实验④⑤的空格)。
(5)上表实验①中,镁条消失的时间为20s。实验过程中,镁条剩余质量与时间关系图如图。
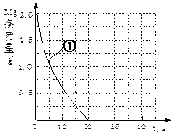
Ⅰ. 假设反应过程中盐酸体积不变,则要计算该反应的速率v(HCl),尚缺少的数据是
Ⅱ.若反应温度每升高10℃,反应速率增大到原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在图中大致画出“实验②”、“实验④中醋酸实验”的镁条质量与时间关系曲线,并用②或④注明曲线代表的实验(假设实验中所用镁完全相同,且镁均能完全溶解)。
您最近一年使用:0次



