名校
解题方法
1 . 将6 mol H2和3 mol CO充入容积为0.5 L的密闭容器中,进行如下反应:
2H2(g)+CO(g) CH3OH(g),6秒末时容器内压强为开始时的0.6倍。
CH3OH(g),6秒末时容器内压强为开始时的0.6倍。
试计算:(1)H2的反应速率是______
(2)CO的转化率为_____
2H2(g)+CO(g)
 CH3OH(g),6秒末时容器内压强为开始时的0.6倍。
CH3OH(g),6秒末时容器内压强为开始时的0.6倍。试计算:(1)H2的反应速率是
(2)CO的转化率为
您最近一年使用:0次
2016-12-09更新
|
765次组卷
|
10卷引用:四川省三台中学2016-2017学年高一下学期第二次月考(5月)化学试题
四川省三台中学2016-2017学年高一下学期第二次月考(5月)化学试题(已下线)2012-2013学年浙江省桐乡一中高二下学期期中考试化学试卷(已下线)2012-2013学年河北省石家庄市第一中学高一下学期期中考试化学试卷(已下线)2014届湖南浏阳一中高一下学期期中考试化学(理)试卷2016-2017学年陕西省西安中学高二上10月月考化学试卷安徽省蚌埠市第二中学2016-2017学年高一下学期期中考试化学试题山西省实验中学2017-2018学年高二上学期10月月考化学试题【全国百强校】江苏省启东中学2018-2019学年高一(创新班)上学期期中考试化学试题山西省实验中学2021-2022学年高二下学期开学分班素质测试化学试题河北省藁城新冀明中学2021-2022学年高二上学期10月月考化学试题
名校
解题方法
2 . T℃时,将3mol A和1mol B 气体通入体积为2 L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g)≒xC(g),2min时,反应达到平衡状态(温度不变),剩余0.8molB,并测得C的浓度为0.4mol/L,请回答下列问题:
(1)从开始反应至达到平衡状态,生成C的平均速率为____ 。
(2)x=____ 。
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡____ (填字母)。
A、向正反应方向移动 B、向逆反应方向移动 C、不移动
(4)若向原平衡混合物的容器中再充入a molC,在 T℃时达到新的平衡,此时B的物质的量为n(B)=____ mol。
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为____________ 。
(1)从开始反应至达到平衡状态,生成C的平均速率为
(2)x=
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡
A、向正反应方向移动 B、向逆反应方向移动 C、不移动
(4)若向原平衡混合物的容器中再充入a molC,在 T℃时达到新的平衡,此时B的物质的量为n(B)=
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为
您最近一年使用:0次
2016-12-09更新
|
1894次组卷
|
4卷引用:2014-2015四川省达州市大竹县文星中学高二3月月考化学试卷
2014-2015四川省达州市大竹县文星中学高二3月月考化学试卷(已下线)2012-2013学年湖北武汉部分重点中学高二上学期期末考试化学试卷山西省平遥中学2017-2018学年高二上学期期中考试化学试题鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 章末综合检测卷
11-12高二下·四川泸州·阶段练习
名校
3 . 在一个容积为500mL的密闭容器中,充入5mol H2和2 mol CO。在一定温度和一定压强下,发生如下反应在:2H2(g) +CO(g) CH3OH(g),经过5min后达到平衡状态。若此时测得容器内压强是起始时的
CH3OH(g),经过5min后达到平衡状态。若此时测得容器内压强是起始时的 ,求:(1)以H2的浓度变化表示的该反应的速率(2)达平衡时CO的转化率(3)该温度下的平衡常数K
,求:(1)以H2的浓度变化表示的该反应的速率(2)达平衡时CO的转化率(3)该温度下的平衡常数K
 CH3OH(g),经过5min后达到平衡状态。若此时测得容器内压强是起始时的
CH3OH(g),经过5min后达到平衡状态。若此时测得容器内压强是起始时的 ,求:(1)以H2的浓度变化表示的该反应的速率(2)达平衡时CO的转化率(3)该温度下的平衡常数K
,求:(1)以H2的浓度变化表示的该反应的速率(2)达平衡时CO的转化率(3)该温度下的平衡常数K
您最近一年使用:0次
2012·四川成都·二模
4 . 在恒温恒容条件下,向容积为2L的密闭容器中充入2. O mol SO2和2. O mol O2。已知: ,经2 min达到平衡状态,反应放热0. 25a kJ。下列判断正确的是
,经2 min达到平衡状态,反应放热0. 25a kJ。下列判断正确的是
 ,经2 min达到平衡状态,反应放热0. 25a kJ。下列判断正确的是
,经2 min达到平衡状态,反应放热0. 25a kJ。下列判断正确的是A.在1 min时: |
B.2 min内: |
| C.若再充入2mol SO3,达平衡时SO3%(质量分数)减小 |
| D.反应条件相同,若起始时向反应容器中充入2mol SO3,平衡时反应吸热0. 75a kJ |
您最近一年使用:0次
10-11高一下·四川雅安·期中
5 . 在1L容器中加入4 molA和4 molB发生3A(g)+B(g) 2C(g)的反应,如果A的平均反应速率为0·12mol/(L·s),则10 s时容器中的B是
2C(g)的反应,如果A的平均反应速率为0·12mol/(L·s),则10 s时容器中的B是
 2C(g)的反应,如果A的平均反应速率为0·12mol/(L·s),则10 s时容器中的B是
2C(g)的反应,如果A的平均反应速率为0·12mol/(L·s),则10 s时容器中的B是| A.2.8 mol | B.1.6 mol | C.3.2 mol | D.3.6 mol |
您最近一年使用:0次
6 . 在容积为1L的密闭容器中充入1mol CO和2mol H2混合气体,发生以下反应:
CO(g)+2H2(g) CH3OH(g)。T1、T2温度下,CH3OH的物质的量随着时间的变化关系如下图所示。下列有关说法正确的是
CH3OH(g)。T1、T2温度下,CH3OH的物质的量随着时间的变化关系如下图所示。下列有关说法正确的是

CO(g)+2H2(g)
 CH3OH(g)。T1、T2温度下,CH3OH的物质的量随着时间的变化关系如下图所示。下列有关说法正确的是
CH3OH(g)。T1、T2温度下,CH3OH的物质的量随着时间的变化关系如下图所示。下列有关说法正确的是
| A.T1>T2 |
| B.K(T1)>K(T2) |
| C.T1温度下达到平衡后,再充入一定量CO,CO的转化率增大 |
| D.T2温度下,0~10min间v(H2)=0.06mol·L-1·min-1 |
您最近一年使用:0次
10-11高二上·四川成都·期中
7 . 在体积为V L的密闭容器中进行如下反应:mA(g) + nB(g)="==pC" (g)+qD(g)。用A物质表示的平均反应速率为: mol /(L.min)。则t分钟时,D物质增加的物质的量是
mol /(L.min)。则t分钟时,D物质增加的物质的量是
 mol /(L.min)。则t分钟时,D物质增加的物质的量是
mol /(L.min)。则t分钟时,D物质增加的物质的量是A.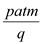 mol mol | B. mol mol | C. mol mol | D. mol mol |
您最近一年使用:0次
8 . 一定量的化合物A放入容积恒定的容器中,在一定条件下发生如下反应:
A(s) 2B(g) +C(g) 2C(g)
2B(g) +C(g) 2C(g) D(g) +3E(g) 。2分钟后,上述两个反应均达到平衡,测得υ(B)=0.2mol/(L.min),c(E)平=0.24mol/L.则c(C)平= mol/L.
D(g) +3E(g) 。2分钟后,上述两个反应均达到平衡,测得υ(B)=0.2mol/(L.min),c(E)平=0.24mol/L.则c(C)平= mol/L.
A(s)
 2B(g) +C(g) 2C(g)
2B(g) +C(g) 2C(g) D(g) +3E(g) 。2分钟后,上述两个反应均达到平衡,测得υ(B)=0.2mol/(L.min),c(E)平=0.24mol/L.则c(C)平= mol/L.
D(g) +3E(g) 。2分钟后,上述两个反应均达到平衡,测得υ(B)=0.2mol/(L.min),c(E)平=0.24mol/L.则c(C)平= mol/L.| A.0.04 | B.0.4 | C.0.2 | D.0.16 |
您最近一年使用:0次
9-10高二下·四川眉山·期末
9 . 向一个体积可变的密闭器中充入4molA、1molB,发生如下反应:
4A(g)+B(s) 3C(s)+4D(g)。在高温下达到平衡,测得混合气体中D的浓度为0.3mol·L-1。
3C(s)+4D(g)。在高温下达到平衡,测得混合气体中D的浓度为0.3mol·L-1。
请填写下列空白:
(1)若容器体积为10L,反应经2min达平衡,则以A物质浓度变化表示的化学反应率为
。
(2)若压缩容器增大压强,则逆反应的速率 ,容器中D的体积分数 。(填“增大”“减小”“不变”)
(3)若相对分子质量M(B)>3M(C),温度升高时混合气体的平均相对分子质量减少,则正反应 。(填“吸热”或“放热”)
(4)在最初的容器改充1.5molC、4.4molD温度保持不变,要使反应达平衡时D的浓度为0.6mol·L-1,则容器的体积是 L。
4A(g)+B(s)
 3C(s)+4D(g)。在高温下达到平衡,测得混合气体中D的浓度为0.3mol·L-1。
3C(s)+4D(g)。在高温下达到平衡,测得混合气体中D的浓度为0.3mol·L-1。请填写下列空白:
(1)若容器体积为10L,反应经2min达平衡,则以A物质浓度变化表示的化学反应率为
。
(2)若压缩容器增大压强,则逆反应的速率 ,容器中D的体积分数 。(填“增大”“减小”“不变”)
(3)若相对分子质量M(B)>3M(C),温度升高时混合气体的平均相对分子质量减少,则正反应 。(填“吸热”或“放热”)
(4)在最初的容器改充1.5molC、4.4molD温度保持不变,要使反应达平衡时D的浓度为0.6mol·L-1,则容器的体积是 L。
您最近一年使用:0次
2010·四川绵阳·一模
解题方法
10 . 金属单质及其化合物与工农业生产、日常生活有密切的联系。请回答下列问题:
(1)Fe2O3(s)+ C(s)=
C(s)= CO2(g)+2Fe(s) ΔH=+234KJ/mol
CO2(g)+2Fe(s) ΔH=+234KJ/mol
C(s)+O2(g)=CO2(g)ΔH=-393.5KJ/mol
则2Fe(s)+ O2(g)=Fe2O3(s)的ΔH是
O2(g)=Fe2O3(s)的ΔH是____________________
(2)一定温度下,氧化铁可以与一氧化碳发生如下反应:

①该温度时,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,5 min后,生成了单质铁11.2 g,则这段时间内CO的反应速率为_____________ ;
②达平衡后,若温度升高,CO的含量增大,则Q____ 0(填“>”、“=”、“<”)。
(3)工业常根据金属氢氧化物在酸中溶解度不同,通过控制溶液的pH,达到分离金属离子的目的。如是难溶金属的氢氧化物在不同pH下的溶解情况(s/mol·L-1)。若要除去CuCl2溶液的少量Fe3+,应控制溶液的pH为________(填序号)。

(4)某工业废水中含有Cu2+、Pb2+、Hg2+,若向工业废水中加入过量的FeS,当FeS、CuS、PbS和HgS共存时,溶液中c(Fe2+):c(Pb2+):c(Hg2+)=__________ :_________ :_________ 。
已知:Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(PbS)=3.4×10-28mol2·L-2
Ksp(CuS)=1.3×10-36mol2·L-2,Ksp(HgS)=6.4×10-53mol2·L-2
(5)依据氧化还原反应:Cu2+(aq)+Fe(s)===Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是_______(填序号)。

(1)Fe2O3(s)+
 C(s)=
C(s)= CO2(g)+2Fe(s) ΔH=+234KJ/mol
CO2(g)+2Fe(s) ΔH=+234KJ/molC(s)+O2(g)=CO2(g)ΔH=-393.5KJ/mol
则2Fe(s)+
 O2(g)=Fe2O3(s)的ΔH是
O2(g)=Fe2O3(s)的ΔH是(2)一定温度下,氧化铁可以与一氧化碳发生如下反应:

①该温度时,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,5 min后,生成了单质铁11.2 g,则这段时间内CO的反应速率为
②达平衡后,若温度升高,CO的含量增大,则Q
(3)工业常根据金属氢氧化物在酸中溶解度不同,通过控制溶液的pH,达到分离金属离子的目的。如是难溶金属的氢氧化物在不同pH下的溶解情况(s/mol·L-1)。若要除去CuCl2溶液的少量Fe3+,应控制溶液的pH为________(填序号)。

| A.小于l | B.4左右 | C.大于6 | D.大于9 |
已知:Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(PbS)=3.4×10-28mol2·L-2
Ksp(CuS)=1.3×10-36mol2·L-2,Ksp(HgS)=6.4×10-53mol2·L-2
(5)依据氧化还原反应:Cu2+(aq)+Fe(s)===Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是_______(填序号)。

| A.电极X的材料是Fe |
| B.电解质溶液Y是AgNO3溶液 |
| C.原电池工作时,盐桥中的阴离子不断移向左池的氯化钠溶液中 |
| D.原电池工作时,X电极反应为:O2+2H2O+4e-→4OH- |
您最近一年使用:0次



