2024·四川德阳·二模
解题方法
1 .  资源化利用是实现
资源化利用是实现 减排的首要途径。已知
减排的首要途径。已知 加氢制甲醇反应体系中,主要反应有
加氢制甲醇反应体系中,主要反应有
Ⅰ.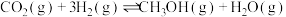


Ⅱ.
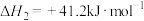

Ⅲ.

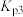
回答下列问题:
(1)
_______ 。
(2)在一定温度范围和压强范围内,只发生反应Ⅰ和Ⅱ,为了增大甲醇产率,理论上可采取的措施是_______ (写2点);
(3)已知反应Ⅰ和Ⅱ的 ,随温度的变化如图所示:
,随温度的变化如图所示:
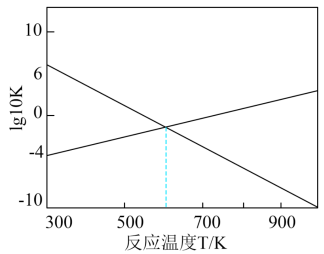
①300K时, 、
、 、
、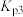 由大到小的顺序为
由大到小的顺序为_______ 。
②在600K、3MPa下,向密闭容器中充入2mol 和1mol
和1mol ,只发生反应Ⅰ和Ⅱ,开始时甲醇与CO的生成速率之比为6∶1,达到平衡时,生成速率之比为3∶1,甲醇的生成速率方程
,只发生反应Ⅰ和Ⅱ,开始时甲醇与CO的生成速率之比为6∶1,达到平衡时,生成速率之比为3∶1,甲醇的生成速率方程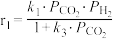 ,CO的生成速率方程
,CO的生成速率方程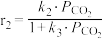 ,
, 、
、 为速率方程常数、
为速率方程常数、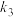 为常数。体系达到平衡时,
为常数。体系达到平衡时,
_______ , 的平衡转化率为
的平衡转化率为_______ 。
(4) 电池的研究取得了新的进展,在TAPP-Mn(Ⅱ)作用下,其电池结构和正极反应历程如下:
电池的研究取得了新的进展,在TAPP-Mn(Ⅱ)作用下,其电池结构和正极反应历程如下:
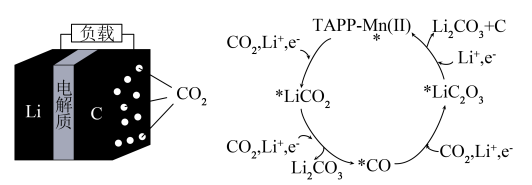
①该正极反应历程中有_______ 种中间产物;
②放电时,该电池的正极反应式为_______ 。
 资源化利用是实现
资源化利用是实现 减排的首要途径。已知
减排的首要途径。已知 加氢制甲醇反应体系中,主要反应有
加氢制甲醇反应体系中,主要反应有Ⅰ.
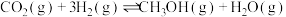


Ⅱ.

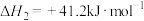

Ⅲ.


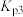
回答下列问题:
(1)

(2)在一定温度范围和压强范围内,只发生反应Ⅰ和Ⅱ,为了增大甲醇产率,理论上可采取的措施是
(3)已知反应Ⅰ和Ⅱ的
 ,随温度的变化如图所示:
,随温度的变化如图所示:
①300K时,
 、
、 、
、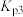 由大到小的顺序为
由大到小的顺序为②在600K、3MPa下,向密闭容器中充入2mol
 和1mol
和1mol ,只发生反应Ⅰ和Ⅱ,开始时甲醇与CO的生成速率之比为6∶1,达到平衡时,生成速率之比为3∶1,甲醇的生成速率方程
,只发生反应Ⅰ和Ⅱ,开始时甲醇与CO的生成速率之比为6∶1,达到平衡时,生成速率之比为3∶1,甲醇的生成速率方程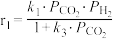 ,CO的生成速率方程
,CO的生成速率方程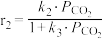 ,
, 、
、 为速率方程常数、
为速率方程常数、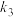 为常数。体系达到平衡时,
为常数。体系达到平衡时,
 的平衡转化率为
的平衡转化率为(4)
 电池的研究取得了新的进展,在TAPP-Mn(Ⅱ)作用下,其电池结构和正极反应历程如下:
电池的研究取得了新的进展,在TAPP-Mn(Ⅱ)作用下,其电池结构和正极反应历程如下:
①该正极反应历程中有
②放电时,该电池的正极反应式为
您最近一年使用:0次
23-24高三上·湖北·阶段练习
名校
2 . 甲醇是一种基本的有机化工原料,用途十分广泛。应用 催化加氢规模化生产甲醇是综合利用
催化加氢规模化生产甲醇是综合利用 ,实现“碳达峰”的有效措施之一、我国科学家研究发现二氧化碳电催化还原制甲醇的反应
,实现“碳达峰”的有效措施之一、我国科学家研究发现二氧化碳电催化还原制甲醇的反应
 ,需通过以下两步实现:
,需通过以下两步实现:
I.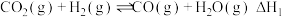
II.
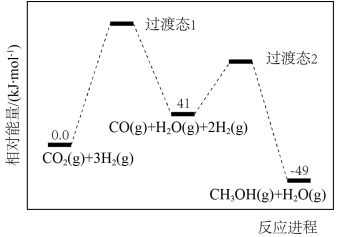
反应过程中各物质的相对能量变化情况如图所示。
(1)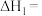
___________ ,稳定性:过渡态1___________ 过渡态2(填“大于”“小于”或“等于”)
(2)为探究该反应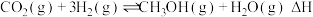 ,进行如下实验:在一恒温、体积为
,进行如下实验:在一恒温、体积为 密闭容器中,充入
密闭容器中,充入 和
和 ,进行该反应(不考虑其它副反应)。
,进行该反应(不考虑其它副反应)。 时测得
时测得 和
和 的体积分数之比为
的体积分数之比为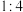 且比值不再随时间变化。回答下列问题:
且比值不再随时间变化。回答下列问题:
①反应开始到平衡,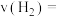
___________ 。
②该温度下的平衡常数
___________  (保留三位有效数字)。
(保留三位有效数字)。
③若上述反应过程中不断升高反应温度,下列图像正确的是___________ 。
A.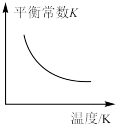 B.
B. C.
C.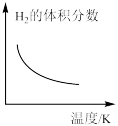 D.
D.
(3)基于催化剂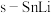 的
的 电催化制备甲酸盐同时释放电能的装置如图所示,该电池充电时,阳极的电极反应式为
电催化制备甲酸盐同时释放电能的装置如图所示,该电池充电时,阳极的电极反应式为___________ ,若电池工作 电极的质量变化为
电极的质量变化为 ,则理论上消耗
,则理论上消耗 的物质的量为
的物质的量为___________ 。

 催化加氢规模化生产甲醇是综合利用
催化加氢规模化生产甲醇是综合利用 ,实现“碳达峰”的有效措施之一、我国科学家研究发现二氧化碳电催化还原制甲醇的反应
,实现“碳达峰”的有效措施之一、我国科学家研究发现二氧化碳电催化还原制甲醇的反应 ,需通过以下两步实现:
,需通过以下两步实现:I.
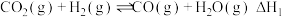
II.

反应过程中各物质的相对能量变化情况如图所示。

(1)
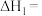
(2)为探究该反应
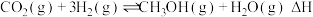 ,进行如下实验:在一恒温、体积为
,进行如下实验:在一恒温、体积为 密闭容器中,充入
密闭容器中,充入 和
和 ,进行该反应(不考虑其它副反应)。
,进行该反应(不考虑其它副反应)。 时测得
时测得 和
和 的体积分数之比为
的体积分数之比为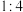 且比值不再随时间变化。回答下列问题:
且比值不再随时间变化。回答下列问题:①反应开始到平衡,
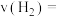
②该温度下的平衡常数

 (保留三位有效数字)。
(保留三位有效数字)。③若上述反应过程中不断升高反应温度,下列图像正确的是
A.
 B.
B. C.
C. D.
D.
(3)基于催化剂
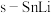 的
的 电催化制备甲酸盐同时释放电能的装置如图所示,该电池充电时,阳极的电极反应式为
电催化制备甲酸盐同时释放电能的装置如图所示,该电池充电时,阳极的电极反应式为 电极的质量变化为
电极的质量变化为 ,则理论上消耗
,则理论上消耗 的物质的量为
的物质的量为
您最近一年使用:0次
2023-11-06更新
|
223次组卷
|
4卷引用:T28-原理综合题
23-24高三上·河北衡水·开学考试
名校
3 . 近年来甲醇用途日益广泛,越来越引起商家的关注。工业上甲醇的合成途径多种多样。现在实验室中模拟甲醇合成反应,在2 L密闭容器内,n(CO)和n(H2)按1:2 充入。在400 ℃时发生反应CO(g)+2H2(g) CH3OH(g),体系中n(CO)随时间的变化如表:
CH3OH(g),体系中n(CO)随时间的变化如表:
(1)图甲中表示CH3OH的变化的曲线是_______ (填序号)。
(2)此反应在前2s,H2 的反应速率是_______
(3)下列措施不能提高反应速率的有_______(填序号)。
(4)下列叙述能说明反应达到平衡状态的是_______ (填序号)。
a.CO和H2的浓度保持不变
b.v(H2)=2v(CO)
c.CO的物质的量分数保持不变
d.容器内气体密度保持不变
e.每生成1 mol CH3OH的同时有2 mol H-H键断裂
(5)CO(g)+2H2(g) CH3OH(g),此反应的平衡常数的表达式为:
CH3OH(g),此反应的平衡常数的表达式为:_____
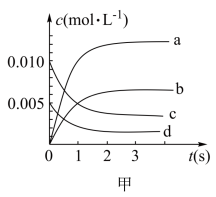
(6)CH3OH与O2的反应可将化学能转化为电能,其工作原理如图乙所示,图中CH3OH从_______ (填“A”或“B”)处通入。
 CH3OH(g),体系中n(CO)随时间的变化如表:
CH3OH(g),体系中n(CO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 5 |
| n(CO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |

(2)此反应在前2s,H2 的反应速率是
(3)下列措施不能提高反应速率的有_______(填序号)。
| A.升高温度 |
| B.加入催化剂 |
| C.增大压强 |
| D.及时分离出CH3OH |
a.CO和H2的浓度保持不变
b.v(H2)=2v(CO)
c.CO的物质的量分数保持不变
d.容器内气体密度保持不变
e.每生成1 mol CH3OH的同时有2 mol H-H键断裂
(5)CO(g)+2H2(g)
 CH3OH(g),此反应的平衡常数的表达式为:
CH3OH(g),此反应的平衡常数的表达式为:(6)CH3OH与O2的反应可将化学能转化为电能,其工作原理如图乙所示,图中CH3OH从

您最近一年使用:0次
2023·陕西榆林·一模
解题方法
4 . “低碳经济”已成为全世界科学家研究的重要课题。根据所学知识回答下列问题:
I.在一定条件下,CO2(g) +4H2(g)⇌CH4(g)+2H2O(g) ΔH1 。
已知:①常温常压下,H2和CH4的燃烧热(ΔH)分别为- 285.5kJ ·mol-1和-890.0 kJ ·mol-1;
②H2O(l)=H2O(g) ΔH2=+44.0 kJ ·mol-1。
(1)ΔH1=_______ kJ ·mol-1。
(2)在某一恒容密闭容器中加入CO2、H2,其分压分别为15 kPa、30 kPa,加入催化剂并加热使其发生反应CO2(g) +4H2(g)⇌CH4(g)+ 2H2O(g)。研究表明CH4的反应速率v(CH4)=1.2×10-6 p(CO2)·p4(H2) kPa·s-1,某时刻测得H2O(g)的分压为10 kPa,则该时刻v(H2)=_______ 。
(3)其他条件一定时,不同压强下,CO2的转化率和CH4的产率如图所示。则CO2甲烷化应该选择的压强约为_______ MPa;CH4的产率小于CO2的转化率的原因是_______ 。

(4)不同条件下,按照n(CO2):n(H2)=1:4投料发生反应[副反应为CO2(g)+ H2(g)⇌CO(g) +H2O(g) ΔH3>0],CO2的平衡转化率如图所示。

①压强p1、p2、p3由大到小的顺序是_______ 。
②压强为p1时,随着温度升高,CO2的平衡转化率先减小后增大。解释温度高于600°C之后,随着温度升高CO2转化率增大的原因:_______ 。
II.某研究团队经实验证明,CO2在一定条件 下与H2O发生氧再生反应:CO2(g)+2H2O(g)⇌CH4(g)+2O2(g) ΔH1= +802.3 kJ·mol-1。
(5)恒压条件下,按c(CO2):c(H2O)=1:2投料,进行氧再生反应,测得不同温度下平衡时体系中各物质浓度关系如图。

350℃时,A点的平衡常数K=_______ (填计算结果)。 为提高CO2的转化率,除改变温度外,还可采取的措施为_______ 。
I.在一定条件下,CO2(g) +4H2(g)⇌CH4(g)+2H2O(g) ΔH1 。
已知:①常温常压下,H2和CH4的燃烧热(ΔH)分别为- 285.5kJ ·mol-1和-890.0 kJ ·mol-1;
②H2O(l)=H2O(g) ΔH2=+44.0 kJ ·mol-1。
(1)ΔH1=
(2)在某一恒容密闭容器中加入CO2、H2,其分压分别为15 kPa、30 kPa,加入催化剂并加热使其发生反应CO2(g) +4H2(g)⇌CH4(g)+ 2H2O(g)。研究表明CH4的反应速率v(CH4)=1.2×10-6 p(CO2)·p4(H2) kPa·s-1,某时刻测得H2O(g)的分压为10 kPa,则该时刻v(H2)=
(3)其他条件一定时,不同压强下,CO2的转化率和CH4的产率如图所示。则CO2甲烷化应该选择的压强约为

(4)不同条件下,按照n(CO2):n(H2)=1:4投料发生反应[副反应为CO2(g)+ H2(g)⇌CO(g) +H2O(g) ΔH3>0],CO2的平衡转化率如图所示。

①压强p1、p2、p3由大到小的顺序是
②压强为p1时,随着温度升高,CO2的平衡转化率先减小后增大。解释温度高于600°C之后,随着温度升高CO2转化率增大的原因:
II.某研究团队经实验证明,CO2在一定条件 下与H2O发生氧再生反应:CO2(g)+2H2O(g)⇌CH4(g)+2O2(g) ΔH1= +802.3 kJ·mol-1。
(5)恒压条件下,按c(CO2):c(H2O)=1:2投料,进行氧再生反应,测得不同温度下平衡时体系中各物质浓度关系如图。

350℃时,A点的平衡常数K=
您最近一年使用:0次
5 . 工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g) Si(s)+4HCl(g);△H=+QkJ•mol-1 (Q>0)某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是
Si(s)+4HCl(g);△H=+QkJ•mol-1 (Q>0)某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是
 Si(s)+4HCl(g);△H=+QkJ•mol-1 (Q>0)某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是
Si(s)+4HCl(g);△H=+QkJ•mol-1 (Q>0)某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是| A.反应过程中,若增大压强则化学反应速率降低 |
| B.若反应开始时 SiCl4 为 1mol,则达到平衡时,吸收热量为 QkJ |
| C.反应至 4min 时,若HCl的浓度为 0.12mol•L-1,则 H2 的反应速率为 0.03mol/(L•min) |
| D.当反应吸收热量为 0.025QkJ 时,生成的 HCl 通入 100mL1mol•L-1 的 NaOH 恰好反应 |
您最近一年使用:0次
2020-04-12更新
|
371次组卷
|
52卷引用:四川省南充市阆中中学2020届高三化学选择题专项训练(28)
四川省南充市阆中中学2020届高三化学选择题专项训练(28)四川省南充市阆中中学2020届高三化学选择题专项训练(19)(已下线)《2018-2019学年同步单元双基双测AB卷》第二单元 化学反应速率与化学平衡单元测试A卷(已下线)专题2 综合评价(1)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)(已下线)西南师大附中2010届高三第五次月考(理综)试题化学部分2008年高考北京理综化学(已下线)09~10学年江苏宿迁中学高二下学期期中考试化学卷(已下线)2010年山西省山西大学附中高二上学期10月考化学(已下线)2010年湖北省襄樊市四校联考-高二上学期期中考试化学卷(已下线)2010—2011学年浙江省温州市十校联合高二下学期期末联考化学试卷(已下线)2012届辽宁省辽南协作体高三上学期期中考试化学试卷(已下线)2011-2012学年山东省鄄城县第一中学高二上学期期中考试化学试卷(已下线)2012-2013学年陕西省长安一中高二下学期期中考试化学试卷(已下线)2014年高二化学苏教版选修2 4专题综合检测练习卷(已下线)2014年高中化学鲁科版选修四第2章 反应的方向限度与速率练习卷(已下线)2013-2014学年陕西省南郑中学高二下学期期末考试化学试卷2015年湖北省荆门市高三元月调考理综化学试卷2014-2015学年浙江省江山实验中学高二4月教学质量检测化学试卷2014-2015学年云南省曲靖市陆良县二中高二下期中化学试卷2014-2015学年辽宁实验分校高一下6月阶段测试化学试卷2016届黑龙江省哈尔滨第六中学高三上期中测试化学试卷2015-2016学年山东省武城县第二中学高二上学期第一次月考化学试卷2015届江西省南昌三中高三上学期第六次考试理综化学试卷2016届甘肃省河西五市部分普通高中高三上第一次联考化学试卷2015-2016学年江西省南昌市进贤一中高二下第一次月考化学试卷2016届天津市河东区高三第二次模拟考试理综化学试卷2016届广东省广州市增城一中高三下4月月考化学试卷2016-2017学年河南省师大附中高二上期中化学试卷2016-2017学年河南郸城高级中学高二上第二次考试化学卷2017届甘肃省兰州一中高三上12月月考化学试卷2017届北京市昌平临川育人学校高三12月月考化学试卷2017届河北省邢台市第二中学高三上学期第三次月考化学试卷【全国校级联考】内蒙古赤峰市重点高中(赤峰二中,平煤高级中学等)2017-2018学年高二下学期期末联考(A)化学试题河北省安平中学2017-2018学年高一下学期期末考试化学试题1【全国百强校】陕西省西安市第一中学2018-2019学年高二上学期10月月考化学试题【全国百强校】河北省武邑中学2018-2019学年高二上学期第二次月考化学试题安徽省定远重点中学2019届高三上学期第三次月考化学试题陕西省黄陵中学2018-2019学年高二(普通班)上学期期末考试化学试题【全国百强校】内蒙古自治区赤峰二中2018-2019学年高一下学期第二次月考化学试题湖南省衡阳市第一中学2019-2020学年高二上学期第一次月考化学试题吉林松原乾安七中2019-2020学年高二上学期9月月考化学试题吉林省松原市乾安县七中2019-2020学年高二上学期第一次月考化学试题重庆市北碚区2019-2020学年高二11月联合性测试化学试题广东省揭阳市惠来县第一中学2019-2020学年高二上学期第二次阶段考试化学试题云南师范大学附属中学2019-2020学年高二上学期期中考试化学试题山西省芮城市2020届高三3月月考化学试题上海市奉贤区2016年高考一模化学试题陕西省渭南市瑞泉中学2019-2020学年高二上学期第一次月考化学试题河北省邯郸市第一中学2019—2020学年高一4月月考化学试题广东省深圳市福景外国语学校2020-2021学年高二年级上学期期中化学试题河北省保定市唐县第一中学2021-2022学年高二10月月考化学试题广西桂林市第十八中学2021-2022学年高二下学期开学考试化学试题
名校
解题方法
6 . 向一容积为5L的恒容密闭容器中充入5molA与8molB,在一定条件下反应:2A(g) + 3B(g) xC(g) + yD(g) (x、y为正整数)反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol∙L-1∙min-1,D的平衡浓度为0.3mol./L,又知v(B) : v(C)=3 : 2,下列说法中不正确的是 ( )
xC(g) + yD(g) (x、y为正整数)反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol∙L-1∙min-1,D的平衡浓度为0.3mol./L,又知v(B) : v(C)=3 : 2,下列说法中不正确的是 ( )
 xC(g) + yD(g) (x、y为正整数)反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol∙L-1∙min-1,D的平衡浓度为0.3mol./L,又知v(B) : v(C)=3 : 2,下列说法中不正确的是 ( )
xC(g) + yD(g) (x、y为正整数)反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol∙L-1∙min-1,D的平衡浓度为0.3mol./L,又知v(B) : v(C)=3 : 2,下列说法中不正确的是 ( )| A.x : y=2 : 1 | B.v(A) : v(D)=2 : 1 |
| C.A的平衡浓度为0.4mol/L | D.A与B的平衡浓度之比为3 : 2 |
您最近一年使用:0次
2014高三·四川·专题练习
名校
解题方法
7 . 向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s) yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:

(1)根据图示可确定x∶y=________ 。
(2)用A的浓度变化表示该反应在0~10 min内的平均反应速率v(A)=______________ 。
(3)0~10 min容器内压强________ (填“变大”“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是________ ;第16 min引起曲线变化的反应条件可能是________ 。
①减压②增大A的浓度 ③增大C的量 ④升温 ⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1________ K2(填“>”“=”或“<”)。
 yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
(1)根据图示可确定x∶y=
(2)用A的浓度变化表示该反应在0~10 min内的平均反应速率v(A)=
(3)0~10 min容器内压强
(4)推测第10 min引起曲线变化的反应条件可能是
①减压②增大A的浓度 ③增大C的量 ④升温 ⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1
您最近一年使用:0次
2020-01-02更新
|
91次组卷
|
15卷引用:2014届高考化学二轮复习四川配套训练 第6讲反应速率和化学平衡练习卷
(已下线)2014届高考化学二轮复习四川配套训练 第6讲反应速率和化学平衡练习卷(已下线)2018年12月29日 《每日一题》人教选修4-周末培优(已下线)2019年12月28日 《每日一题》人教版(选修4)——周末培优(已下线)专题十二化学反应速率与平衡(已下线)第七章 化学反应速率与化学平衡 第44讲 化学反应速率、平衡的常规图像(已下线)第4讲 化学反应速率及平衡图像2016-2017学年湖南省岳阳一中高二上10月月考化学试卷2016-2017学年新疆生产建设兵团二中高二上期中化学卷2016-2017学年黑龙江省哈尔滨市第六中学高二3月月考化学试卷安徽省铜陵市第一中学2017-2018学年高二10月月考化学试题湖北省宜昌市葛洲坝中学2017-2018学年高二9月月考化学试题河北省定州市第二中学2017-2018学年高二上学期第一次月考化学试题广西桂林市第十八中学2017-2018学年高二下学期开学考试化学试题辽宁省阜新市海州高级中学2019届高三上学期第一次月考化学试题陕西省咸阳市实验中学2020-2021学年高二上学期第二次月考化学试题
名校
8 . T℃时,在2 L的密闭容器中,A气体与B气体发生可逆反应生成C气体,反应过程中A、B、C物质的量变化如下图(Ⅰ)所示。若保持其它条件不变,温度分别为T1和T2时,B的物质的量分数与时间关系如下图(Ⅱ)所示。下列叙述正确的是


| A.2 min内A的化学反应速率为0.1 mol/(L·min) |
| B.在反应达平衡时,保持其他条件不变,增大压强,正逆反应速率都增大,且平衡向逆反应方向移动 |
| C.在反应达平衡时,其它条件不变,升高温度,正逆反应速率都增大,且A的转化率增大 |
| D.在T℃时,若A的浓度减少了1 mol/L,则B的浓度会减少3 mol/L,C的浓度会增加2 mol/L |
您最近一年使用:0次



