名校
1 . 某密闭容器中含有X和Y,同时发生以下两个反应:① ;②
;② 。反应①的正反应速率
。反应①的正反应速率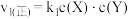 ,反应②的正反应速率
,反应②的正反应速率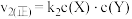 ,其中
,其中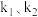 为速率常数。某温度下,体系中生成物浓度
为速率常数。某温度下,体系中生成物浓度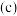 随时间
随时间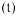 变化的曲线如图所示。下列说法正确的是
变化的曲线如图所示。下列说法正确的是
 ;②
;② 。反应①的正反应速率
。反应①的正反应速率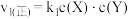 ,反应②的正反应速率
,反应②的正反应速率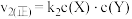 ,其中
,其中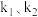 为速率常数。某温度下,体系中生成物浓度
为速率常数。某温度下,体系中生成物浓度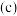 随时间
随时间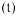 变化的曲线如图所示。下列说法正确的是
变化的曲线如图所示。下列说法正确的是
A. 时,正反应速率 时,正反应速率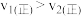 |
B.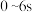 内,X的平均反应速率 内,X的平均反应速率 |
C.若升高温度, 时容器中 时容器中 的比值减小 的比值减小 |
| D.反应①的活化能大于反应② |
您最近一年使用:0次
2024-03-08更新
|
426次组卷
|
5卷引用:选择题11-14
(已下线)选择题11-142024届河北省各市高三下学期一模联考化学试题(已下线)提升练03 反应历程探究与催化原理-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)河北省衡水市衡水董子高级中学2023-2024学年高三下学期3月月考化学试题四川省成都市石室中学2023-2024学年高二下学期4月月考化学试卷
名校
解题方法
2 . 烟道气中的 本身对于
本身对于 是一种很好的还原剂,二者反应可得到硫磺,实现变废为宝。
是一种很好的还原剂,二者反应可得到硫磺,实现变废为宝。 还原
还原 的反应有:
的反应有:
i.

ii.
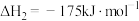
iii.

(1)已知:在标准压强、 时,由最稳定的单质合成
时,由最稳定的单质合成 物质
物质 的反应焓变,叫做物质
的反应焓变,叫做物质 的标准摩尔生成焓。部分物质的标准摩尔生成焓如下图所示,计算:
的标准摩尔生成焓。部分物质的标准摩尔生成焓如下图所示,计算:
_______ ,
_______ 。

(2)将 与
与 按物质的量之比为
按物质的量之比为 进行反应,相同时间内,在不同过渡金属氧化物催化剂作用下,
进行反应,相同时间内,在不同过渡金属氧化物催化剂作用下, 的转化率及生成硫的选择性[硫的选择性
的转化率及生成硫的选择性[硫的选择性 ]随反应温度变化的结果如下表所示:
]随反应温度变化的结果如下表所示:
①当以 作催化剂时,试分析
作催化剂时,试分析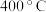 时反应是否达到平衡状态,并说明理由
时反应是否达到平衡状态,并说明理由________ ;请解释 转化率随温度变化的可能原因是
转化率随温度变化的可能原因是________ 。
②根据以上数据判断, 与
与 反应得到硫磺的最合适条件是
反应得到硫磺的最合适条件是________ 。
(3)在一定温度和某催化剂的条件下,将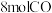 和
和 混合气体置于
混合气体置于 刚性密闭容器中进行上述反应,
刚性密闭容器中进行上述反应, 时反应达到平衡状态,测得
时反应达到平衡状态,测得 的转化率为
的转化率为 ,得到
,得到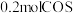 ,计算
,计算 内用
内用 表示的平均反应速率为
表示的平均反应速率为________ ;硫的选择性
_______ ;反应 的平衡常数
的平衡常数
______ (列出计算式,不用化简)。
 本身对于
本身对于 是一种很好的还原剂,二者反应可得到硫磺,实现变废为宝。
是一种很好的还原剂,二者反应可得到硫磺,实现变废为宝。 还原
还原 的反应有:
的反应有:i.


ii.

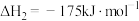
iii.


(1)已知:在标准压强、
 时,由最稳定的单质合成
时,由最稳定的单质合成 物质
物质 的反应焓变,叫做物质
的反应焓变,叫做物质 的标准摩尔生成焓。部分物质的标准摩尔生成焓如下图所示,计算:
的标准摩尔生成焓。部分物质的标准摩尔生成焓如下图所示,计算:


(2)将
 与
与 按物质的量之比为
按物质的量之比为 进行反应,相同时间内,在不同过渡金属氧化物催化剂作用下,
进行反应,相同时间内,在不同过渡金属氧化物催化剂作用下, 的转化率及生成硫的选择性[硫的选择性
的转化率及生成硫的选择性[硫的选择性 ]随反应温度变化的结果如下表所示:
]随反应温度变化的结果如下表所示:温度( ) ) |  |  |  |  | ||||
| 转化率 | 选择性 | 转化率 | 选择性 | 转化率 | 选择性 | 转化率 | 选择性 | |
| 300 | 0.30 | 0.33 | 0.05 | 0.84 | 0.24 | 0.48 | 0.11 | 0.48 |
| 350 | 0.32 | 0.55 | 0.11 | 0.90 | 0.34 | 0.70 | 0.12 | 0.48 |
| 400 | 0.30 | 0.68 | 0.25 | 0.95 | 0.45 | 0.87 | 0.14 | 0.50 |
| 450 | 0.29 | 0.72 | 0.40 | 0.95 | 0.49 | 0.98 | 0.15 | 0.50 |
| 500 | 0.28 | 0.85 | 0.48 | 0.95 | 0.50 | 1.00 | 0.17 | 0.51 |
 作催化剂时,试分析
作催化剂时,试分析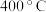 时反应是否达到平衡状态,并说明理由
时反应是否达到平衡状态,并说明理由 转化率随温度变化的可能原因是
转化率随温度变化的可能原因是②根据以上数据判断,
 与
与 反应得到硫磺的最合适条件是
反应得到硫磺的最合适条件是(3)在一定温度和某催化剂的条件下,将
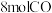 和
和 混合气体置于
混合气体置于 刚性密闭容器中进行上述反应,
刚性密闭容器中进行上述反应, 时反应达到平衡状态,测得
时反应达到平衡状态,测得 的转化率为
的转化率为 ,得到
,得到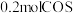 ,计算
,计算 内用
内用 表示的平均反应速率为
表示的平均反应速率为
 的平衡常数
的平衡常数
您最近一年使用:0次
2024-02-26更新
|
104次组卷
|
3卷引用:T17-原理综合题
名校
解题方法
3 . 室温下,某溶液初始时仅溶有M,同时发生以下两个反应:①M=X+Y;②M=X+Z。反应①的速率可表示为v1=k1×c(M),反应②的速率可表示为v2=k2×c(M)(k1、k2为速率常数)。T1温度时,体系中生成物浓度(c)随时间(t)变化的曲线如图甲所示,反应①和②的lnk1或lnk2随 的变化曲线如图乙所示。下列说法错误的是
的变化曲线如图乙所示。下列说法错误的是

 的变化曲线如图乙所示。下列说法错误的是
的变化曲线如图乙所示。下列说法错误的是
| A.0~10s内,M的平均反应速率v(M)=0.7mol/(L·s) |
B.T1温度时,反应过程中 的值不变 的值不变 |
| C.反应①的活化能比反应②的活化能低 |
D.若反应在低于T1温度下发生,则10s时体系中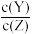 的比值减小 的比值减小 |
您最近一年使用:0次
2023高三·全国·专题练习
4 . 在起始温度均为T℃、容积均为10L的密闭容器A(恒温)、B(绝热)中均加入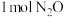 和4molCO,发生反应
和4molCO,发生反应
 。已知:
。已知: 、
、 分别是正、逆反应速率常数,
分别是正、逆反应速率常数, ,
,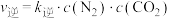 ,A、B容器中
,A、B容器中 的转化率随时间的变化关系如图所示。下列说法中正确的是
的转化率随时间的变化关系如图所示。下列说法中正确的是
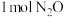 和4molCO,发生反应
和4molCO,发生反应
 。已知:
。已知: 、
、 分别是正、逆反应速率常数,
分别是正、逆反应速率常数, ,
,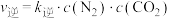 ,A、B容器中
,A、B容器中 的转化率随时间的变化关系如图所示。下列说法中正确的是
的转化率随时间的变化关系如图所示。下列说法中正确的是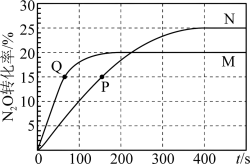
A.曲线M、N的平衡常数大小为: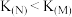 |
B. 与 与 浓度比为1∶1时,标志此反应已达平衡 浓度比为1∶1时,标志此反应已达平衡 |
C.T℃时, |
D.用CO的浓度变化表示曲线N在0~100s内的平均速率为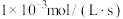 |
您最近一年使用:0次
名校
解题方法
5 . 氨的用途十分泛,如氨是制造硝酸和氮肥的重要原料。工业合成氨是人类科学技术的一项重大突破。回答下列问题:
(1)合成氨反应的历程和能量的变化如图所示,符号“·”可视为催化剂。

在合成氨的基元反应中,决速步骤的活化能为___________ kJ/mol。
(2)在不同条件下进行合成氨反应,下列反应速率由大到小的顺序是___________ (填选项序号)。
①v(N2)=0.5mol/(L·min) ②v(H2)=0.02mol/(L·s)
③v(NH3)=0.4mol/(L·min) ④v(NH3)=0.02mol/(L·s)
(3)对于合成氨反应而言,只控制一个变量,下列图像合理的是___________(填选项字母)。
(4)一定温度下,向2L恒容密闭容器中充入0.4molN2、1.2molH2发生反应,NH3的浓度随时间变化情况如表所示:
0~10min内,用H2表示的平均反应速率为___________ ;实验测得体系平衡时的压强为10MPa,则该反应的平衡常数Kp=___________ MPa-2(用分数表示,Kp为分压表示的平衡常数,分压=总压×体积分数);若维持温度不变,向另一2L恒容密闭容器中充入H2、N2和NH3各4mol时,该反应的v正___________ (填“>”“<”或“=”)v逆。
(1)合成氨反应的历程和能量的变化如图所示,符号“·”可视为催化剂。

在合成氨的基元反应中,决速步骤的活化能为
(2)在不同条件下进行合成氨反应,下列反应速率由大到小的顺序是
①v(N2)=0.5mol/(L·min) ②v(H2)=0.02mol/(L·s)
③v(NH3)=0.4mol/(L·min) ④v(NH3)=0.02mol/(L·s)
(3)对于合成氨反应而言,只控制一个变量,下列图像合理的是___________(填选项字母)。
A.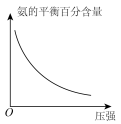 | B.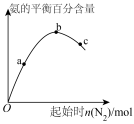 |
C.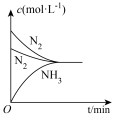 | D.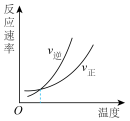 |
| 时间/min | 5 | 10 | 15 | 20 | 25 |
| 浓度/mol/L | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 |
您最近一年使用:0次
解题方法
6 . PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生反应:PCl3(g)+Cl2(g)⇌PCl5(g) ΔH<0,并于10 min时达到平衡。有关数据如下:
下列判断不正确的是
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度/(mol·L-1) | 2.0 | 1.0 | 0 |
| 平衡浓度/(mol·L-1) | c1 | c2 | 0.4 |
| A.10 min内,v(Cl2)=0.04 mol·L-1·min-1 |
| B.当容器中Cl2为1.2 mol时,反应达到平衡 |
| C.升高温度,反应的平衡常数减小,则平衡时PCl3的转化率升高 |
| D.平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件下再达到平衡时,c(PCl5)<0.2 mol·L-1 |
您最近一年使用:0次
2023-10-21更新
|
346次组卷
|
5卷引用:选择题11-14
(已下线)选择题11-14(已下线)章末综合评价(七)2016届宁夏固原一中高三上适应性训练理综化学试卷四川省邻水实验学校2021-2022学年高二上学期第一次月考化学试题(已下线)期中考试模拟试题(二)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)
7 . 一定温度下,在容积恒为 的容器中通入一定量
的容器中通入一定量 ,发生反应
,发生反应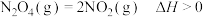 ,体系中各组分浓度随时间(t)的变化如下表。下列说法
,体系中各组分浓度随时间(t)的变化如下表。下列说法不正确 的是
 的容器中通入一定量
的容器中通入一定量 ,发生反应
,发生反应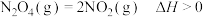 ,体系中各组分浓度随时间(t)的变化如下表。下列说法
,体系中各组分浓度随时间(t)的变化如下表。下列说法| t/s | 0 | 20 | 40 | 60 | 80 |
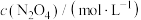 | 0.100 | 0.062 | 0.048 | 0.040 | 0.040 |
 | 0 | 0.076 | 0.104 | 0.120 | 0.120 |
A.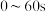 , , 的平均反应速率为 的平均反应速率为 |
B.升高温度,反应 化学平衡常数值增大 化学平衡常数值增大 |
C. 时,再充入 时,再充入 、 、 各 各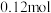 ,平衡不移动 ,平衡不移动 |
| D.若压缩容器使压强增大,达新平衡后混合气颜色比原平衡时深 |
您最近一年使用:0次
8 . 在恒温恒容条件下,向容积为1L的密闭容器中充入一定量的SO3(g),发生下列反应: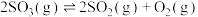
 。温度为T时,部分实验数据如表所示:
。温度为T时,部分实验数据如表所示:
下列说法错误的是
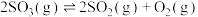
 。温度为T时,部分实验数据如表所示:
。温度为T时,部分实验数据如表所示: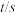 | 0 | 50 | 100 | 150 |
 | 4.00 | 2.50 | 2.00 | 2.00 |
A.前50s内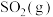 的平均生成速率为 的平均生成速率为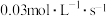 |
| B.容器内密度不再改变说明反应已达平衡 |
C.150s时,向容器中继续通入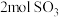 、 、 、 、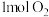 ,则此时反应将逆向进行 ,则此时反应将逆向进行 |
D.其他条件不变,若将恒容改为恒压,则平衡时 的转化率增大 的转化率增大 |
您最近一年使用:0次
2023-08-27更新
|
415次组卷
|
9卷引用:选择题6-10
名校
解题方法
9 . 已知反应: 生成
生成 的初始速率与NO、
的初始速率与NO、 的初始浓度的关系为
的初始浓度的关系为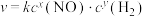 ,k为速率常数。在800℃时测得的相关数据如表所示
,k为速率常数。在800℃时测得的相关数据如表所示
下列说法中不正确的是。
 生成
生成 的初始速率与NO、
的初始速率与NO、 的初始浓度的关系为
的初始浓度的关系为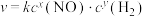 ,k为速率常数。在800℃时测得的相关数据如表所示
,k为速率常数。在800℃时测得的相关数据如表所示| 实验数据 | 初始浓度 | 生成 的初始速率/( 的初始速率/(  ) ) | |
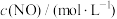 |  | ||
| 1 | 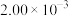 | 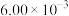 | 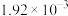 |
| 2 | 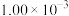 | 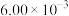 | 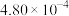 |
| 3 | 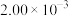 | 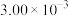 | 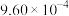 |
A.关系式中 、 、 |
B.800℃时,k的值为 |
C.若800℃时,初始浓度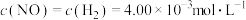 ,则生成 ,则生成 的初始速率为 的初始速率为 |
| D.当其他条件不变时,升高温度,速率常数将增大 |
您最近一年使用:0次
2023-07-21更新
|
220次组卷
|
3卷引用:选择题6-10
名校
解题方法
10 . 为加快实现“双碳”目标,有效应对全球气候变化、构建低碳社会,CO2资源化利用受到越来越多的关注。
I.利用CO2与CH4制备合成气CO、H2的反应历程如下:
第一步:CH4(g)+CO2(g)→C(ads)+2H2(g)+CO2(g) ΔH1=E1kJ·mol-1;
第二步:C(ads)+2H2(g)+CO2(g)→2CO(g)+2H2(g) ΔH2=E2kJ·mol-1;
说明:ads为吸附型催化剂。
(1)制备合成气总反应的反应热ΔH=___________ kJ·mol-1;
(2)一定条件下ads对CO2也有吸附作用。结合下图分析ads吸附CO2的适宜条件是___________ 。

(3)由甲烷生成乙烷的反应如下:2CH4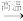 C2H6+H2。在不同反应物浓度时,该反应的反应速率如下表所示:
C2H6+H2。在不同反应物浓度时,该反应的反应速率如下表所示:
该反应的速率方程为:v=___________ mol·L-1·min-1[用含c(CH4)的代数式表示]。
Ⅱ.CO2在固体催化剂表面加氢合成甲烷过程中发生如下反应:
反应1:CO2(g)+4H2(g) CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
反应2:CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
(4)已知温度为T时,向0.5L恒容密闭容器中充入2molCO2和6molH2,一段时间后达到平衡,测得体系中生成2.5molH2O,压强变为原来的75%,反应1的平衡常数K=___________ (用分数表示),CH4选择性=___________ (CH4选择性= ,保留三位有效数字)。
,保留三位有效数字)。
I.利用CO2与CH4制备合成气CO、H2的反应历程如下:
第一步:CH4(g)+CO2(g)→C(ads)+2H2(g)+CO2(g) ΔH1=E1kJ·mol-1;
第二步:C(ads)+2H2(g)+CO2(g)→2CO(g)+2H2(g) ΔH2=E2kJ·mol-1;
说明:ads为吸附型催化剂。
(1)制备合成气总反应的反应热ΔH=
(2)一定条件下ads对CO2也有吸附作用。结合下图分析ads吸附CO2的适宜条件是

(3)由甲烷生成乙烷的反应如下:2CH4
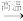 C2H6+H2。在不同反应物浓度时,该反应的反应速率如下表所示:
C2H6+H2。在不同反应物浓度时,该反应的反应速率如下表所示:| 实验编号 | 1 | 2 | 3 | 4 |
| c(CH4)/(mol·L-1) | 0.1000 | 0.2000 | 0.3000 | 0.4000 |
| v/(mol·L-1·min-1) | 0.0076 | 0.0153 | 0.0227 | 0.0306 |
Ⅱ.CO2在固体催化剂表面加氢合成甲烷过程中发生如下反应:
反应1:CO2(g)+4H2(g)
 CH4(g)+2H2O(g)
CH4(g)+2H2O(g)反应2:CO2(g)+H2(g)
 CO(g)+H2O(g)
CO(g)+H2O(g)(4)已知温度为T时,向0.5L恒容密闭容器中充入2molCO2和6molH2,一段时间后达到平衡,测得体系中生成2.5molH2O,压强变为原来的75%,反应1的平衡常数K=
 ,保留三位有效数字)。
,保留三位有效数字)。
您最近一年使用:0次



