名校
1 . H2S的转化是资源利用和环境保护的重要研究课题。回答下列问题:
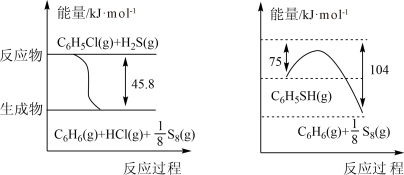
(1)苯硫酚(C6H5SH)是一种重要的有机合成中间体,工业上常用氯苯(C6H5Cl)和硫化氢(H2S)来制备苯硫酚。已知下列两个反应的能量关系如图所示,则C6H5Cl与H2S反应生成C6H5SH的热化学方程式为_______ 。
(2)H2S与CO2在高温下反应制得的羰基硫(COS)可用于合成除草剂。在610K时,将0.40molH2S与0.10molCO2充入2.5L的空钢瓶中,发生反应:H2S(g)+CO2(g)⇌COS(g)+H2O(g)ΔH=+35kJ/mol,反应达平衡后水蒸气的物质的量分数为0.02。
①在610K时,反应经2min达到平衡,则0~2min的平均反应速率v(H2S)=_______ 。
②实验测得上述反应的速率方程为:v正=k正·c(H2S)·c(CO2),v逆=k逆·c(COS)·c(H2O),k正、k逆分别为正、逆反应速率常数,速率常数k随温度升高而增大。则达到平衡后,仅升高温度,k正增大的倍数_______ (填“>”“<”或“=”)k逆增大的倍数。
③该条件下,容器中反应达到化学平衡状态的依据是_______ (填字母)。
A.容器内混合气体密度不再变化 B.v正(H2S)=v逆(COS)
C.容器内的压强不再变化 D.H2S与CO2的质量之比不变
(3)工业上可以通过硫化氢分解制得H2和硫蒸气。在密闭容器中充入一定量H2S气体,反应原理:2H2S(g)⇌2H2(g)+S2(g),H2S气体的平衡转化率与温度、压强的关系如图所示。
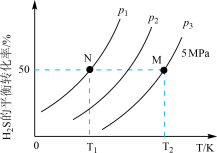
①图中压强(P1、P2、P3)的大小顺序为_______ ,理由是_______ 。
②如果要进一步提高H2S的平衡转化率,除改变温度、压强外,还可以采取的措施有_______ 。
③在温度T2、P3=5MPa条件下,该反应的平衡常数Kp=_______ MPa(已知:用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(1)苯硫酚(C6H5SH)是一种重要的有机合成中间体,工业上常用氯苯(C6H5Cl)和硫化氢(H2S)来制备苯硫酚。已知下列两个反应的能量关系如图所示,则C6H5Cl与H2S反应生成C6H5SH的热化学方程式为

(2)H2S与CO2在高温下反应制得的羰基硫(COS)可用于合成除草剂。在610K时,将0.40molH2S与0.10molCO2充入2.5L的空钢瓶中,发生反应:H2S(g)+CO2(g)⇌COS(g)+H2O(g)ΔH=+35kJ/mol,反应达平衡后水蒸气的物质的量分数为0.02。
①在610K时,反应经2min达到平衡,则0~2min的平均反应速率v(H2S)=
②实验测得上述反应的速率方程为:v正=k正·c(H2S)·c(CO2),v逆=k逆·c(COS)·c(H2O),k正、k逆分别为正、逆反应速率常数,速率常数k随温度升高而增大。则达到平衡后,仅升高温度,k正增大的倍数
③该条件下,容器中反应达到化学平衡状态的依据是
A.容器内混合气体密度不再变化 B.v正(H2S)=v逆(COS)
C.容器内的压强不再变化 D.H2S与CO2的质量之比不变
(3)工业上可以通过硫化氢分解制得H2和硫蒸气。在密闭容器中充入一定量H2S气体,反应原理:2H2S(g)⇌2H2(g)+S2(g),H2S气体的平衡转化率与温度、压强的关系如图所示。

①图中压强(P1、P2、P3)的大小顺序为
②如果要进一步提高H2S的平衡转化率,除改变温度、压强外,还可以采取的措施有
③在温度T2、P3=5MPa条件下,该反应的平衡常数Kp=
您最近一年使用:0次
2023-06-19更新
|
341次组卷
|
4卷引用:青海省西宁市大通回族土族自治县2023-2024学年高三上学期期中考试理综试题
名校
解题方法
2 . 一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列描述正确的是
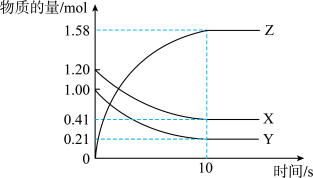
| A.反应在0~10 s内,用Z表示的反应速率为0.158 mol·L-1·s-1 |
| B.反应在0~10 s内,X的物质的量浓度减少了0.79 mol·L-1 |
| C.反应进行到10 s时,Y的转化率为79.0% |
| D.反应的化学方程式为X(g)+Y(g)=Z(g) |
您最近一年使用:0次
2022-12-20更新
|
3355次组卷
|
158卷引用:青海省海西蒙古族藏族自治州德令哈市海西州高级中学2020-2021学年高二上学期期中考试化学试题
青海省海西蒙古族藏族自治州德令哈市海西州高级中学2020-2021学年高二上学期期中考试化学试题(已下线)2010年江西省德兴市四校联考高二上学期期中考试化学试卷(已下线)2011-2012学年山西省大同一中高二上学期期中考试化学试卷(已下线)2011-2012学年江西省九江一中高一下学期期中考试理科化学试卷(已下线)2011-2012学年浙江省温州中学高一下学期期中考试理科化学试卷(已下线)2011-2012学年浙江省温州中学高一下学期期中考试文科化学试卷(已下线)2011-2012年江苏淮安市范集中学高二下学期期中考试化学试卷(已下线)2011-2012学年河南省永城实验高中高二上学期期中考试化学试卷(已下线)2011-2012学年河北省辛集三中高二化学选修四期中试卷(已下线)2012-2013学年昆明三中、滇池中学(滇中)高二下期中考试化学卷(已下线)2012-2013学年吉林省龙井市三中高一下学期期中考试化学试卷(已下线)2013-2014学年江苏省常州市四校高二期中考试化学试卷(已下线)2014-2015学年甘肃省庆阳一中高二第一学期期中考试化学试卷(已下线)2014-2015学年辽宁大连市第二十高级中学高二上期中考试化学试题2014-2015山西省大同市一中高二上学期期中化学试卷2014—2015江西省九江市彭泽县第二高中高一下学期期中考试化学试卷2015-2016学年江西省吉安一中高一下期中化学试卷2015-2016学年湖南东部六校高一下期中化学试卷2016-2017学年宁夏育才中学高二上学期期中化学卷2016-2017学年新疆生产建设兵团二中高二上期中化学卷安徽省淮北市第一中学2016-2017学年高一下学期期中考试化学试题1北京市昌平临川育人学校2017-2018学年高二上学期期中考试化学试题广东省东莞市七校2017-2018学年高二上学期期中联考化学试题江苏省苏州市第五中学2018-2019学年高二下学期期中考试化学试题湖南省武冈市第一中学2018-2019学年高一下学期期中考试化学试题甘肃省靖远县第四中学2018-2019学年高一下学期期中考试化学试题宁夏长庆高级中学2019-2020学年高二上学期期中考试化学试题(已下线)【新东方】高中化学173江苏省苏州市张家港高级中学2019-2020学年高二上学期期中考试化学试题辽宁省葫芦岛市第八高级中学2019-2020学年高二上学期期中考试化学试题西藏自治区拉萨市那曲第二高级中学2019-2020学年高二上学期期中考试化学试题甘肃省甘南藏族自治州合作第一中学2018-2019学年高一下学期期中考试化学试题云南省普洱市景东彝族自治县第一中学2019-2020学年高二下学期期中考试理综化学试题福建省连城县第一中学2019-2020学年高二下学期期中考试化学试题浙江省宁波市余姚中学2019-2020学年高一下学期期中考试化学试题(已下线)陕西省吴起高级中学2018-2019学年高一下学期期中考试化学能力卷试题内蒙古赤峰学院附属中学2020-2021学年高二上学期期中考试化学试题西藏自治区日喀则市第二高级中学2020-2021学年高二上学期期中考试化学试题甘肃省武威第一中学2020-2021学年高二上学期期中考试化学试题云南省玉溪第二中学2020-2021学年高二上学期期中质量检测化学试题陕西省眉县槐芽中学2020-2021学年高二上学期期中考试化学试题甘肃省白银市靖远县第四中学2020-2021学年高一下学期期中考试化学(理)试题宁夏长庆高级中学2020-2021学年高一上学期期中考试化学试题2云南省玉溪市第二中学2021-2022学年高二上学期期中考试化学试题云南省玉溪市江川区第二中学2021-2022学年高二上学期期中考试化学试题安徽省六安市新安中学2021-2022学年高二上学期期中考试化学试题内蒙古乌兰察布市部分学校2021-2022学年高二上学期期中联考化学试题甘肃省兰州市西固区三校2021-2022学年高二上学期期中联考化学(理科)试题安徽省怀宁县第二中学2021-2022学年高二上学期期中考试化学试题四川省邻水实验学校2021-2022学年高二上学期期中考试化学试题吉林省白城市第十四中学2021-2022学年高二上学期期中考试化学试卷题广东省深圳市龙华中学2021-2022学年高二上学期第二次考试化学试题湖南省常德市2018-2019学年高一下学期期中考试化学试题浙江省嘉兴市八校联盟2022-2023学年高二上学期期中联考化学试题(已下线)专题03 化学反应速率及影响因素、活化能【考题猜想】(9大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)广东省清远市"四校联盟"期中考试2023-2024学年高二上学期11月期中化学试题(已下线)专题06 化学反应的速率与限度(考题猜想)(8大题型)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)(已下线)2010年河南省许昌市六校联考高一下学期期末考试化学试题(已下线)2010年黑龙江省哈六中高一下学期期末考试化学试题(已下线)2010年山西省汾阳中学高二上学期第二次月考(化学)(已下线)2012-2013学年吉林省白山市第一中学高一下学期期末考试化学试卷(已下线)2014届天津市和平区高三上学期期末考试化学试卷(已下线)2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(已下线)2013-2014陕西省岐山县第二学期高一期末化学试卷2014-2015河北省唐山市一中高二下学期开学调研化学试卷2014-2015学年湖北省松滋一中高一下学期6月月考化学试卷2015-2016学年吉林省汪清县第六中学高二上学期9月月考化学试卷2016届湖南省常德一中高三上学期第五次月考化学试卷2015-2016学年四川省彭州中学高二下2月月考化学试卷2015-2016学年江苏省启东中学高一下第二次月考化学试卷2015-2016学年甘肃省武威二中高一下第二次月考化学试卷2015-2016学年中国石油天然气管道局中学高一下第二次月考化学试卷2015-2016学年吉林东北师大附属实验高一下期末化学试卷2015-2016学年江苏省前黄高中高一下期末化学试卷2016-2017学年辽宁省大连市第二十中学高二上9月月考化学试卷2016-2017学年北大附中河南分校高二上第一次月考化学卷黑龙江省哈尔滨师大附中2016-2017学年高二10月月考化学卷2016-2017学年天津市静海一中高二上9月调研化学试卷2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷河北省定州市第二中学2016-2017学年高一4月月考化学试题黑龙江省虎林市高级中学2016-2017学年高一5月月考化学试题甘肃省天水市第一中学2016-2017学年高一下学期第二次月考(B卷)化学试题云南省中央民族大学附属中学芒市国际学校2016-2017学年高一下学期期末考试化学试题河北省张家口市2016-2017学年高一下学期期末考试化学试题山东省济宁市微山县第二中学2017-2018学年高二上学期第一次月考化学试题甘肃省武威第十八中学2017-2018学年高二上学期第二次月考化学试题高中化学人教版 选修四 第二章 化学反应速率和化学平衡 第一节 化学反应速率 化学反应速率安徽省宣城市三校(郎溪中学、宣城二中、广德中学)2017-2018学年高二上学期期中联考化学试题2017-2018学年高一化学人教版必修2:第二章检测题河南省鹤壁市淇滨高级中学2017-2018学年高一3月月考化学试题福建省永春县第一中学2017-2018高一下学期期末考试化学试题吉林省长春汽车经济开发区第三中学2018-2019学年高二上学期10月月考化学试题【全国百强校】山西省山西大学附属中学2018-2019学年高二上学期10月模块诊断化学试题湖南省娄底市第四中学2018-2019学年高二上学期10月月考化学试题河北省香河县第三中学2018-2019学年高二上学期第一次(10月)月考化学试题(已下线)2019年3月30日 《每日一题》 必修2 周末培优(已下线)2019年3月31日 《每日一题》 必修2 每周一测福建省泉州市泉港区第一中学2018-2019学年高二下学期第二次月考化学试题陕西省吴起高级中学2018-2019学年高一下学期第二次月考能力卷化学试题西藏林芝一中2018-2019学年高一下学期期末考试化学试题河北省承德一中2017-2018学年高二第二次月考化学试卷云南省开远市实验中学2019-2020学年高二上学期开学考试化学试题天津市静海区四校2019-2020学年高二上学期9月联考化学试题甘肃省甘谷第一中学2019-2020学年高二上学期第一次月考化学试题吉林省白山市抚松六中2019-2020学年高二上学期第一次月考化学试卷山东省济宁市微山县第二中学2019-2020学年高二10月月考化学试题甘肃省张掖市临泽县第一中学2019-2020学年高二上学期9月月考化学试题湖北省黄冈市浠水县实验高级中学2019-2020学年高二上学期9月份月考化学试题天津市部分区2019-2020学年高二上学期期末考试化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 转化率与产率的相关计算(基础过关)(已下线)【新东方】2020-12河南省新乡市卫辉高中2019-2020学年高一下学期第一次调研考试化学试题(已下线)【南昌新东方】2019 南昌一中 高一下第二次月考辽宁省锦州市黑山县黑山中学2019-2020学年高一6月质量检测化学试题甘肃省定西市岷县第一中学2019-2020学年高一下学期第二次月考化学试题河南省兰考县第三高级中学卫星试验部2020-2021学年高二上学期第一次月考化学试题高一必修第二册(人教2019版)第六章 第二节 化学反应的速率与限度 课时1 化学反应的速率安徽省定远县育才学校2020-2021学年高二上学期第一次月考化学试题(已下线)【全国百强校】云南省曲靖市第一中学2018-2019学年高一5月月考化学试题广东省江门市第二中学2020-2021学年高二上学期第一次月考化学试题黑龙江省伊春市伊美区第二中学2020-2021学年高二上学期第一次月考化学试题四川省自贡市江姐中学2020-2021学年高二上学期第一次月考化学试题宁夏长庆高级中学2020-2021学年高二上学期第一次月考化学试题安徽省六安市霍邱一中2019-2020学年高一下学期期末考试化学试题(已下线)练习5 化学反应速率-2020-2021学年【补习教材·寒假作业】高二化学(苏教版)山西省沁县中学2020-2021学年高二上学期第一次月考化学试题西藏日喀则市上海实验学校2020-2021学年高二上学期期中考试化学试题福建省泉州科技中学2020-2021学年高一下学期第一次月考化学试题(已下线)专题讲座(七) 常考速率、平衡图像题解题策略(精讲)-2022年一轮复习讲练测(已下线)专题2.1.1 化学反应速率(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)宁夏海原第一中学2020-2021学年高一下学期期末考试化学试题重庆市西南大学附属中学校2021-2022学年高二上学期第一次定时检测化学试题甘肃省民勤县第一中学2021-2022学年高二上学期第一次月考化学试题河北省藁城新冀明中学2021-2022学年高二上学期10月月考化学试题广东省梅州市大埔县田家炳实验中学2021-2022学年高二上学期第一次段考(月考)化学试题黑龙江省哈尔滨市依兰县高级中学2021-2022学年高二上学期第一次月考化学试题河南省濮阳县实验高中2021-2022学年高二上学期第二次月考化学试题(已下线)2.1.1 化学反应速率(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)山西省运城市新绛中学校2022届高三10月月考化学试题重庆市青木关中学校2020-2021学年高一下学期第四次月考化学试题陕西省西安市鄠邑区第二中学2022-2023学年高二上学期第一次月考化学试题 黑龙江省牡丹江市第三高级中学2022-2023学年高三上学期第三次月考化学试题四川省凉山宁南中学2021-2022学年高二上学期第一次月考化学试题陕西省渭南市集才中学老城分校2021-2022学年高三上学期期末考试化学试题广东省茂名市第十六中学2021-2022学年高二10月月考化学试题广西南宁市第五十六中学2022-2023学年高二上学期月考化学试题浙江省宁波市姜山中学2022-2023学年高一下学期3月月考化学试题第六章 化学反应与能量(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)甘肃省兰州市等2地2022-2023学年高二上学期12月期末考试化学试题(已下线)专题突破卷08 化学反应速率与化学平衡 ?-2024年高考化学一轮复习考点通关卷(新教材新高考)第1课时 化学反应速率云南省楚雄第一中学2022-2023学年高一下学期期末考试化学试题辽宁省东港市第二中学2023-2024学年高二上学期开学考试化学试题云南省宣威市第三中学2023-2024学年高三上学期收心考化学试题第二章 化学反应速率与化学平衡 第一节 化学反应速率 第1课时 化学反应速率四川省凉山州民族中学2023-2024学年高二上学期10月月考化学试题(已下线)第六章 化学反应与能量【单元测试B卷】新疆兵团第三师图木舒克市鸿德实验学校2023-2024学年高二上学期第一次月考化学试题
3 . 一定温度下,在2 L的恒容密闭容器中发生反应:A(g)+2B(g) 3C(g)反应过程中的部分数据如下表所示:
3C(g)反应过程中的部分数据如下表所示:
下列说法正确的是
 3C(g)反应过程中的部分数据如下表所示:
3C(g)反应过程中的部分数据如下表所示:| 时间(t/min) | 物质的量(n/mol) | ||
| n(A) | n(B) | n(C) | |
| 0 | 2.0 | 2.4 | 0 |
| 5 | 0.9 | ||
| 10 | 1.6 | ||
| 15 | 1.6 | ||
| A.0~5 min用A表示的平均反应速率为0. 09 mol·L-1·min-1 |
| B.该反应在10 min后才达到平衡 |
| C.平衡状态时,c(C)=0.6 mol·L-1 |
| D.物质B的平衡转化率为20% |
您最近一年使用:0次
2022-09-13更新
|
2728次组卷
|
36卷引用:青海省海西蒙古族藏族自治州德令哈市海西州高级中学2020-2021学年高二上学期期中考试化学试题
青海省海西蒙古族藏族自治州德令哈市海西州高级中学2020-2021学年高二上学期期中考试化学试题浙江省东阳中学2019-2020学年高一下学期期中考试化学试题四川省射洪中学校2019-2020学年高一下学期期中考试化学试题浙江省宁波市六校2020-2021学年高二上学期期中联考化学试题广东省大联考2021-2022学年高一下学期期中检测化学试题山东省济宁市泗水县2021-2022学年高二上学期期中考试化学试题广东省广州市天河区第八十九中学2022~2023学年高一下学期期中考试化学选考试题(已下线)浙江省2020年1月选考(学考)化学试题2020年浙江省高考化学试卷(1月选考)浙江省丽水市松阳县第二中学2019-2020学年高二4月线上教学检测化学试题河南省洛阳市2019-2020学年高一下学期期末考试化学试题河南省豫南九校2020-2021学年高二上学期第二次联考化学试题山东省滨州渤海中学2020-2021学年高二上学期10月月考化学试题高中化学苏教2019版必修第二册-专题6 第一单元综合拔高练人教版2019必修第二册 第六章 第二节综合拔高练(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)浙江省杭州市长征中学2020-2021学年高二下学期第二学期阶段性练习化学试题黑龙江省牡丹江市海林市朝鲜族中学2020-2021学年高一5月月考化学试题选择性必修1(SJ)专题2第二单元课时3 化学平衡常数平衡转化率(已下线)课时36 化学平衡及平衡移动-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题12.化学反应速率与化学平衡-十年(2012-2021)高考化学真题分项汇编(浙江专用)甘肃省张掖市第二中学2021-2022学年高二上学期10月月考(B班)化学试题甘肃省张掖市第二中学2021-2022学年高二上学期10月月考(A班)化学试题(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)浙江省吴兴高级中学高二 2021-2022学年上学期10月月考化学试题广东省汕头市2021-2022学年高一下学期期末教学质量检测化学试题浙江省湖州中学2021-2022学年高一下学期第一次质量检测化学试题湖北省黄州中学2022--2023学年高二上学期10月月考化学试题(已下线)热点情景汇编-专题七 化学反应速率与平衡(已下线)题型24 单反应体系中的化学平衡(已下线)专题15 化学反应速率和化学平衡2.2.3化学平衡常数 课后广西河池市八校联考2022-2023学年高一下学期4月月考化学试题黑龙江省鹤岗市第一中学2022-2023学年高一下学期期末考试化学试题
名校
4 . (1)对于下列反应:2SO2 + O2 2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为
2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为___________ ,用O2浓度变化来表示的反应速率为___________ 。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为___________ 。
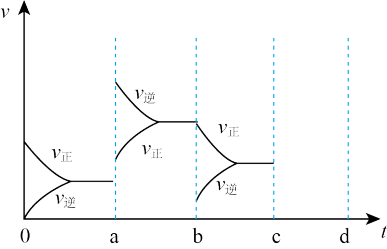
(2)如图表示在密闭容器中反应:2SO2+O2 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是__________ ;b c过程中改变的条件可能是__________ ;若增大压强时,反应速度变化情况画在cd处__________ 。
 2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为
2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为(2)如图表示在密闭容器中反应:2SO2+O2
 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是
您最近一年使用:0次
2020-12-10更新
|
123次组卷
|
8卷引用:青海省海南州贵德高级中学2020-2021学年高二下学期期中化学试题
5 . 在2 L的密闭容器中,发生以下反应:2A(g)+B(g)⇌2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol·L-1·s-1,则10秒钟时,容器中B的物质的量是( )
| A.1.6 mol | B.2.8 mol | C.2.4 mol | D.1.2 mol |
您最近一年使用:0次
2020-10-13更新
|
1547次组卷
|
80卷引用:青海省海南州贵德高级中学2020-2021学年高二下学期期中化学试题
青海省海南州贵德高级中学2020-2021学年高二下学期期中化学试题(已下线)2011-2012年山东省莒南县三中高二上学期期中考试化学试卷(已下线)2011-2012年湖南省醴陵二中、醴陵四中高二上学期期中考试化学试卷(已下线)2011-2012学年江西省新余九中高二上学期期中考试化学试卷(已下线)2014-2015学年湖南省娄底市高二上学期期中联考化学试卷(已下线)2014-2015河北省石家庄第二实验中学高二上学期期中化学(理)试卷2015-2016学年山西大学附中高一下期中化学试卷2015-2016学年甘肃省白银市靖远一中高二上期中化学试卷江西省上饶市铅山一中、弋阳一中2016-2017学年高二上学期期中化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高二上学期期中考试(A卷)化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高二上学期期中考试化学试题(B卷)【全国百强校】吉林省长春外国语学校2018-2019学年高二上学期期中考试化学试题2甘肃省镇原县第二中学2018-2019学年高二上学期期中考试化学试题江苏省宝应中学2017-2018学年高二第二学期期中考试化学试题新疆自治区阿克苏地区库车县伊西哈拉镇中学2018-2019学年高二上学期期中考试化学试题新疆昌吉市教育共同体2019-2020学年高二上学期期中考试化学试题河南省安阳市安阳县第一高级中学2019-2020学年高二上学期期中考试化学试题新疆昌吉回族自治州玛纳斯县第一中学2019-2020学年高二上学期期中考试化学试题辽宁省葫芦岛市第八高级中学2019-2020学年高二上学期期中考试化学试题河北省唐山市玉田县2019-2020学年高二上学期期中考试化学试题北京市昌平区新学道临川学校2019-2020学年高二上学期期中考试化学试题广东省广州市2019-2020学年高二上学期期中模拟测试化学试题(一)河北省石家庄市元氏县第四中学2019-2020学年高一下学期期中考试化学试题内蒙古赤峰学院附属中学2020-2021学年高二上学期期中考试化学试题海南省海南鑫源高级中学2019-2020学年高二上学期期中考试化学试题湖南省常德市一中2020-2021学年高一下学期期中考试化学试题青海省海东市第二中学2020-2021学年高二4月月考化学试题安徽省六安市新安中学2021-2022学年高二上学期期中考试化学试题辽宁省重点高中沈阳市联合体2021-2022高一下学期期中考试化学试题甘肃省兰州市西固区三校2021-2022学年高二上学期期中联考化学(理科)试题海南省鑫源中学2021-2022学年高二上学期期中考试化学试题四川省巴中市第三中学2021-2022学年高二上学期期中考试化学试题广东省广州市执信中学2020-2021学年高一下学期期中考试化学试题(已下线)2011-2012学年甘肃兰州一中高二上学期期末考试化学试卷(已下线)2012-2013学年广东省实验中学高一下学期期末考试化学试卷2014-2015甘肃省高台县一中高二上学期期末考试化学试卷2015-2016学年广西南宁市上林中学高二上学期期末化学试卷2015-2016学年黑龙江省海林林业局一中高二上期末考试化学试卷2016届河北省定州中学高三下周练(一)化学试卷2016届河北定州中学高三下学期周练二化学试卷2017届江西省赣中南五校高三上学期第一次模拟考试化学试卷2016-2017学年河北省景县中学高二上学期摸底化学试卷2016-2017学年广东佛山一中高二上第一次段考化学卷2016-2017学年甘肃省天水三中高二上10月学段考理化学卷2016-2017学年黑龙江省大庆市杜蒙县高二上月考一化学卷2016-2017学年天津市宝坻区高二11月联考化学试卷河北省故城县高级中学2017-2018学年高二9月月考化学试题黑龙江省双鸭山市第一中学2017-2018学年高二9月月考化学试题河北省承德市第一中学2017-2018学年高二上学期第一次月考化学试题云南省姚安县第一中学2017-2018学年高二10月月考化学试题四川省成都市七中实验学校2017-2018学年高二10月月考化学试题天津市杨柳青一中2017-2018第一学期高二第一次化学月考安徽省滁州市定远县西片三校2017-2018学年高二上学期期末考试化学试题广西桂林市第十八中学2017-2018学年高二下学期开学考试化学试题(已下线)2018年9月30日《每日一题》人教选修4每周一测【全国百强校】甘肃省兰州市第一中学2018-2019学年高二上学期9月月考化学试题江西省南昌市第十中学2018-2019学年高二上学期第一次月考化学试题陕西省西安市远东第一中学2018-2019学年高二上学期10月月考化学试题宁夏青铜峡市高级中学(吴忠中学分校)2019-2020学年高二上学期第一次月考化学试题2019-2020学年人教版鲁科版高中化学必修2第二章《化学键 化学反应与能量》单元测试卷课时1 化学反应的速率——A学习区 夯实基础(人教版必修2)课时1 化学反应的速率——A学习区 夯实基础(人教版(2019)第二册)四川省攀枝花市第十五中学2019-2020学年高二上学期第一次月考化学试题必修第二册RJ第6章第二节 化学反应的速率与限度 课时1河北省邢台市第七中学2019-2020学年高二上学期10月月考化学试题四川省广安市武胜烈面中学校2020-2021学年高二上学期10月月考化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第3节 化学反应的速率 课时1 化学反应速率宁夏长庆高级中学2020-2021学年高二上学期第一次月考化学试题湖北省石首市第一中学2020-2021学年高二上学期10月月考化学试题(已下线)6.1.1 化学反应速率 练习-2020-2021学年下学期高一化学同步精品课堂(苏教版2019必修第二册)湖南师范大学附属中学2020-2021学年高一下学期第一次月考化学试题(苏教版2019)必修第二册专题6 化学反应与能量变化 第一单元 化学反应速率与反应限度 课时1 化学反应速率江西省新余市渝水区第一中学2019-2020学年高二上学期第一次月考化学试题四川省成都市简阳市阳安中学2021-2022学年高二上学期9月月考化学试卷西藏日喀则市南木林高级中学2020-2021学年高一下学期期末测试化学试题(已下线)第09讲 化学反应速率(讲义)-【寒假自学课】2023年高一化学寒假精品课(人教版2019必修第二册)(已下线)第13讲 化学反应速率(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)河北省邯郸市大名县第一中学2021-2022学年高一下学期开学考试化学试题安徽省芜湖市无为襄安中学2022-2023高二上学期第一次月考化学试题天津市蓟州中学2022-2023学年高二上学期第一次月考化学试题
6 . 把0.6molW气体和0.5molX气体混合于2L密闭容器中,使它们发生如下反应:4W(g)+3X(g)⇌2Y(g)+nZ(g)。2min末已生成0.2molY,若测知以Z的浓度变化表示的反应速率为0.0025mol/(L·s),试计算:
(1)前2min内用W的浓度变化表示的平均反应速率为__ 。
(2)2min末时X的浓度为___ 。
(3)化学反应方程式中n=__ 。
(4)2min末,W的转化率__ 。
(1)前2min内用W的浓度变化表示的平均反应速率为
(2)2min末时X的浓度为
(3)化学反应方程式中n=
(4)2min末,W的转化率
您最近一年使用:0次
解题方法
7 . 气态反应A(g)+3B(g)=2C(g)+2D(g),在四种不同条件下的反应速率如下,其中反应速率最快的是( )
| A.vA=0.15mol/(L·min) | B.vB=0.6mol/(L·min) |
| C.vC=0.4mol/(L·min) | D.vD=0.6mol/(L·min) |
您最近一年使用:0次
名校
8 . 在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表
2NO2(g)体系中,n(NO)随时间的变化如表
(1)下图表示NO2的变化的曲线是________ 。用O2表示从0~2 s内该反应的平均速率v=________ 。
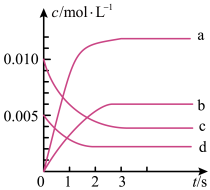
(2)能说明该反应已达到平衡状态的是________ (填字母,下同)。
a. v(NO2)、v(O2)、v(NO)相等
b. 容器内各物质浓度保持不变
c. 该反应v逆=v正
d. 容器内总质量保持不变
(3)为使该反应的反应速率增大,下列措施正确的是________ 。
a 及时分离出NO2气体 b 适当升高温度
c 增大O2的浓度 d 选择高效催化剂
 2NO2(g)体系中,n(NO)随时间的变化如表
2NO2(g)体系中,n(NO)随时间的变化如表| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)下图表示NO2的变化的曲线是

(2)能说明该反应已达到平衡状态的是
a. v(NO2)、v(O2)、v(NO)相等
b. 容器内各物质浓度保持不变
c. 该反应v逆=v正
d. 容器内总质量保持不变
(3)为使该反应的反应速率增大,下列措施正确的是
a 及时分离出NO2气体 b 适当升高温度
c 增大O2的浓度 d 选择高效催化剂
您最近一年使用:0次
9 . 将等物质的量的A、B混合于5L的密闭容器中,发生反应: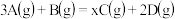 ,经5min后,测得D的浓度为
,经5min后,测得D的浓度为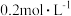 ,
, ,C的平均反应速率是
,C的平均反应速率是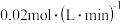 。
。 请写出计算过程
请写出计算过程 求:
求:
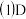 的平均反应速率
的平均反应速率_____ ;
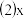 的值
的值_____ ;
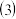 反应开始前放入容器中的A、B的物质的量
反应开始前放入容器中的A、B的物质的量_____ ;
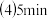 时B的物质的量浓度
时B的物质的量浓度_____ 。
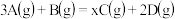 ,经5min后,测得D的浓度为
,经5min后,测得D的浓度为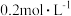 ,
, ,C的平均反应速率是
,C的平均反应速率是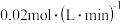 。
。 请写出计算过程
请写出计算过程 求:
求: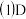 的平均反应速率
的平均反应速率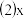 的值
的值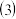 反应开始前放入容器中的A、B的物质的量
反应开始前放入容器中的A、B的物质的量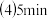 时B的物质的量浓度
时B的物质的量浓度
您最近一年使用:0次
名校
10 . 把0.4mol X气体和0.6mol Y气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)═nZ(g)+6W(g)。2min时生成0.3mol W,此时测知以Z的浓度变化表示的反应速率为0.05mol•L﹣1•min﹣1。
试计算:
(1)前2min内用X的浓度变化表示的平均反应速率为多少?____
(2)计算n值和2min末时Y的浓度(写出必要的计算过程)。______
(3)室温下将n体积pH=10和m体积pH=13两种NaOH溶液混合得pH=12的NaOH溶液,则n:m=________
试计算:
(1)前2min内用X的浓度变化表示的平均反应速率为多少?
(2)计算n值和2min末时Y的浓度(写出必要的计算过程)。
(3)室温下将n体积pH=10和m体积pH=13两种NaOH溶液混合得pH=12的NaOH溶液,则n:m=
您最近一年使用:0次



