名校
解题方法
1 . 密闭容器中发生的某化学反应,各物质的分子数目随时间变化情况如图1所示,物质Y和Z的质量随时间变化情况如图2所示。下列说法正确的是


| A.该反应前后分子总数保持不变 |
| B.参加反应的X与Y的质量比为2:7 |
| C.该反应的化学方程式可表示为2X+Y=Z |
| D.若Z的相对分子质量为17,则Y的相对分子质量为28 |
您最近一年使用:0次
解题方法
2 . 实验是化学的灵魂。下列实验装置或操作正确的是
| A | B | C | D |
 | 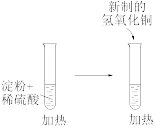 | 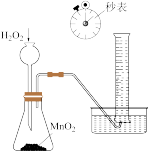 | 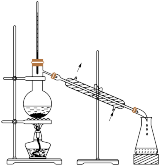 |
| 收集氨气 | 检验淀粉水解产物 | 测量 分解速率 分解速率 | 分离水和苯的混合液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . I.H2O2能缓慢分解生成水和氧气,但分解速率较慢,加入催化剂会加快分解速率。某化学兴趣小组为研究不同催化剂对H2O2分解反应的催化效果,设计了如图甲、乙、丙所示的三组实验。
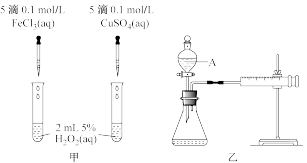
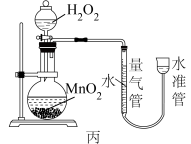
(1)定性分析:可以通过观察甲装置的_______ 现象,而定性得出关于Fe3+和Cu2+催化效果的结论。有同学认为该实验不能比较Fe3+和Cu2+的催化效果,理由是_______ 。
(2)定量测定:用乙装置做对照试验,仪器A的名称是_______ 。实验时组装好装置乙,关闭A的旋塞,将注射器活塞向外拉出一段距离后松开,观察活塞是否回到原来的位置。这一操作的实验目的是_______ 。实验时以2min时间为准,需要测量的数据是_______ 。(其它可能影响实验的因素均已忽略)
II.CO2可用于合成多种化工原料。用 CO2生产绿色燃料甲醇时发生反应A:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
(3)在体积为 1 L 的恒容密闭容器中发生反应 A,如图是在三种投料,即[n(CO2),n(H2)]分别为:[1mol,3mol]、[1mol,4mol]、[1mol,6mol]下,反应温度对 CO2平衡转化率影响的曲线。
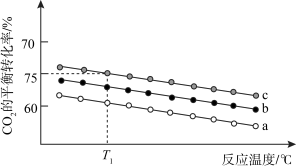
①反应A的ΔH1_______ 0(填“>”或“<”)。
②曲线c对应的投料是_______ 。
(4)在一定条件下,利用 CO2合成 CH3OH 的反应过程中会有副反应:CO2(g) + H2(g)⇌CO(g) + H2O(g)。压强一定时,将初始投料比一定的 CO2和H2按一定流速通过催化剂甲,经过相同时间(反应均未达到平衡)时,温度对 CH3OH、CO 的产率影响如图 1 所示,温度对CO2的转化率影响如图2所示。
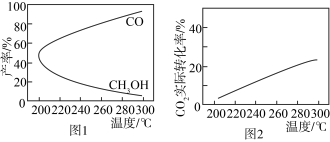
由图像可知,升高温度,CO2的实际转化率提高而甲醇的产率降低,其原因是_______ 。


(1)定性分析:可以通过观察甲装置的
(2)定量测定:用乙装置做对照试验,仪器A的名称是
II.CO2可用于合成多种化工原料。用 CO2生产绿色燃料甲醇时发生反应A:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1(3)在体积为 1 L 的恒容密闭容器中发生反应 A,如图是在三种投料,即[n(CO2),n(H2)]分别为:[1mol,3mol]、[1mol,4mol]、[1mol,6mol]下,反应温度对 CO2平衡转化率影响的曲线。

①反应A的ΔH1
②曲线c对应的投料是
(4)在一定条件下,利用 CO2合成 CH3OH 的反应过程中会有副反应:CO2(g) + H2(g)⇌CO(g) + H2O(g)。压强一定时,将初始投料比一定的 CO2和H2按一定流速通过催化剂甲,经过相同时间(反应均未达到平衡)时,温度对 CH3OH、CO 的产率影响如图 1 所示,温度对CO2的转化率影响如图2所示。

由图像可知,升高温度,CO2的实际转化率提高而甲醇的产率降低,其原因是
您最近一年使用:0次
4 . 某化学小组欲测定KClO3溶液与NaHSO3溶液反应的化学反应速率,所用试剂为10mL0.1mol·L-1KClO3溶液和10mL0.3mol·L-1NaHSO3溶液,所得溶液中c(Cl-)随时间变化的曲线如图1所示,用Cl-表示的反应速率随时间的变化情况如图2所示。


(1)配平该反应的化学方程式:_______ 。
_____KClO3+_____NaHSO3=_____KCl+_____Na2SO4+_______H2SO4
(2)根据实验数据可知,该反应在0~7min内的平均反应速率v(Cl-)=_______ mol·L-1·min-1。
(3)图2中阴影部分面积表示的是_______ 。
(4)分析图2发现,在反应过程中,该反应的反应速率先增大后减小。对于反应速率先增大的原因该小组进行如下探究实验。已知 对该反应的反应速率无影响。
对该反应的反应速率无影响。
实验1:向2个烧杯中分别加入10mL0.1mol·L-1KCO3溶液和10mL0.3 mol·L-1NaHSO3溶液,将其中一个烧杯在50℃下进行反应。
实验2:分别向2个烧杯中加入10mL0.1mol·L-1KCO3溶液;向烧杯i中加入1mL蒸馏水,向烧杯ii中加入1mL0.1 mol·L-1H2SO4溶液;再分别向2个烧杯中加入10mL0.3mol·L-11NaHSO3溶液。
实验3:取10mL0.1mol∙·L-1KClO3溶液于烧杯中,先加入少量NaCl固体,再加入10mL0.3mol·L-1NaHSO3溶液。
①实验1探究的是_______ ,可以用_______ 的方法控制温度为50℃。
②实验2中,向烧杯i中加入1mL蒸馏水的作用是_______ 。
③实验3探究的可能是_______ 。


(1)配平该反应的化学方程式:
_____KClO3+_____NaHSO3=_____KCl+_____Na2SO4+_______H2SO4
(2)根据实验数据可知,该反应在0~7min内的平均反应速率v(Cl-)=
(3)图2中阴影部分面积表示的是
(4)分析图2发现,在反应过程中,该反应的反应速率先增大后减小。对于反应速率先增大的原因该小组进行如下探究实验。已知
 对该反应的反应速率无影响。
对该反应的反应速率无影响。实验1:向2个烧杯中分别加入10mL0.1mol·L-1KCO3溶液和10mL0.3 mol·L-1NaHSO3溶液,将其中一个烧杯在50℃下进行反应。
实验2:分别向2个烧杯中加入10mL0.1mol·L-1KCO3溶液;向烧杯i中加入1mL蒸馏水,向烧杯ii中加入1mL0.1 mol·L-1H2SO4溶液;再分别向2个烧杯中加入10mL0.3mol·L-11NaHSO3溶液。
实验3:取10mL0.1mol∙·L-1KClO3溶液于烧杯中,先加入少量NaCl固体,再加入10mL0.3mol·L-1NaHSO3溶液。
①实验1探究的是
②实验2中,向烧杯i中加入1mL蒸馏水的作用是
③实验3探究的可能是
您最近一年使用:0次
名校
5 . 研究化学反应的反应速率具有重要的现实意义。
I.
(1)已知反应: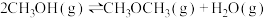 在某温度下的平衡常数为400。此温度下,在密闭容器中加入
在某温度下的平衡常数为400。此温度下,在密闭容器中加入 ,反应到某时刻测得各组分的浓度如下:
,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v正_______ v逆(填“>”、“<”或“=”)。
②若加入 后,经10min反应达到平衡,此时
后,经10min反应达到平衡,此时
_______ ,该时间内反应速率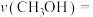
_______ 。
II. 是一种绿色氧化还原试剂,在化学研究中应用广泛。
是一种绿色氧化还原试剂,在化学研究中应用广泛。
(2)某小组拟在同浓度 的催化下,探究
的催化下,探究 浓度对
浓度对 分解反应速率的影响。限选试剂与仪器:30%
分解反应速率的影响。限选试剂与仪器:30% 、
、 、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。
、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。
①写出本实验 分解反应的化学方程式
分解反应的化学方程式_______ 。
②设计实验方案:在不同 浓度下,需测定的物理量为
浓度下,需测定的物理量为_______ 。

(3)利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有 气体)进行实验。可观察到B瓶中气体颜色比A瓶中的
气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_______ (填“深”或“浅”),其原因是_______ (填字母)。
a. 分解放热,温度升高
分解放热,温度升高
b.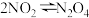 为放热反应
为放热反应
c.升温,平衡逆向移动
I.
(1)已知反应:
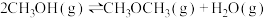 在某温度下的平衡常数为400。此温度下,在密闭容器中加入
在某温度下的平衡常数为400。此温度下,在密闭容器中加入 ,反应到某时刻测得各组分的浓度如下:
,反应到某时刻测得各组分的浓度如下:| 物质 |  |  |  |
浓度/( ) ) | 0.44 | 0.6 | 0.6 |
①比较此时正、逆反应速率的大小:v正
②若加入
 后,经10min反应达到平衡,此时
后,经10min反应达到平衡,此时
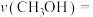
II.
 是一种绿色氧化还原试剂,在化学研究中应用广泛。
是一种绿色氧化还原试剂,在化学研究中应用广泛。(2)某小组拟在同浓度
 的催化下,探究
的催化下,探究 浓度对
浓度对 分解反应速率的影响。限选试剂与仪器:30%
分解反应速率的影响。限选试剂与仪器:30% 、
、 、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。
、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。①写出本实验
 分解反应的化学方程式
分解反应的化学方程式②设计实验方案:在不同
 浓度下,需测定的物理量为
浓度下,需测定的物理量为
(3)利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有
 气体)进行实验。可观察到B瓶中气体颜色比A瓶中的
气体)进行实验。可观察到B瓶中气体颜色比A瓶中的a.
 分解放热,温度升高
分解放热,温度升高b.
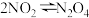 为放热反应
为放热反应c.升温,平衡逆向移动
您最近一年使用:0次
解题方法
6 . 下列操作规范且能达到实验目的的是


| A.若装置I中反应速率①>②,可以验证Fe3+的催化效果比Cu2+好 |
B.由装置II中颜色的变化可以判断反应N2O4(g) 2NO2(g) △H>0 2NO2(g) △H>0 |
| C.可通过装置III测定反应速率的大小 |
| D.可用装置IV来测定醋酸的浓度 |
您最近一年使用:0次
2022-11-13更新
|
158次组卷
|
2卷引用:山东省日照市2022-2023学年高二上学期期中校际联考化学试题
7 . 下列实验装置及表述正确的是
| A | B | C | D |
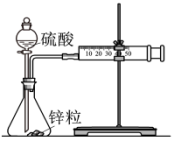 | 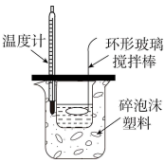 |  | 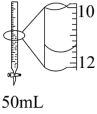 |
| 测定锌与稀硫酸反应速率 | 测定中和热 | 该装置可用制备 | 酸式滴定管中还剩余38.40mL的溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-11-12更新
|
153次组卷
|
3卷引用:浙江省“七彩阳光”新高考研究联盟2022-2023学年高二上学期期中考试化学试题
浙江省“七彩阳光”新高考研究联盟2022-2023学年高二上学期期中考试化学试题(已下线)【2022】【高二上】【期中考】【七彩阳光(夏衍中学+西湖高级)】【高中化学】【霍钰涵收集】陕西省宝鸡市金台区2023-2024学年高二上学期期中考试化学试题
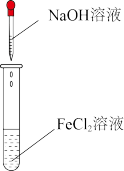
8 . 下列有关实验探究方案设计合理的是
| 选项 | 实验方案 | 实验目的 |
| A | 向等体积等浓度的H2O2溶液中分别加入5滴等浓度的CuSO4和FeCl3溶液,观察气体产生的速度 | 比较Cu2+和Fe3+的催化效果 |
| B | 先将注射器充满NO2气体,然后将活塞往里推,压缩体积,观察注射器内气体颜色变化 | 验证压强对平衡的影响 |
| C | 在锥形瓶内各盛有2g锌粒(颗粒大小基本相同),然后通过分液漏斗分别加入40mL1mol/L和40mL18mol/L的硫酸,比较两者收集10mL氢气所用的时间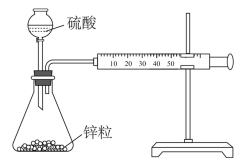 | 探究硫酸浓度对反应速率的影响 |
| D | 在FeCl3+3KSCN Fe(SCN)3+3KCl平衡体系中加入KCl晶体,观察并比较实验现象 Fe(SCN)3+3KCl平衡体系中加入KCl晶体,观察并比较实验现象 | 探究离子浓度对平衡移动的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-11-12更新
|
161次组卷
|
2卷引用:福建省龙岩市一级校联盟(九校)联考2022-2023学年高二上学期半期考化学试题
名校
解题方法
9 . 下列装置正确且能达到相应实验目的的是
 |  |  |  |
| 测定中和热 | 配制溶液时“摇匀” | 测定化学反应速率 | 测定 的浓度 的浓度 |
| A | B | C | D |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-11-12更新
|
205次组卷
|
3卷引用:湖北省荆、荆、襄、宜四地七校考试联盟2022-2023学年高二上学期期中联考化学试题
名校
10 . 下列说法不正确的是
| A.需要加热才能发生的反应可能是放热反应 |
| B.任何吸热反应在常温条件下都不能发生 |
| C.反应物和生成物所具有的总能量的相对大小决定了反应是放热还是吸热 |
| D.可以利用物质的颜色变化和浓度变化间的比例关系来测量反应速率 |
您最近一年使用:0次
2022-11-10更新
|
144次组卷
|
2卷引用:浙江省嘉兴市第一中学2022-2023学年高二上学期期中检测化学试题



