名校
解题方法
1 . 已知CaCO3和盐酸反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑,下列措施中可使生成CO2的速率加快的是(不考虑CaCO3与盐酸接触面积改变的影响)
| A.增加CaCO3的量 |
| B.增加盐酸的浓度 |
| C.增加盐酸的量 |
| D.减小CaCl2的浓度 |
您最近一年使用:0次
2023-07-05更新
|
448次组卷
|
11卷引用:【全国百强校】宁夏回族自治区银川一中2018-2019学年高一下学期期中考试化学试题
【全国百强校】宁夏回族自治区银川一中2018-2019学年高一下学期期中考试化学试题吉林省汪清县第六中学2016-2017学年高一下学期第二次月考化学试题专题2 第一单元 第2课时 物质的检验 物质性质和变化的探究-高中化学苏教2019版必修第一册(已下线)第11讲 物质的性质和变化探究-【暑假自学课】2023年新高一暑假精品课(苏教版2019)江西省吉安市吉州区部分学校联考2022-2023学年高一下学期7月期末考试化学试题(已下线)6.2.1化学反应的速率-随堂练习河北省唐山市开滦第二中学2016-2017学年高二下学期期末考试化学试题四川省广安市岳池县顾县中学2019—2020学年第一学期高二上学期期中测试化学(选修四)试题人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第一节 化学反应速率 课时2 影响化学反应速率的因素海南省三亚华侨学校(南新校区)2021-2022学年高二上学期10月月考化学试题 云南省大理白族自治州民族中学2022-2023学年高二下学期开学考试化学试题
名校
解题方法
2 . 将盐酸滴到碳酸钙固体上,能使反应的最初速率加快的是:
| A.盐酸浓度不变,使用量增大1倍 |
| B.盐酸浓度增加1倍,用量减至1/2 |
| C.将碳酸钙粉末改为块状 |
| D.使反应在较低温度下进行 |
您最近一年使用:0次
解题方法
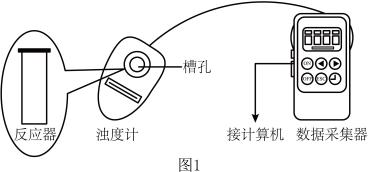
3 . 利用浊度计探究一定条件下反应物浓度对硫代硫酸钠( )溶液与硫酸溶液反应速率的影响。浊度计用于测量浑浊度的变化,产生的沉淀越多,浑浊度(单位为NTU)值越大。
)溶液与硫酸溶液反应速率的影响。浊度计用于测量浑浊度的变化,产生的沉淀越多,浑浊度(单位为NTU)值越大。
反应原理: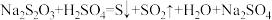
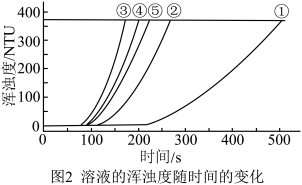
用图1所示装置进行如下表所示的5个实验,分别测量混合后溶液达到浑浊度为375NTU的过程中,浑浊度随时间变化情况。实验①~⑤所得数据如图2曲线①~⑤所示。
(1)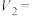
______ 。
(2)实验①③的目的是__________________ 。
(3)分析数据可得以下三个结论:
结论1:其它条件相同时, 浓度越大,反应速率越大;
浓度越大,反应速率越大;
①结论2:______________________________ ;
②结论3:其它条件相同时, 浓度改变对反应速率的影响程度大于
浓度改变对反应速率的影响程度大于 浓度改变对反应速率的影响程度。证据是
浓度改变对反应速率的影响程度。证据是________________________ 。
(4)已知浑浊度为375NTU时,产生S的质量为 g,则实验①反应开始到500s,用
g,则实验①反应开始到500s,用 浓度变化表示的平均反应速率为
浓度变化表示的平均反应速率为______  。
。
 )溶液与硫酸溶液反应速率的影响。浊度计用于测量浑浊度的变化,产生的沉淀越多,浑浊度(单位为NTU)值越大。
)溶液与硫酸溶液反应速率的影响。浊度计用于测量浑浊度的变化,产生的沉淀越多,浑浊度(单位为NTU)值越大。反应原理:
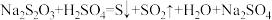
用图1所示装置进行如下表所示的5个实验,分别测量混合后溶液达到浑浊度为375NTU的过程中,浑浊度随时间变化情况。实验①~⑤所得数据如图2曲线①~⑤所示。


| 实验编号 |  溶液 溶液 |  溶液 溶液 | 蒸馏水 | ||
 | V/mL |  | V/mL | V/mL | |
| ① | 0.1 | 1.5 | 0.1 | V1 | 10 |
| ② | 0.1 | 2.5 | 0.1 | V2 | 9 |
| ③ | 0.1 | 3.5 | 0.1 | 3.5 | 8 |
| ④ | 0.1 | V3 | 0.1 | 2.5 | 9 |
| ⑤ | 0.1 | V4 | 0.1 | 1.5 | 10 |
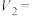
(2)实验①③的目的是
(3)分析数据可得以下三个结论:
结论1:其它条件相同时,
 浓度越大,反应速率越大;
浓度越大,反应速率越大;①结论2:
②结论3:其它条件相同时,
 浓度改变对反应速率的影响程度大于
浓度改变对反应速率的影响程度大于 浓度改变对反应速率的影响程度。证据是
浓度改变对反应速率的影响程度。证据是(4)已知浑浊度为375NTU时,产生S的质量为
 g,则实验①反应开始到500s,用
g,则实验①反应开始到500s,用 浓度变化表示的平均反应速率为
浓度变化表示的平均反应速率为 。
。
您最近一年使用:0次
名校
4 . 对于室温、一定体积容器内反应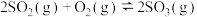 ,已知
,已知 完全反应放出热量为
完全反应放出热量为 。下列说法正确的是
。下列说法正确的是
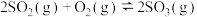 ,已知
,已知 完全反应放出热量为
完全反应放出热量为 。下列说法正确的是
。下列说法正确的是A.若以 投入参与反应,反应达平衡时 投入参与反应,反应达平衡时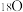 存在于 存在于 和 和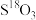 中 中 |
| B.增大容器体积能加快反应速率 |
C.增大 的浓度能加快反应速率 的浓度能加快反应速率 |
D.一定条件下,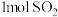 与 与 充分反应吸热 充分反应吸热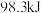 |
您最近一年使用:0次
名校
5 . 向绝热恒容密闭容器中通入 和
和 ,在一定条件下发生反应
,在一定条件下发生反应 ,正反应速率随时间变化的示意图如下图,下列结论中正确的个数为
,正反应速率随时间变化的示意图如下图,下列结论中正确的个数为
② 浓度:a点大于c点
浓度:a点大于c点
③反应物的总能量高于生成物的总能量
④逆反应速率图像在此时间段内和上图趋势相同
⑤混合物颜色不再变化,说明反应达到平衡
⑥达到平衡后,改变容器体积增大压强,逆反应速率可能先增大后减小
 和
和 ,在一定条件下发生反应
,在一定条件下发生反应 ,正反应速率随时间变化的示意图如下图,下列结论中正确的个数为
,正反应速率随时间变化的示意图如下图,下列结论中正确的个数为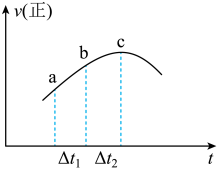
②
 浓度:a点大于c点
浓度:a点大于c点③反应物的总能量高于生成物的总能量
④逆反应速率图像在此时间段内和上图趋势相同
⑤混合物颜色不再变化,说明反应达到平衡
⑥达到平衡后,改变容器体积增大压强,逆反应速率可能先增大后减小
| A.2个 | B.3个 | C.4个 | D.5个 |
您最近一年使用:0次
2023-06-01更新
|
491次组卷
|
4卷引用:宁夏石嘴山市第三中学2023-2024学年高一下学期4月期中考试化学试题
名校
6 . 用0.1mol•L-1稀盐酸与锌反应制取氢气,不能使氢气生成速率增大的是
| A.对该反应体系加热 | B.不用锌片,改用锌粉 |
| C.加入少量NaCl溶液 | D.加入少量2mol•L-1硫酸 |
您最近一年使用:0次
名校
7 . 在一定条件下,可逆反应X(g)+3Y(g) 2Z(g)达到平衡时,测得X和Y转化的转化率均为25%,下列叙述正确的是
2Z(g)达到平衡时,测得X和Y转化的转化率均为25%,下列叙述正确的是
 2Z(g)达到平衡时,测得X和Y转化的转化率均为25%,下列叙述正确的是
2Z(g)达到平衡时,测得X和Y转化的转化率均为25%,下列叙述正确的是| A.升高温度,正反应速率增大,逆反应速率减小 |
| B.开始充入容器中的X、Y物质的量之比为1∶3 |
| C.若Y的反应速率为0.2 mol·L-1·s-1,则Z的反应速率为0.3 mol·L-1·s-1 |
| D.若容器体积不变,向容器中充入氦气,压强增大,反应速率增大 |
您最近一年使用:0次
2023-05-11更新
|
483次组卷
|
3卷引用:宁夏吴忠中学2022-2023学年高一下学期学业水平模拟考试(三)化学(B)试题
名校
8 . 一定条件下,容积2L的密闭容器中,将1mol L气体和0.5mol M气体混合,发生如下反应: ,5s时反应达到平衡,生成0.2mol R,测得Q的浓度为
,5s时反应达到平衡,生成0.2mol R,测得Q的浓度为 。计算:
。计算:
(1)化学方程式中a的值为___________ 。
(2)前5s内用M表示的化学反应速率为___________ ,L的转化率为___________ 。
(3)一定能使该反应的速率增大的措施有___________(填字母)。
(4)可认定上述可逆反应在一定条件下已达到化学平衡状态的是___________ (填字母)。
A.体系压强不再变化
B.体系的密度不再变化
C.
D.
E.Q(g)的物质的量浓度不再发生变化
 ,5s时反应达到平衡,生成0.2mol R,测得Q的浓度为
,5s时反应达到平衡,生成0.2mol R,测得Q的浓度为 。计算:
。计算:(1)化学方程式中a的值为
(2)前5s内用M表示的化学反应速率为
(3)一定能使该反应的速率增大的措施有___________(填字母)。
| A.其他条件不变,充入一定量气体L | B.降低温度 |
| C.保持温度不变,将容器的体积压缩 | D.保持体积不变,充入无关惰性气体 |
A.体系压强不再变化
B.体系的密度不再变化
C.

D.
E.Q(g)的物质的量浓度不再发生变化
您最近一年使用:0次
2023-04-26更新
|
336次组卷
|
2卷引用:宁夏吴忠中学2022-2023学年高一下学期学业水平模拟考试(三)化学(B)试题
名校
解题方法
9 . 把在空气中久置的铝片5.0g投入盛有50mL0.1mol/L盐酸的烧杯中,该铝片与盐酸反应,产生氢气的速率v(H2)与反应时间t的关系可用如图所示的坐标曲线来表示,下列推论不正确的是
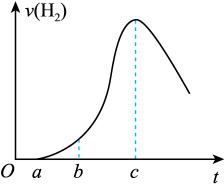

| A.O→a不产生氢气是因为表面的氧化物隔离了铝和稀盐酸 |
| B.b→c段产生氢气的速率增加较快的主要原因之一是温度升高 |
| C.t=c时,反应处于平衡状态 |
| D.t>c时,产生氢气的速率降低的主要原因是溶液中H+浓度下降 |
您最近一年使用:0次
2023-04-22更新
|
391次组卷
|
7卷引用:宁夏银川市育才中学2022-2023学年高一下学期5月期中考试化学试题
名校
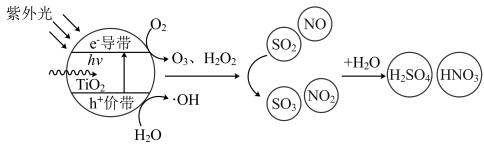
10 . 近年来光催化处理船舶尾气技术被称为是一种“绿色友好”技术,以 半导体为基底的纳米催化剂,表面经光激发后产生空穴和光生电子,光生空穴被表面吸附水或氢氧根离子捕获生成
半导体为基底的纳米催化剂,表面经光激发后产生空穴和光生电子,光生空穴被表面吸附水或氢氧根离子捕获生成 自由基,光生电子则与
自由基,光生电子则与 等反应在催化剂表面生成
等反应在催化剂表面生成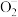 、
、 等氧化物,这些氧化物作用于尾气中的
等氧化物,这些氧化物作用于尾气中的 、
、 等污染物并将其氧化降解,原理见图。下列说法错误的是
等污染物并将其氧化降解,原理见图。下列说法错误的是
 半导体为基底的纳米催化剂,表面经光激发后产生空穴和光生电子,光生空穴被表面吸附水或氢氧根离子捕获生成
半导体为基底的纳米催化剂,表面经光激发后产生空穴和光生电子,光生空穴被表面吸附水或氢氧根离子捕获生成 自由基,光生电子则与
自由基,光生电子则与 等反应在催化剂表面生成
等反应在催化剂表面生成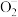 、
、 等氧化物,这些氧化物作用于尾气中的
等氧化物,这些氧化物作用于尾气中的 、
、 等污染物并将其氧化降解,原理见图。下列说法错误的是
等污染物并将其氧化降解,原理见图。下列说法错误的是
A.含有氮氧化物、硫氧化物的尾气排放到大气中易形成酸雨, 小于7的雨水为酸雨 小于7的雨水为酸雨 |
B.除 、NO的总反应分别为 、NO的总反应分别为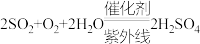 、 、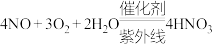 |
| C.催化剂可以改变氮氧化物、硫氧化物被氧化的速率 |
| D.尾气中含有大量有害物质,但经过科学的处理可以转化为多种有实用价值的物质 |
您最近一年使用:0次
2023-03-25更新
|
413次组卷
|
4卷引用:宁夏回族自治区银川一中2022-2023学年高一下学期期中考试化学试题



