名校
解题方法
1 .  和
和 在钯的配合物离子
在钯的配合物离子 的作用下合成
的作用下合成 ,反应历程如图,下列说法不正确的是
,反应历程如图,下列说法不正确的是
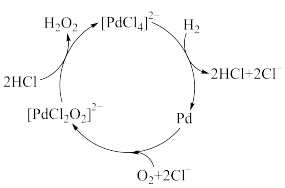
 和
和 在钯的配合物离子
在钯的配合物离子 的作用下合成
的作用下合成 ,反应历程如图,下列说法不正确的是
,反应历程如图,下列说法不正确的是
A.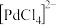 在此过程中作为催化剂 在此过程中作为催化剂 |
B.该过程的总反应为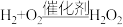 |
C.生成 的过程中转移电子总数为4mol 的过程中转移电子总数为4mol |
D.历程中发生了 |
您最近一年使用:0次
2022-03-11更新
|
322次组卷
|
8卷引用:宁夏银川市贺兰县景博中学2022-2023学年高三上学期第二次月考化学试题
2 . 在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO )以达到消除污染的目的。其工作原理的示意图如图所示。下列说法正确的是
)以达到消除污染的目的。其工作原理的示意图如图所示。下列说法正确的是
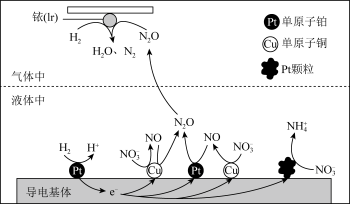
 )以达到消除污染的目的。其工作原理的示意图如图所示。下列说法正确的是
)以达到消除污染的目的。其工作原理的示意图如图所示。下列说法正确的是
| A.Ir的表面发生反应:H2+N2O=N2+H2O |
| B.导电基体上的负极反应:H2+2e-=2H+ |
| C.若导电基体上只有单原子铜,也能消除含氮污染物 |
| D.若导电基体上的Pt颗粒增多,有利于降低溶液中的含氮量 |
您最近一年使用:0次
2022-03-03更新
|
295次组卷
|
2卷引用:宁夏中卫市2022届高三下学期二模理综化学试题
名校
3 . 2021年我国科学家以CO2为原料人工合成淀粉,其效率约为传统农业生产淀粉的8.5倍,其部分合成路线如下图所示,下列有关说法正确的是
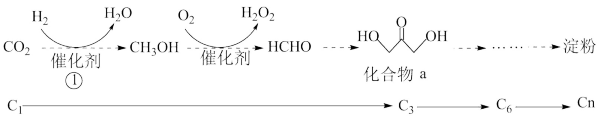
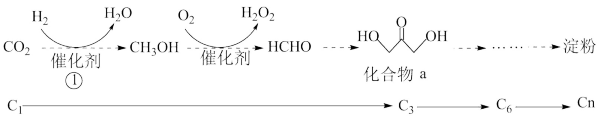
A.反应①为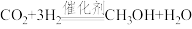 |
| B.HCHO的水溶液能使蛋白质发生盐析 |
| C.化合物a能与NaOH发生反应 |
| D.用淀粉可检验食盐是否为加碘盐 |
您最近一年使用:0次
2022-01-03更新
|
356次组卷
|
5卷引用:宁夏回族自治区银川市宁夏六盘山高级中学2022届高三下学期第三次模拟理综化学试题
名校
解题方法
4 . 下列实验操作、现象和所得到的结论都正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 用坩埚钳夹住一小块用砂纸打磨过的铝箔,在酒精灯上加热,铝箔熔化并滴落 | 金属铝的熔点较低 |
| B | 相同条件下,在两支试管中各取4mL0.1mol∙L−1KMnO4,分别加入2mL0.1mol∙L−1H2C2O4和2mL0.01mol∙L−1H2C2O4,加入2mL0.1mol∙L−1H2C2O4溶液褪色较快 | 浓度越大,化学反应速率越快 |
| C | 向某溶液中滴加K3[Fe(CN)6]溶液,产生蓝色沉淀 | 原溶液中有Fe2+,无Fe3+ |
| D | 将浓硫酸滴入蔗糖中并搅拌,得到黑色蓬松的“黑面包”并产生有刺激性气味的气体 | 该过程体现了浓硫酸的脱水性和强氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-01-01更新
|
275次组卷
|
2卷引用:宁夏银川一中2021-2022学年高三上学期第五次月考理综化学试题
名校
5 . T℃时,A气体与C气体反应生成B气体,反应过程中A、B、C浓度变化如图(I)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(II)所示。由以上条件,回答下列问题:
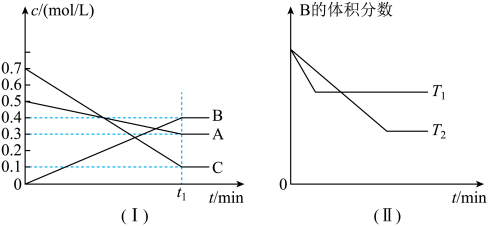
(1)该反应的化学方程式为_______
(2)T1_______ T2(大于,小于,等于),该反应为_______ (填“吸热”或“放热”)反应
(3)该反应的平衡常数的数值为(保留一位小数)_______ ;
(4)t1min后,改变下列某一条件,能使平衡向逆反应方向移动的有_______(填字母)
(5)已知甲醇制备的有关化学反应如下:
反应①:CO(g)+2H2(g)=CH3OH(g) ΔH1=﹣92kJ/mol
反应②:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2
反应③:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH3=﹣49kJ/mol
求反应②的ΔH2=_______ kJ/mol

(1)该反应的化学方程式为
(2)T1
(3)该反应的平衡常数的数值为(保留一位小数)
(4)t1min后,改变下列某一条件,能使平衡向逆反应方向移动的有_______(填字母)
| A.保持其他条件不变,增大压强 | B.保持容器总体积不变,通入少量稀有气体 |
| C.保持其他条件不变,升高温度 | D.保持其他条件不变,降低温度 |
反应①:CO(g)+2H2(g)=CH3OH(g) ΔH1=﹣92kJ/mol
反应②:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2
反应③:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH3=﹣49kJ/mol
求反应②的ΔH2=
您最近一年使用:0次
名校
解题方法
6 . 据文献报道,某反应的反应历程如图所示,下列有关该历程的说法错误的是
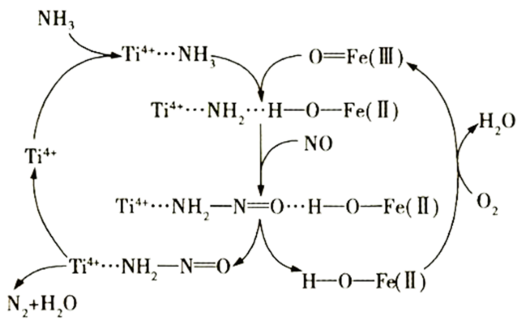

| A.Ti4+…NH2—N=O是中间产物 |
B.总反应化学方程式为4NH3+3O2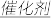 2N2+6H2O 2N2+6H2O |
| C.Ti4+是催化剂 |
| D.Ti4+…NH2—N=O→Ti4++N2+H2O属于分解反应 |
您最近一年使用:0次
2021-06-09更新
|
1012次组卷
|
16卷引用:宁夏回族自治区贺兰景博中学2022届高三二模理综化学试题
宁夏回族自治区贺兰景博中学2022届高三二模理综化学试题湖南省2021年普通高中学业水平选择考适应性测试化学试题山东省聊城市第一中学2021届高三下学期开学模拟考试化学试题(已下线)热点7 新信息反应机理分析-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)热点8 新信息反应机理分析-2021年高考化学【热点·重点·难点】专练(新高考)山东省济南市莱芜第一中学2021-2022学年高三上学期期中考试化学试题(已下线)专题10 化学反应与能量-2022年高考化学二轮复习重点专题常考点突破练(已下线)题型22 反应历程—活化能—催化剂的定性和定量分析江苏省南通市如皋市2024届高三上学期期初考试押题卷化学试题湖北省部分省重点中学2020-2021学年高二3月联考化学试题江苏省徐州市郑集高级中学2020-2021学年高一下学期3月考化学试题河北省衡水市安平中学2020-2021学年高一下学期第一次月考化学试题广东省广州市广州大学附属中学2020-2021学年高一下学期4月月考试题安徽省涡阳第一中学2020-2021学年高一下学期6月第二次质量检测化学试题重庆市第七中学校2020-2021学年高一下学期5月月考化学试题黑龙江省齐齐哈尔市第八中学2022-2023学年高二上学期10月月考化学试题
解题方法
7 . 据文献报道:Pd-Mg/SiO2催化某反应的一种反应机理如图所示。下列说法错误的是


| A.该反应可消耗CO2产生清洁燃料CH4 |
| B.H2在Pd催化剂的表面断裂H-H键 |
| C.该催化循环CO2变成了含镁的化合物 |
| D.使用催化剂可以大大降低该反应的活化能使反应快速进行 |
您最近一年使用:0次
解题方法
8 . 用软锰矿(主要成分为MnO2,所含杂质为质量分数约8%Fe3O4和约5%Al2O3)和BaS制备高纯MnCO3,同时制得Ba(OH)2,工艺流程如下:
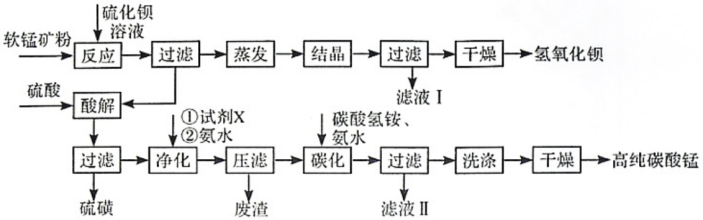
已知:25℃时相关物质的Ksp见下表
回答下列问题:
(1)MnO2与BaS溶液反应转化为MnO的化学方程式为___________ ,能否通过加热的方式加快该反应的速率,___________ (填“能”或“否”)
(2)已知MnO2为两性氧化物,保持BaS投料量不变,随软锰矿粉与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是___________ 。
(3)在实验室进行过滤操作时,除了使用铁架台和烧杯以外,还需要的玻璃仪器为___________ 。
(4)净化时需先加入的试剂X为___________ (填化学式) 。再使用氨水调溶液的pH,则pH的理论最小值为___________ (当溶液中某离子浓度小于1.0×10-5mol•L-1时,可认为该离子沉淀完全)。
(5)碳化过程中发生反应的离子方程式为___________ 。

已知:25℃时相关物质的Ksp见下表
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
| Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-32.3 | 1×10-12.7 |
(1)MnO2与BaS溶液反应转化为MnO的化学方程式为
(2)已知MnO2为两性氧化物,保持BaS投料量不变,随软锰矿粉与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是
(3)在实验室进行过滤操作时,除了使用铁架台和烧杯以外,还需要的玻璃仪器为
(4)净化时需先加入的试剂X为
(5)碳化过程中发生反应的离子方程式为
您最近一年使用:0次
2021-03-14更新
|
445次组卷
|
3卷引用:宁夏石嘴山市2021届高三下学期3月高考质量监测(一模) 化学试题
名校
解题方法
9 . 阳离子交换膜法电解饱和食盐水具有综合能耗低、环境污染小等优点。生产流程如图所示:

(1)电解饱和食盐水的化学方程式为____________ 。
(2)电解结束后,能够脱去阳极液中游离氯的试剂或方法是________ (填字母序号)。
a.Na2SO4b.NaNO3
c.热空气吹出d.降低阳极区液面上方的气压
(3)食盐水中的I-若进入电解槽,可被电解产生的Cl2氧化为ICl,并进一步转化为 。
。 可继续被氧化为高碘酸根(
可继续被氧化为高碘酸根(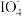 ),与Na+结合生成溶解度较小的NaIO4沉积于阳离子交换膜上,影响膜的寿命。
),与Na+结合生成溶解度较小的NaIO4沉积于阳离子交换膜上,影响膜的寿命。
①ICl为有毒的黑色晶体,可用氢氧化钠溶液吸收,请写出相应的离子反应方程式:_______________________ 。
②请写出NaIO3被氧化为NaIO4的离子反应方程式为________________________ 。
(4)在酸性条件下加入NaClO溶液,可将食盐水中的I-转化为I2,再进一步除去。通过测定体系的吸光度,可以检测不同pH下I2的生成量随时间的变化,如下图所示。已知:吸光度越高表明该体系中c(I2)越大。

①结合化学用语解释10min时不同pH体系吸光度不同的原因:__________________ 。
②pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因____________________ 。
③研究表明食盐水中I-含量≤0.2mg•L-1时对离子交换膜影响可忽略。现将1m3含I-浓度为1.47mg•L-1的食盐水进行处理,为达到使用标准,理论上至少 需要0.05mol•L-1NaClO溶液_____________ L。(已知NaClO的反应产物为NaCl,溶液体积变化忽略不计)

(1)电解饱和食盐水的化学方程式为
(2)电解结束后,能够脱去阳极液中游离氯的试剂或方法是
a.Na2SO4b.NaNO3
c.热空气吹出d.降低阳极区液面上方的气压
(3)食盐水中的I-若进入电解槽,可被电解产生的Cl2氧化为ICl,并进一步转化为
 。
。 可继续被氧化为高碘酸根(
可继续被氧化为高碘酸根(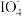 ),与Na+结合生成溶解度较小的NaIO4沉积于阳离子交换膜上,影响膜的寿命。
),与Na+结合生成溶解度较小的NaIO4沉积于阳离子交换膜上,影响膜的寿命。①ICl为有毒的黑色晶体,可用氢氧化钠溶液吸收,请写出相应的离子反应方程式:
②请写出NaIO3被氧化为NaIO4的离子反应方程式为
(4)在酸性条件下加入NaClO溶液,可将食盐水中的I-转化为I2,再进一步除去。通过测定体系的吸光度,可以检测不同pH下I2的生成量随时间的变化,如下图所示。已知:吸光度越高表明该体系中c(I2)越大。

①结合化学用语解释10min时不同pH体系吸光度不同的原因:
②pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因
③研究表明食盐水中I-含量≤0.2mg•L-1时对离子交换膜影响可忽略。现将1m3含I-浓度为1.47mg•L-1的食盐水进行处理,为达到使用标准,理论上
您最近一年使用:0次
10 . 随着新能源汽车销量的猛增,动力电池退役高峰将至,磷酸铁锂(LFP)是目前使用最多的动力电池材料,因此回收磷酸铁锂具有重要意义。一种从废旧磷酸铁锂正极片( LiFePO4、导电石墨、铝箔)中回收锂的工艺流程如图:
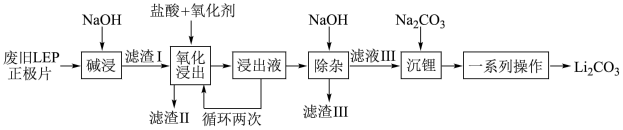
已知:Li2CO3在水中的溶解度随温度升高而降低,但煮沸时发生水解。回答下列问题:
(1)在“碱浸”时,为加快浸出速率,下列措施不可行的是_______ (填标号)。
a.适当提高浸出温度
b.使用电动搅拌器
c.适当提高氢氧化钠的浓度
d.增大废料的颗粒
(2)“氧化浸出”时,保持其他条件不变,不同氧化剂对锂的浸出实验结果如表,实际生产中氧化剂选用H2O2,不选用 NaClO3的原因是______ 。在“氧化浸出”时,温度不宜超过50℃,其目的是________ 。“氧化浸出”时生成了难溶的FePO4,该反应的离子方程式为_________ 。
(3)“浸出液”循环两次的目的是________ 。
(4)“沉锂”的温度保持在95℃,最适宜的加热方式为________ 。“一系列操作”具体包括______ 、洗涤、干燥。
(5)“滤渣Ⅱ”经纯化可得FePO4,流程中生成的Li2CO3、FePO4在高温条件下与H2C2O4煅烧可得 LiFePO4,实现再生利用,其化学方程式为_________ 。

已知:Li2CO3在水中的溶解度随温度升高而降低,但煮沸时发生水解。回答下列问题:
(1)在“碱浸”时,为加快浸出速率,下列措施不可行的是
a.适当提高浸出温度
b.使用电动搅拌器
c.适当提高氢氧化钠的浓度
d.增大废料的颗粒
(2)“氧化浸出”时,保持其他条件不变,不同氧化剂对锂的浸出实验结果如表,实际生产中氧化剂选用H2O2,不选用 NaClO3的原因是
| 序号 | 锂含量/% | 氧化剂 | pH | 浸出液体Li浓度/(g·L-1) | 浸出渣中Li含量/% |
| 1 | 3.7 | H2O2 | 3.5 | 9.02 | 0.10 |
| 2 | 3.7 | NaClO3 | 3.5 | 9.05 | 0.08 |
| 3 | 3.7 | O2 | 3.5 | 7.05 | 0.93 |
| 4 | 3.7 | NaClO | 3.5 | 8.24 | 0.43 |
(4)“沉锂”的温度保持在95℃,最适宜的加热方式为
(5)“滤渣Ⅱ”经纯化可得FePO4,流程中生成的Li2CO3、FePO4在高温条件下与H2C2O4煅烧可得 LiFePO4,实现再生利用,其化学方程式为
您最近一年使用:0次
2020-11-02更新
|
509次组卷
|
3卷引用:宁夏银川一中2021届高三第三次月考理综化学试题



