名校
1 . 重要的化工原料丁烯(C4H8)可由丁烷(C4H10)催化脱氢制备,反应如下:
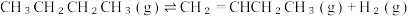 △H
△H
已知:i.该工艺过程的副产物有炭(C),生成的积炭会附着在催化剂表面,影响催化效果。
ii.温度过高会引发正丁烷裂解生成低碳烃类的副反应。
iii.CH2=CHCH2CH3(g)+6O2 (g)=4CO2 (g)+4H2O(l) △H1
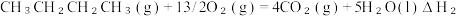
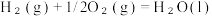 △H3
△H3
(1)用△H1、△H2、△H3表示丁烷催化脱氢反应的反应热△H=_______ 。
(2)寻找高效的催化剂是脱氢反应重要的研究课题之一、
①催化剂使用 段时间后活性会下降,通入适量氢气可使其改善,氢气的作用是_______ 。
②其他条件相同时,以SiO₂为载体与不同质量百分比的CrOx组合,催化效果相关数据如表。
下列说法正确的是_______ (填序号)。[收率=(生成某产物的原料量/投入的原料量)×100%]
a.脱氢反应中SiO2不起催化作用 b. CrOx的含量越高,反应的催化效果越好
c. CrOx的含量对丁烷脱氢反应的焓变有影响 d. 正丁烯收率越高,则原料的利用率越高
(3)其他条件相同,30min时测得正丁烷转化率、正丁烯收率随温度的变化如图1。
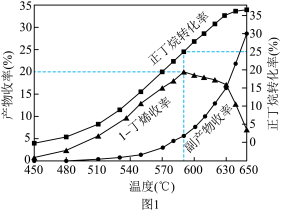
① 实际生产温度选择590℃, 由图1说明其理由是_______ 。
②590℃时,向体积为 1L 的密闭容器中充入3mol正丁烷气体,据图1计算0~30min内生成正丁烯的平均反应速率为_______ mol/(L·min)。
(4)利用电解装置可以将尾气中的 NO 转化为尿素[CO(NH2) 2,其中碳的化合价为+4 价,属于非电解质],工作原理如图2所示。
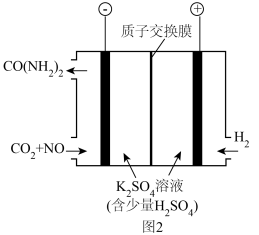
①阴极的电极反应式为_______ 。
②反应 段时间后,阳极区的pH基本不变,结合化学用语解释原因为_______ 。
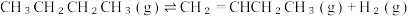 △H
△H已知:i.该工艺过程的副产物有炭(C),生成的积炭会附着在催化剂表面,影响催化效果。
ii.温度过高会引发正丁烷裂解生成低碳烃类的副反应。
iii.CH2=CHCH2CH3(g)+6O2 (g)=4CO2 (g)+4H2O(l) △H1
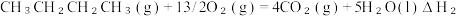
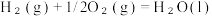 △H3
△H3(1)用△H1、△H2、△H3表示丁烷催化脱氢反应的反应热△H=
(2)寻找高效的催化剂是脱氢反应重要的研究课题之一、
①催化剂使用 段时间后活性会下降,通入适量氢气可使其改善,氢气的作用是
②其他条件相同时,以SiO₂为载体与不同质量百分比的CrOx组合,催化效果相关数据如表。
| 实验组 | 催化剂组成 | 正丁烷转化率 /% | 正丁烯收率 /% |
| 1 | 无催化剂 | 5 | 0.35 |
| 2 | SiO2 | 5 | 0.35 |
| 3 | SiO2+9%CrOx | 25.5 | 18.3 |
| 4 | SiO2+15% CrOx | 27.5 | 20.65 |
| 5 | SiO2+21%CrOx | 24 | 17.87 |
a.脱氢反应中SiO2不起催化作用 b. CrOx的含量越高,反应的催化效果越好
c. CrOx的含量对丁烷脱氢反应的焓变有影响 d. 正丁烯收率越高,则原料的利用率越高
(3)其他条件相同,30min时测得正丁烷转化率、正丁烯收率随温度的变化如图1。

① 实际生产温度选择590℃, 由图1说明其理由是
②590℃时,向体积为 1L 的密闭容器中充入3mol正丁烷气体,据图1计算0~30min内生成正丁烯的平均反应速率为
(4)利用电解装置可以将尾气中的 NO 转化为尿素[CO(NH2) 2,其中碳的化合价为+4 价,属于非电解质],工作原理如图2所示。

①阴极的电极反应式为
②反应 段时间后,阳极区的pH基本不变,结合化学用语解释原因为
您最近一年使用:0次
名校
解题方法
2 . 废弃电池是一种有害垃圾,合理处理则能变废为宝。下图是废弃锌锰电池的处理流程图:
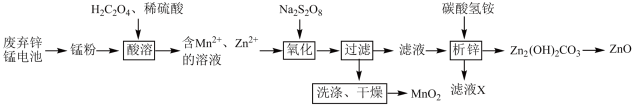
已知:锰粉的主要成分是Mn元素的+2、+3、+4价氧化物和ZnO。
回答下列问题:
(1)“废弃锌锰电池→锰粉”的操作是拆分、煅烧,煅烧类似于实验室中的焙烧,实验室焙烧使用的仪器名称是___________ 。
(2)“酸溶”采用锰粉比锰块的浸取速率快,为提高“酸溶”的浸取速率,还可以采取的措施有___________ (任写两条),
(3)“酸溶” 过程中H2C2O4与Mn元素+4价氧化物反应的离子方程式___________ ,“氧化”操作的氧化产物是___________ (填化学式)。
(4)“洗涤、干燥”时,检验MnO2洗涤干净的实验方法及现象是___________ 。
(5)滤液X可以用于制取化肥,其中除Na+外,主要含___________ 、 (填离子符号)。
(填离子符号)。
(6)由Zn2(OH)2CO3制备ZnO的条件是加热,写出该反应的化学方程式:___________ 。

已知:锰粉的主要成分是Mn元素的+2、+3、+4价氧化物和ZnO。
回答下列问题:
(1)“废弃锌锰电池→锰粉”的操作是拆分、煅烧,煅烧类似于实验室中的焙烧,实验室焙烧使用的仪器名称是
(2)“酸溶”采用锰粉比锰块的浸取速率快,为提高“酸溶”的浸取速率,还可以采取的措施有
(3)“酸溶” 过程中H2C2O4与Mn元素+4价氧化物反应的离子方程式
(4)“洗涤、干燥”时,检验MnO2洗涤干净的实验方法及现象是
(5)滤液X可以用于制取化肥,其中除Na+外,主要含
 (填离子符号)。
(填离子符号)。(6)由Zn2(OH)2CO3制备ZnO的条件是加热,写出该反应的化学方程式:
您最近一年使用:0次
名校
解题方法
3 . 反应Fe+H2SO4=FeSO4+H2↑的能量变化如图所示:
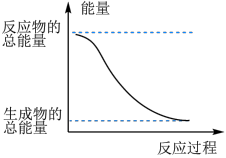
(1)该反应为___________ 反应(填“吸热”或“放热”)。
(2)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为___________ (填“正”或“负”)极;其电极反应式为:___________ ,外电路中电流由___________ 流出。(填电极材料名称)。
(3)若要使该反应的反应速率加快,下列措施可行的是 。

(1)该反应为
(2)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为
(3)若要使该反应的反应速率加快,下列措施可行的是 。
| A.增加铁的量 | B.改稀硫酸为98%的硫酸 |
| C.增大压强 | D.滴加几滴CuSO4溶液 |
您最近一年使用:0次
名校
解题方法
4 . 如图是硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁的生产流程示意图:

请回答下列问题:
(1)酸浸时,将硫铁矿烧渣粉碎的原因是___________ 。
(2)酸浸、过滤后滤液A中的金属阳离子是___________ 。
(3)煅烧FeCO3生成产品I的化学方程式为___________ 。
(4)产品Ⅱ的化学式为___________ 。
(5)写出步骤Ⅳ反应的离子方程式___________ 。

请回答下列问题:
(1)酸浸时,将硫铁矿烧渣粉碎的原因是
(2)酸浸、过滤后滤液A中的金属阳离子是
(3)煅烧FeCO3生成产品I的化学方程式为
(4)产品Ⅱ的化学式为
(5)写出步骤Ⅳ反应的离子方程式
您最近一年使用:0次
名校
解题方法
5 . 甲酸常被用于橡胶、医药等工业,一定条件下可分解生成CO和H2O。在无催化剂和有催化剂的条件下,能量与反应历程的关系分别如图1、图2所示。下列说法错误的是
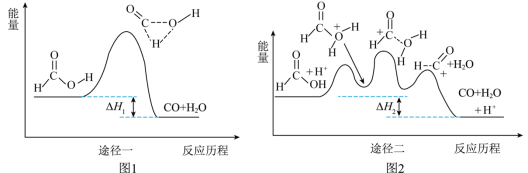

| A.途径一和途径二中均涉及了极性键的断裂和生成 |
| B.ΔH1<ΔH2<0 |
| C.途径二使用了H+作为催化剂 |
D.途径二反应的快慢由生成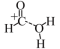 的速率决定 的速率决定 |
您最近一年使用:0次
2024-01-03更新
|
200次组卷
|
5卷引用:宁夏银川市育才中学2023-2024学年高三上学期1月期末理科综合化学试题
宁夏银川市育才中学2023-2024学年高三上学期1月期末理科综合化学试题宁夏银川市西夏区育才中学2023-2024学年高三上学期1月期末化学试题重庆市渝北中学校2023-2024学年高三上学期11月月考质量监测化学试题(已下线)选择题11-14(已下线)专题06 化学反应速率与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
名校
6 . 化学在生活中有着广泛的应用,下列措施与控制化学反应速率无关的是
| A.用加酶洗衣粉洗涤衣物 | B.夏季将食物放在冰箱内保鲜 |
| C.合成氨时,将吸收塔尾气循环使用 | D.制硫酸时,进入沸腾炉前将硫铁矿石粉碎 |
您最近一年使用:0次
2023-12-31更新
|
58次组卷
|
2卷引用:宁夏开元学校2023-2024学年高二上学期期末考试化学试题
名校
解题方法
7 . 科学家一直致力于“人工固氮”的方法研究。目前合成氨的技术原理为:
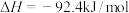 。该反应的能量变化如图所示。
。该反应的能量变化如图所示。
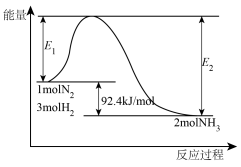
(1)在实际工业生产中,通常采用铁触媒、在___________ ℃温度和___________ MPa的条件下合成氨。
(2)将一定量的 和
和 放入2L的密闭容器中,在500℃、
放入2L的密闭容器中,在500℃、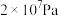 下发生反应,5分钟后达到平衡,测得
下发生反应,5分钟后达到平衡,测得 为0.2mol,
为0.2mol, 为0.6mol,
为0.6mol, 为0.2mol,则
为0.2mol,则 的转化率为
的转化率为___________ (保留小数点后一位)。
(3)欲提高(2)容器中 的转化率,下列措施可行的是___________。
的转化率,下列措施可行的是___________。
(4)若在0.5L的密闭容器中,一定量的氮气和氢气进行反应,其化学平衡常数K与温度T的关系如表所示,请完成下列问题:
①试比较 、
、 的大小,
的大小,
___________  (填“>”、“<”或“=”);
(填“>”、“<”或“=”);
②400℃时,测得 、
、 和
和 物质的量分别为3mol、2mol和2mol时,则该反应的
物质的量分别为3mol、2mol和2mol时,则该反应的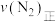
___________ 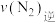 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。

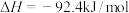 。该反应的能量变化如图所示。
。该反应的能量变化如图所示。
(1)在实际工业生产中,通常采用铁触媒、在
(2)将一定量的
 和
和 放入2L的密闭容器中,在500℃、
放入2L的密闭容器中,在500℃、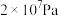 下发生反应,5分钟后达到平衡,测得
下发生反应,5分钟后达到平衡,测得 为0.2mol,
为0.2mol, 为0.6mol,
为0.6mol, 为0.2mol,则
为0.2mol,则 的转化率为
的转化率为(3)欲提高(2)容器中
 的转化率,下列措施可行的是___________。
的转化率,下列措施可行的是___________。| A.向容器中再充入氢气 | B.向容器中再充入惰性气体 |
| C.改变反应的催化剂 | D.液化生成物分离出氨 |
(4)若在0.5L的密闭容器中,一定量的氮气和氢气进行反应,其化学平衡常数K与温度T的关系如表所示,请完成下列问题:
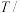 ℃ ℃ | 200 | 300 | 400 |
 |  |  | 0.5 |
 、
、 的大小,
的大小,
 (填“>”、“<”或“=”);
(填“>”、“<”或“=”);②400℃时,测得
 、
、 和
和 物质的量分别为3mol、2mol和2mol时,则该反应的
物质的量分别为3mol、2mol和2mol时,则该反应的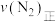
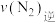 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
名校
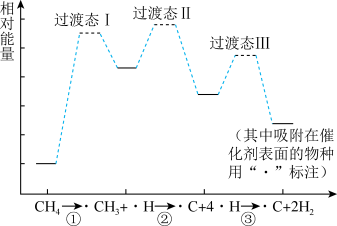
8 . 甲烷分子结构具有高对称性且断开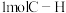 键需要吸收440kJ能量。无催化剂作用下甲烷在温度达到1200℃以上才可裂解。在催化剂及一定条件下,
键需要吸收440kJ能量。无催化剂作用下甲烷在温度达到1200℃以上才可裂解。在催化剂及一定条件下, 可在较低温度下发生裂解反应,甲烷在镍基催化剂上转化过程中的能量变化如图所示。下列说法错误的是
可在较低温度下发生裂解反应,甲烷在镍基催化剂上转化过程中的能量变化如图所示。下列说法错误的是
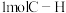 键需要吸收440kJ能量。无催化剂作用下甲烷在温度达到1200℃以上才可裂解。在催化剂及一定条件下,
键需要吸收440kJ能量。无催化剂作用下甲烷在温度达到1200℃以上才可裂解。在催化剂及一定条件下, 可在较低温度下发生裂解反应,甲烷在镍基催化剂上转化过程中的能量变化如图所示。下列说法错误的是
可在较低温度下发生裂解反应,甲烷在镍基催化剂上转化过程中的能量变化如图所示。下列说法错误的是
| A.步骤②反应为放热反应 |
| B.使用该催化剂,反应的焓变不变 |
C.甲烷催化裂解成C和 需要吸收1760kJ能量 需要吸收1760kJ能量 |
| D.催化剂使用一段时间后失活的原因可能是碳在催化剂表面沉积 |
您最近一年使用:0次
名校
9 . 关于反应
 ,下列说法正确的是
,下列说法正确的是

 ,下列说法正确的是
,下列说法正确的是| A.该反应在高温条件下可以自发进行 |
| B.向反应容器中加入催化剂,反应自发进行的温度会改变 |
| C.恒容条件下,通入He气,压强会增大,反应的速率会加快 |
D.恒容条件下,可通入过量的 气体来提高 气体来提高 转化率 转化率 |
您最近一年使用:0次
2023-12-16更新
|
111次组卷
|
2卷引用:宁夏六盘山高级中学2023-2024学年高二上学期第二次月考化学试题
名校
解题方法
10 . 依据下列实验现象可以推出结论的是
| 选项 | 实验 | 现象 | 结论 |
| A |  | ①中产生大量气体 ②中无明显现象 |  是 是 分解的催化剂 分解的催化剂 |
| B |  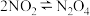 | 压缩体积,气体颜色加深 | 气体颜色加深是平衡正向移动的结果 |
| C | 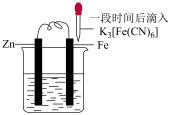 | 铁表面产生蓝色沉淀 | Zn不能对Fe起到保护作用 |
| D | 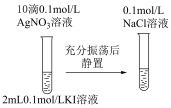 | 先产生黄色沉淀 滴加2mL NaCl后,上层清液无明显变化 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-11更新
|
230次组卷
|
3卷引用:宁夏银川一中2023-2024学年高二上学期期末考试化学试题



