名校
1 . 某温度下,CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K=1,该温度下在体积均为1L的甲、乙两个恒容密闭容器中,投入CO(g)和H2O(g)的起始浓度及5min时的浓度如表所示。
CO2(g)+H2(g)的平衡常数K=1,该温度下在体积均为1L的甲、乙两个恒容密闭容器中,投入CO(g)和H2O(g)的起始浓度及5min时的浓度如表所示。
下列判断不正确的是
 CO2(g)+H2(g)的平衡常数K=1,该温度下在体积均为1L的甲、乙两个恒容密闭容器中,投入CO(g)和H2O(g)的起始浓度及5min时的浓度如表所示。
CO2(g)+H2(g)的平衡常数K=1,该温度下在体积均为1L的甲、乙两个恒容密闭容器中,投入CO(g)和H2O(g)的起始浓度及5min时的浓度如表所示。| 甲 | 乙 | |||
| 起始浓度 | 5min时浓度 | 起始浓度 | 5min时浓度 | |
| c(CO)/mol/L | 0.1 | 0.08 | 0.2 | x |
| c(H2O)/mol/L | 0.1 | 0.08 | 0.2 | y |
| A.甲中0-5min平均反应速率v(CO)=0.004mol•L-1•min-1 |
| B.反应开始时,乙中反应速率快 |
| C.x=y=0.16 |
| D.平衡时,乙中的转化率是50% |
您最近一年使用:0次
2021-12-04更新
|
124次组卷
|
3卷引用:宁夏银川一中2021-2022学年高二上学期期中考试化学试题
名校
解题方法
2 . 某同学探究外界条件对H2O2分解速率的影响实验所用试剂:0.4mol·L-1H2O2溶液、蒸馏水、MnO2粉末、Fe2O3粉。
(1)实验1、2的目的是其他条件相同时,研究___________ 对H2O2分解速率的影响。
(2)表中a处所用试剂为___________ 。对比实验3、4可得出的结论是___________ 。
(3)实验3、5是其他条件相同时,探究浓度对该化学反应速率的影响。b处取用10mL0.4mol·L-1H2O2溶液,还应添加的试剂及用量为___________ 。
(4)控制其他条件相同,印刷电路板的金属粉末用0.4mol·L-1H2O2溶液和3.0mol·L-1 H2SO4溶液处理。
①请配平方程式:___________
___________Cu+___________H2O2+___________H+=___________Cu2++___________H2O
②某同学在不同温度下完成该实验,测得铜的平均溶解速率分别为:
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是:___________ 。
实验序号 | H2O2浓度(mol·L-1) | v(H2O2溶液)(mL) | 温度 | 催化剂 | 收集112mLO2所需时间(s) |
1 | 0.4 | 20 | 室温 | 无 | 几乎无气体产生 |
2 | 0.4 | 20 | 50℃水浴 | 无 | 296 |
3 | 0.4 | 20 | 室温 | 0.5g a | 45 |
4 | 0.4 | 20 | 室温 | 0.5gMnO2粉末 | 100 |
5 | 0.4 | b | 室温 | a | >45 |
(2)表中a处所用试剂为
(3)实验3、5是其他条件相同时,探究浓度对该化学反应速率的影响。b处取用10mL0.4mol·L-1H2O2溶液,还应添加的试剂及用量为
(4)控制其他条件相同,印刷电路板的金属粉末用0.4mol·L-1H2O2溶液和3.0mol·L-1 H2SO4溶液处理。
①请配平方程式:
___________Cu+___________H2O2+___________H+=___________Cu2++___________H2O
②某同学在不同温度下完成该实验,测得铜的平均溶解速率分别为:
温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜的平均溶解速率( | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
您最近一年使用:0次
2021-12-02更新
|
184次组卷
|
7卷引用:宁夏六盘山高级中学2021-2022学年高二上学期期中考试化学试题
宁夏六盘山高级中学2021-2022学年高二上学期期中考试化学试题北京市丰台区2020-2021学年高一下学期期中联考化学(A卷)试题(已下线)作业03 化学反应速率-2021年高二化学暑假作业(人教版2019)(已下线)2.2 影响化学反应速率的因素-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)第2章 化学反应速率和化学平衡(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)(已下线)2.1.2 影响化学反应速率的因素(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)安徽省黄山市屯溪第一中学2022-2023学年高二上学期期中质量检测(选择性考试) 化学试题
名校
3 . CO2加氢制CH4的一种催化机理如图所示,下列说法正确的是
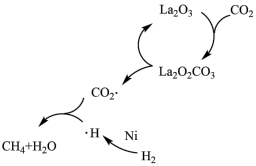

| A.反应中 La2O3是中间产物 |
| B.反应中 La2O2CO3可以释放出带负电荷的 CO2· |
| C.H2经过 Ni 活性中心裂解产生活化态 H·的过程中ΔS>0 |
| D.使用 TiO2作催化剂可以降低反应的焓变,从而提高化学反应速率 |
您最近一年使用:0次
2021-12-02更新
|
301次组卷
|
3卷引用: 宁夏回族自治区银川一中2023-2024学年高二上学期期中考试化学试题
名校
解题方法
4 . 少量铁粉与100 mL 0.1 mol/L的稀盐酸反应,若想减慢此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②降温 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦加KNO3溶液
①加H2O ②降温 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦加KNO3溶液
| A.①④⑤⑦ | B.②③⑥ | C.①②⑤⑦ | D.①②④⑤ |
您最近一年使用:0次
2021-11-12更新
|
482次组卷
|
6卷引用:宁夏回族自治区石嘴山市第三中学2023-2024学年高二9月月考化学试题
宁夏回族自治区石嘴山市第三中学2023-2024学年高二9月月考化学试题天津市五校联考2021-2022学年高二上学期期中考试化学试题新疆喀什第二中学2021-2022学年高三下学期开学考试化学试题(已下线)押新高考卷09题 速率和平衡-备战2022年高考化学临考题号押题(新高考通版)天津市武清区四校2022-2023学年高二上学期第一次阶段性练习化学试题安徽省安庆市第七中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
5 . 研究表明 与
与 在
在 作用下发生反应,下列说法
作用下发生反应,下列说法不正确 的是
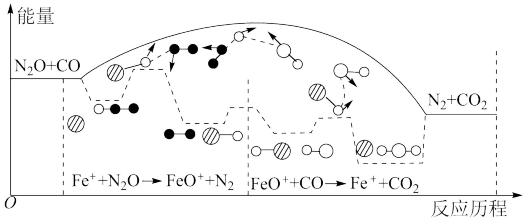
 与
与 在
在 作用下发生反应,下列说法
作用下发生反应,下列说法
A.反应总过程 |
B. 使反应的活化能减小 使反应的活化能减小 |
C.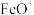 是该反应的催化剂 是该反应的催化剂 |
D. 、 、 两步反应均为放热反应 两步反应均为放热反应 |
您最近一年使用:0次
2021-11-06更新
|
938次组卷
|
21卷引用:宁夏银川市第二中学2021-2022学年高二下学期期末考试化学试题
宁夏银川市第二中学2021-2022学年高二下学期期末考试化学试题【全国百强校】广东省佛山市第一中学2018-2019学年高二上学期第一次段考化学试题【全国百强校】山西省太原市第五中学2018-2019学年高二(理)上学期10月月考化学试题【市级联考】广东省清远市2018-2019学年高二第一学期期末质量检测化学试题【全国百强校】河南省郑州市第一中学2018-2019学年高一下学期期中考试化学试题黑龙江省大庆实验中学2019-2020学年高二上学期第一次月考化学试题江苏省常州市田家炳高级中学 2019-2020学年高二上学期12月份阶段调研考试化学试题北京市海淀人大附中西山学校2020-2021学年高二上学期期中考试化学试题湖南省常德市淮阳中学2019-2020学年高二下学期期中考试化学试题山东省济南市2020-2021学年高二1月学情诊断化学试题重庆市第七中学校2021-2022学年高二上学期第一次月考化学试题北京市第十四中学2021-2022学年高二上学期期中考试化学试题黑龙江省绥化市第一中学2021-2022学年高二上学期期中考试化学试卷山东师范大学附属中学2021-2022学年高二上学期期中考试化学试题河南省范县第一中学2021-2022学年高二上学期期中检测化学试题(已下线)备战2022年高考化学精准检测卷【全国卷】17(已下线)第23讲化学反应与热能云南省昆明市西山区2022-2023学年高二上学期1月期末考试化学试题辽宁省重点高中沈阳市郊联体2022-2023学年高三上学期期中考试化学试题广东省广州市第八十九中学2023-2024学年高二上学期10月月考化学试题山东省聊城颐中外国语学校2023-2024学年高二上学期期中考试化学试题
名校
6 . 在恒温、恒容的容器中进行反应A⇌B+C,若A的浓度由0.1 mol/L降到0.08 mol/L需要5s,那么由0.08 mol/L降到0.04 mol/L所需时间为
| A.等于15 s | B.等于10 s | C.小于10 s | D.大于10 s |
您最近一年使用:0次
9-10高三·湖南衡阳·阶段练习
名校
7 . 某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
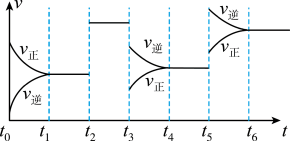
 2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是 
| A.t2时加入催化剂 | B.t3时降低了温度 |
| C.t5时增大了压强 | D.t4~t5时间内转化率一定最低 |
您最近一年使用:0次
2021-10-15更新
|
1838次组卷
|
57卷引用:宁夏海原第一中学2020-2021学年高二上学期第二次月考化学试题
宁夏海原第一中学2020-2021学年高二上学期第二次月考化学试题(已下线)湖南省衡阳市第八中学2010届高三年级第五次月考化学试题(已下线)09~10年大连23中高一下学期期末考试化学卷(已下线)2010年湖北省孝感高中高二上学期期中考试化学试卷(已下线)2011-2012学年陕西省西安市第一中学高二上学期期末考试化学(理)试卷(已下线)2011-2012学年陕西师大附中高二年级第一学期期中考试化学试卷(已下线)2012-2013学年湖南省益阳市一中高二上学期期末考试理科化学试卷(已下线)2012-2013学年辽宁省辽河油田第二高中高一下学期期末考试化学试卷(已下线)2014-2015学年福建三明市一中高二上第一次月考化学试卷(已下线)2014秋季湖南省浏阳一中高二上学期第一次阶段测试化学(B)试题(已下线)2014秋河北省成安一中、临漳一中、永年二中高二上学期期中联考化学试卷2015-2016学年陕西西安第一中学高二上期中考试化学试卷2015-2016学年山东省青岛市华侨中学高二上学期10月月考化学试卷2016-2017学年陕西省西安一中高二上期中化学试卷2016-2017学年湖北省宜昌市葛洲坝中学高二上期中化学卷辽宁省大连育明高级中学2018届高三人教版选修四同步周测三化学试题湖北省监利县实验高中2017-2018学年高二上学期期中考试化学试题新疆维吾尔自治区兵团第二师华山中学2018-2019学年高二上学期第一次调研考试化学试题吉林省长春市九台区师范高级中学2018-2019学年高二上学期期中考试化学试题内蒙古自治区北京八中乌兰察布分校2018-2019学年高二下学期第一次月考化学试题河南省新野县第一高级中学2019-2020学年高二上学期第二次月考化学试题甘肃省白银市会宁县第一中学2019-2020学年高二上学期期中考试化学(理)试题广东省揭西县河婆中学2019-2020学年高二上学期期中考试化学试题吉林省白山市抚松县第六中学2019-2020学年高二上学期期中考试化学试题广东省阳江市阳春市第一中学2019-2020学年高二上学期第三次月考化学试题湖南省株洲市茶陵县第三中学2019-2020学年高二上学期第三次月考化学(选考)试题(已下线)2019年12月28日 《每日一题》人教版(选修4)——周末培优湖北省利川市第五中学2019-2020学年高二12月月考化学试题陕西省咸阳市实验中学2019-2020学年高二上学期第二次月考化学试题江西省九江市浔阳区九江市第七中学2020-2021学年高二上学期期中考试化学试题安徽省六安市城南中学2020-2021学年高二上学期期中考试化学试题华中师范大学海南附属中学2019-2020学年高二上学期第三次月考化学试题吉林省长春市清蒲中学2020-2021学年度高二上学期期末化学试题云南省丽江市第一中学2020-2021学年高二下学期期中考试化学试题陕西省咸阳市泾干中学2021-2022学年高二上学期第二次月考化学试题新疆乌鲁木齐市第八中学2021-2022学年高二上学期第一次月考化学试题黑龙江省哈尔滨市三中2021-2022学年高二上学期第一学段考试化学(理科)试题新疆乌苏市第一中学2021-2022学年高二上学期期中考试化学试题吉林省长春市希望高中2021-2022学年高二上学期期中考试化学试题重庆市青木关中学校2021-2022学年高二上学期期中考试化学试题重庆市天星桥中学2021-2022学年高二上学期第一次月考化学试题陕西省西安市西航一中2021-2022学年高二上学期期中考试化学试题天津市西青区杨柳青第一中学2021-2022学年高二下学期期末适应性测试(实验班)化学试题陕西省西安市雁塔区第二中学2021-2022学年高二上学期第一次月考化学试题(已下线)2.2.3 化学反应速率和化学平衡图像——同步学习必备知识湖南省长沙市雅礼中学2022-2023学年高二上学期第一次月考化学试题重庆市江津中学2022-2023学年高二上学期10月阶段性考试化学试题河北省石家庄新乐市第一中学2022-2023学年高二上学期第一次月考化学试题海南省文昌中学2022-2023学年高二上学期第一次月考化学试题甘肃省武威市古浪县第二中学2021-2022学年高二上学期期中化学试题黑龙江省牡丹江市海林市朝鲜族中学2021-2022学年高二上学期第三次月考化学试题陕西省宝鸡市2022-2023学年高二上学期期末考试化学试题陕西省渭南市白水中学2022-2023学年高二上学期12月月考化学试题河北省唐山市丰润区2023-2024学年高二上学期期中考试化学试题陕西省渭南市蒲城县蒲城中学2023-2024学年高二上学期期中考试化学试题吉林省长春市第二中学2023-2024学年高二上学期11月期中考试化学试题四川省眉山市仁寿县校际2023-2024学年高二上学期10月联考化学试题
名校
解题方法
8 . 下列关于有效碰撞理论与影响速率因素之间关系正确的是
| A.增大反应物浓度,可以提高活化分子百分数,从而提高反应速率 |
| B.升高温度,可以提高活化分子的能量,会减慢反应速率 |
| C.加入催化剂可以降低活化能,活化分子百分比虽然没变,但可以加快反应速率 |
| D.通过压缩体积增大压强,可提高单位体积内活化分子数,从而提高反应速率 |
您最近一年使用:0次
2021-10-13更新
|
324次组卷
|
5卷引用:宁夏吴忠中学2022-2023学年高二上学期期中考试化学试题
名校
9 . T℃时,A气体与C气体反应生成B气体,反应过程中A、B、C浓度变化如图(I)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(II)所示。由以上条件,回答下列问题:
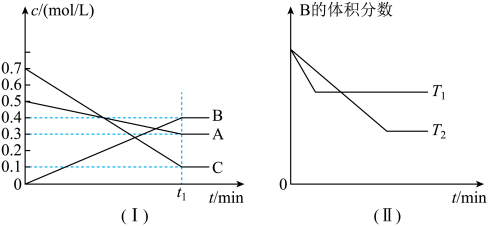
(1)该反应的化学方程式为_______
(2)T1_______ T2(大于,小于,等于),该反应为_______ (填“吸热”或“放热”)反应
(3)该反应的平衡常数的数值为(保留一位小数)_______ ;
(4)t1min后,改变下列某一条件,能使平衡向逆反应方向移动的有_______(填字母)
(5)已知甲醇制备的有关化学反应如下:
反应①:CO(g)+2H2(g)=CH3OH(g) ΔH1=﹣92kJ/mol
反应②:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2
反应③:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH3=﹣49kJ/mol
求反应②的ΔH2=_______ kJ/mol

(1)该反应的化学方程式为
(2)T1
(3)该反应的平衡常数的数值为(保留一位小数)
(4)t1min后,改变下列某一条件,能使平衡向逆反应方向移动的有_______(填字母)
| A.保持其他条件不变,增大压强 | B.保持容器总体积不变,通入少量稀有气体 |
| C.保持其他条件不变,升高温度 | D.保持其他条件不变,降低温度 |
反应①:CO(g)+2H2(g)=CH3OH(g) ΔH1=﹣92kJ/mol
反应②:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2
反应③:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH3=﹣49kJ/mol
求反应②的ΔH2=
您最近一年使用:0次
12-13高二·全国·课时练习
名校
解题方法
10 . 在恒温、恒容的容器中进行反应2HI⇌H2+I2(正反应为吸热反应),反应物的浓度由0.1mol·L-1降到0.06mol·L-1需要20s,那么由0.06mol·L-1降到0.036mol·L-1所需时间为
| A.等于10s | B.等于12s | C.大于12s | D.小于12s |
您最近一年使用:0次
2021-09-05更新
|
185次组卷
|
13卷引用:宁夏银川市宁夏大学附属中学2019-2020学年高二线上线下教学衔接摸底暨期中考试化学试题
宁夏银川市宁夏大学附属中学2019-2020学年高二线上线下教学衔接摸底暨期中考试化学试题(已下线)2012年苏教版高中化学选修4 2.1化学反应速率练习卷(已下线)2014-2015学年云南省玉溪市第一中学高二上学期期中考试化学试卷2014-2015学年辽宁实验分校高一下6月阶段测试化学试卷2015-2016学年贵州省思南中学高二上二次月考化学试卷【全国市级联考】福建省福州市八县协作校2017-2018学年高二上学期期末联考化学试题吉林松原乾安七中2019-2020学年高二上学期9月月考化学试题吉林省松原市乾安县七中2019-2020学年高二上学期第一次月考化学试题福建省泉州市永春华侨中学2019-2020学年高二上学期期中考试化学试题黑龙江省牡丹江市第三高级中学2019-2020学年高二上学期期中考试化学(理)试题陕西省宝鸡市金台区2020-2021学年高一下学期期中考试化学试题(已下线)课时35 化学反应速率及影响因素-2022年高考化学一轮复习小题多维练(全国通用)福建省福州市四校联盟2022-2023学年高二下学期期末联考化学试题

 )
)

