1 .  是
是 还原工业废水中六价Cr的催化剂,反应机理如图所示。
还原工业废水中六价Cr的催化剂,反应机理如图所示。
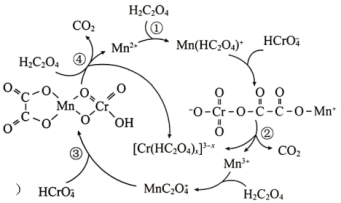
下列叙述错误 的是
 是
是 还原工业废水中六价Cr的催化剂,反应机理如图所示。
还原工业废水中六价Cr的催化剂,反应机理如图所示。
下列叙述
| A.反应①、③均不属于氧化还原反应 |
B.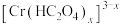 中Cr元素的化合价为+3价 中Cr元素的化合价为+3价 |
| C.加入Mn能够降低活化能,提高六价铬的转化率 |
D.总反应 |
您最近一年使用:0次
名校
解题方法
2 . 下列实验方案设计、现象和结论都正确的是
| 实验目的 | 方案设计 | 现象或结论 | |
| A | 探究反应物浓度对化学反应速率的影响 | 向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2mL5%H2O2溶液,观察现象 | 浓度大的NaHSO3溶液中气泡产生的速率快 |
| B | 测定中和反应的反应热 | 将50mL0.50mol/L氢氧化钠溶液,分批次倒入盛有50mL0.50mol/L盐酸的量热计内筒中 | 根据反应前后的温度变化和比热容等数值可计算中和反应的反应热 |
| C | 探究影响化学平衡移动的因素 | 向FeCl3和KSCN的混合溶液中,加入KCl固体 | 其他条件不变时,增大 的浓度,平衡不移动 的浓度,平衡不移动 |
| D | 探究KI与FeCl3反应的限度 | 取1mL0.1mol/LKI溶液于试管中,加入5mL0.1mol/LFeCl3溶液,充分反应后滴入5滴15%KSCN溶液 | 若溶液变血红色,则KI与FeCl3的反应有一定限度 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-06更新
|
423次组卷
|
4卷引用:宁夏石嘴山市第三中学2023-2024学年高三上学期第四次月考理科综合试卷
名校
3 . 已知反应:2NO(g)+2H2(g)  N2(g)+2H2O(g)生成N2的速率与NO、H2的初始浓度的关系为v=kcx(NO)•cy(H2),k为速率常数。在800℃时测得的相关数据如表所示。
N2(g)+2H2O(g)生成N2的速率与NO、H2的初始浓度的关系为v=kcx(NO)•cy(H2),k为速率常数。在800℃时测得的相关数据如表所示。
下列说法中不正确的是
 N2(g)+2H2O(g)生成N2的速率与NO、H2的初始浓度的关系为v=kcx(NO)•cy(H2),k为速率常数。在800℃时测得的相关数据如表所示。
N2(g)+2H2O(g)生成N2的速率与NO、H2的初始浓度的关系为v=kcx(NO)•cy(H2),k为速率常数。在800℃时测得的相关数据如表所示。| 实验数据 | 初始浓度(mol·L-1) | 生成N2的初始速率(mol·L-1·s-1) | |
| c(NO) | c(H2) | ||
| 1 | 2.00×10-3 | 6.00×10-3 | 1.92×10-3 |
| 2 | 1.00×10-3 | 6.00×10-3 | 4.80×10-4 |
| 3 | 2.00×10-3 | 3.00×10-3 | 9.60×10-4 |
| A.关系式中x=2、y=1 |
| B.800℃时,k的值为8×104 |
| C.反应体系的二种物质中,H2(g)的浓度对反应速率影响更大 |
| D.当其他条件不变时,升高温度,速率常数将增大 |
您最近一年使用:0次
解题方法
4 . 碳达峰、碳中和是现在需要继续完成的环保任务,CO2的综合利用成为热点研究对象,CO2作为碳源加氢是再生能源的有效方法,CO2加氢可以合成甲醇,0lah 提出“甲醇经济”概念,认为甲醇会在不久的将来扮演不可或缺的角色,通过CO2加氢生产甲醇是有希望的可再生路线之一,该过程主要发生如下反应:
反应Ⅰ: CO2 (g)+ H2(g) CO(g) +H2O(g) ΔH1
CO(g) +H2O(g) ΔH1
反应Ⅱ: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2=-41.1KJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-41.1KJ·mol-1
(1)①相关键能如下表,则ΔH1=_______ ,该反应的活化能Ea(正)_______ Ea(逆)(填“大于”“小于”或“等于”)。
②若K1、K2分别表示反应Ⅰ、反应Ⅱ的平衡常数。则CO(g) +2H2(g)  CH3OH(g) 的平衡常数K=
CH3OH(g) 的平衡常数K=_______ (用含K1、K2的代数式表示)。
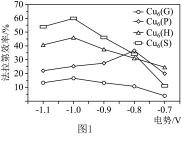
(2)据文献报道,Cu基纳米材料作为高性能催化剂可将CO2电还原为高能量密度的CH3OH,不同催化剂对生成CH3OH的法拉第效率与电极电势的变化如图1所示(已知法拉第效率是指实际生成物和理论生成物的百分比),为了保证生成甲醇的法拉第效率,最合适的电势及最佳催化剂是________ 。
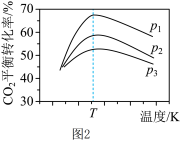
(3)在催化剂作用下,发生上述反应Ⅰ、Ⅱ, 达平衡时CO2的转化率随温度和压强的变化如图2,判断P1、P2、P3的大小关系:_______ ,解释压强一定时,CO2的平衡转化率呈现如图变化的原因:______ 。
(4)某温度下,初始压强为10MPa,向容积为2L的恒容密闭容器中充入2 mol CO2、3 mol H2发生反应Ⅰ、Ⅱ,平衡时CO2的转化率是50%,体系内剩余1 mol H2,反应Ⅱ的Kp=_______ 。
反应Ⅰ: CO2 (g)+ H2(g)
 CO(g) +H2O(g) ΔH1
CO(g) +H2O(g) ΔH1反应Ⅱ: CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2=-41.1KJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-41.1KJ·mol-1(1)①相关键能如下表,则ΔH1=
| 化学键 | H-H | C≡ O | O-H | C=O |
| 键能/ (kJ·mol-1) | 436 | 1071 | 464 | 803 |
 CH3OH(g) 的平衡常数K=
CH3OH(g) 的平衡常数K=(2)据文献报道,Cu基纳米材料作为高性能催化剂可将CO2电还原为高能量密度的CH3OH,不同催化剂对生成CH3OH的法拉第效率与电极电势的变化如图1所示(已知法拉第效率是指实际生成物和理论生成物的百分比),为了保证生成甲醇的法拉第效率,最合适的电势及最佳催化剂是

(3)在催化剂作用下,发生上述反应Ⅰ、Ⅱ, 达平衡时CO2的转化率随温度和压强的变化如图2,判断P1、P2、P3的大小关系:

(4)某温度下,初始压强为10MPa,向容积为2L的恒容密闭容器中充入2 mol CO2、3 mol H2发生反应Ⅰ、Ⅱ,平衡时CO2的转化率是50%,体系内剩余1 mol H2,反应Ⅱ的Kp=
您最近一年使用:0次
名校
解题方法
5 . 计算机模拟单个乙炔分子和氯化氢分子在催化剂表面的反应历程如图所示。下列说法错误的是
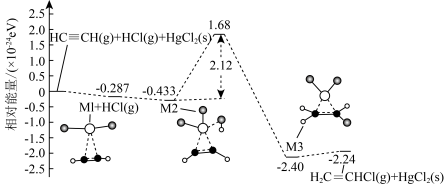

| A.该历程中活化能为2.113×10-24eV |
| B.M2为C2H2、HgCl2、HCl形成的中间体 |
| C.反应物或产物在催化剂表面进行吸附和脱离 |
| D.反应的热化学方程式为:HC≡CH(g)+HCl(g)→H2C=CHCl(g) ΔH=-2.24×10-24eV•mol-1 |
您最近一年使用:0次
名校
解题方法
6 . 环状碳酸酯广泛用于极性非质子溶剂、电池的电解质等,离子液体研究团队近期报道了一种环氧乙烷衍生物与二氧化碳催化合成环状碳酸酯的反应历程如图所示。已知:R表示烃基。下列说法错误的是
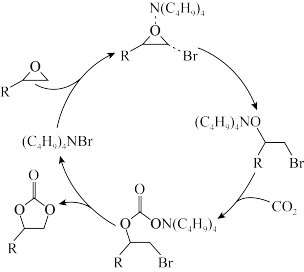

| A.(C4H9)4NBr是反应的催化剂 | B.反应过程存在极性键的断裂和形成 |
| C.反应过程中有4种中间体 | D.总反应属于加成反应 |
您最近一年使用:0次
2021-08-28更新
|
2825次组卷
|
10卷引用:宁夏石嘴山市第三中学2022-2023学年高二上学期期中考试化学(理)试题
宁夏石嘴山市第三中学2022-2023学年高二上学期期中考试化学(理)试题宁夏石嘴山市第三中学2022-2023学年高二上学期11月期中化学试题河南部分学校2022届新高三8月份摸底联考化学试题山西省大同市2022届高三上学期学情调研测试化学试题河南省南阳市第一中学校2021-2022学年高三上学期第三次月考化学试题湖南省长沙市长郡中学2021-2022学年高三下学期第一次模考化学试题湖南省长沙市长郡中学2022-2023学年高三第三次月考化学试题巩固训练13吉林省长春市东北师范大学附属中学2022-2023学年高一下学期期末考试化学试题河北师范大学附属中学2023-2024学年高二上学期开学考试化学试题
7 . 随着新能源汽车销量的猛增,动力电池退役高峰将至,磷酸铁锂(LFP)是目前使用最多的动力电池材料,因此回收磷酸铁锂具有重要意义。一种从废旧磷酸铁锂正极片( LiFePO4、导电石墨、铝箔)中回收锂的工艺流程如图:
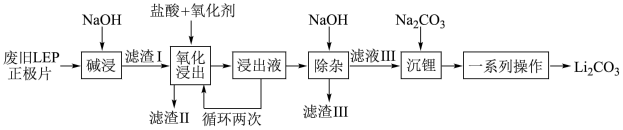
已知:Li2CO3在水中的溶解度随温度升高而降低,但煮沸时发生水解。回答下列问题:
(1)在“碱浸”时,为加快浸出速率,下列措施不可行的是_______ (填标号)。
a.适当提高浸出温度
b.使用电动搅拌器
c.适当提高氢氧化钠的浓度
d.增大废料的颗粒
(2)“氧化浸出”时,保持其他条件不变,不同氧化剂对锂的浸出实验结果如表,实际生产中氧化剂选用H2O2,不选用 NaClO3的原因是______ 。在“氧化浸出”时,温度不宜超过50℃,其目的是________ 。“氧化浸出”时生成了难溶的FePO4,该反应的离子方程式为_________ 。
(3)“浸出液”循环两次的目的是________ 。
(4)“沉锂”的温度保持在95℃,最适宜的加热方式为________ 。“一系列操作”具体包括______ 、洗涤、干燥。
(5)“滤渣Ⅱ”经纯化可得FePO4,流程中生成的Li2CO3、FePO4在高温条件下与H2C2O4煅烧可得 LiFePO4,实现再生利用,其化学方程式为_________ 。

已知:Li2CO3在水中的溶解度随温度升高而降低,但煮沸时发生水解。回答下列问题:
(1)在“碱浸”时,为加快浸出速率,下列措施不可行的是
a.适当提高浸出温度
b.使用电动搅拌器
c.适当提高氢氧化钠的浓度
d.增大废料的颗粒
(2)“氧化浸出”时,保持其他条件不变,不同氧化剂对锂的浸出实验结果如表,实际生产中氧化剂选用H2O2,不选用 NaClO3的原因是
| 序号 | 锂含量/% | 氧化剂 | pH | 浸出液体Li浓度/(g·L-1) | 浸出渣中Li含量/% |
| 1 | 3.7 | H2O2 | 3.5 | 9.02 | 0.10 |
| 2 | 3.7 | NaClO3 | 3.5 | 9.05 | 0.08 |
| 3 | 3.7 | O2 | 3.5 | 7.05 | 0.93 |
| 4 | 3.7 | NaClO | 3.5 | 8.24 | 0.43 |
(4)“沉锂”的温度保持在95℃,最适宜的加热方式为
(5)“滤渣Ⅱ”经纯化可得FePO4,流程中生成的Li2CO3、FePO4在高温条件下与H2C2O4煅烧可得 LiFePO4,实现再生利用,其化学方程式为
您最近一年使用:0次
2020-11-02更新
|
507次组卷
|
3卷引用:宁夏银川一中2021届高三第三次月考理综化学试题
名校
8 . 下列装置或操作能达到目的的是


| A.装置①用于测定生成氢气的速率 |
| B.装置②依据褪色快慢比较浓度对反应速率的影响 |
| C.装置③依据U形管两边液面的高低判断Na和水反应的热效应 |
| D.装置④依据出现浑浊的快慢比较温度对反应速率的影响 |
您最近一年使用:0次
2018-11-05更新
|
1892次组卷
|
18卷引用:宁夏回族自治区中宁县第一中学2022-2023学年高二上学期10月月考化学试题
宁夏回族自治区中宁县第一中学2022-2023学年高二上学期10月月考化学试题【全国百强校】广东省佛山市第一中学2018-2019学年高二上学期第一次段考化学试题黑龙江省大庆实验中学2019-2020学年高二上学期第一次月考化学试题福建省永泰县第一中学2019-2020学年高二上学期期中考试化学试题(已下线)2019年12月20日 《每日一题》人教版(选修4)——外界条件对化学反应速率的影响广东省梅州中学2021届高三热身测试化学试题山东省烟台市莱州第一中学2021-2022学年高二上学期10月月考化学试题广东省佛山市第二中学2020-2021学年高二上学期期中考试化学试题吉林省抚松县第一中学2021-2022学年高二下学期开学考试化学试题广东省江门市第一中学2022-2023学年高二上学期第一次月考化学试题云南省玉溪市华宁县第二中学2021-2022年高二下学期开学考试化学试题云南省玉溪市江川区第二中学2021-2022学年高二下学期开学考试化学试题云南省蒙自市第一高级中学2022-2023学年高二下学期3月月考化学试题江西省乐平中学2022-2023学年高二上学期11月期中考试化学试题河北省石家庄市第二十七中学2023-2024学年高二上学期第一次月考化学试题重庆市第一中学校2023-2024学年高二上学期第一次月考化学试题吉林省长春市第二实验中学2023-2024学年高二上学期期中考试化学试题黑龙江省哈尔滨市第一中学校2023-2024学年高二上学期第一次质量检测化学试题
名校
9 . 某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
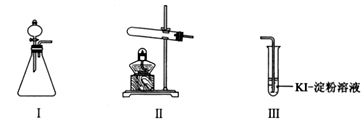
供选试剂:30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体。
(1)小组同学设计甲、乙、丙三组实验,记录如下:
(2)丙实验中O2与KI溶液反应的离子方程式是__________________________ 。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是___________ 。为进一步探究该条件对反应速率的影响,可采取的实验措施是________________________ 。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列________ 溶液(填序号),证明了白雾中含有H2O2。
A.酸性KMnO4 B.FeCl2 C.氢硫酸 D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI +O2 +2H2O=2I2 + 4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应(写离子方程式)_____________________ 造成的,请设计实验证明他们的猜想是否正确。_________________________________________ 。

供选试剂:30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体。
(1)小组同学设计甲、乙、丙三组实验,记录如下:
| 操作 | 现象 | |
| 甲 | 向I的锥形瓶中加入 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
| 乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
| 丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列
A.酸性KMnO4 B.FeCl2 C.氢硫酸 D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI +O2 +2H2O=2I2 + 4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应(写离子方程式)
您最近一年使用:0次
名校
10 . 下列实验能达到相应目的的是
| 选项 | A | B | C | D |
| 实验过程 |  | 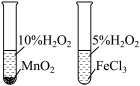 | 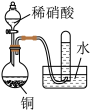 | 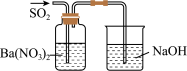 |
| 实验目的 | 将乙二醇转化为乙二酸 | 比较氯化铁和二氧化锰对H2O2分解反应的催化效果 | 证明稀硝酸与铜反应时表现出氧化性 | 用SO2与Ba(NO3)2反应获得BaSO3沉淀 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-05-13更新
|
1689次组卷
|
6卷引用:【全国百强校】宁夏银川市第二中学2018届高三三模考试理科综合化学试题



