名校
1 . 下图为有关分子在催化剂作用下发生转化的示意图,下列叙述正确的是
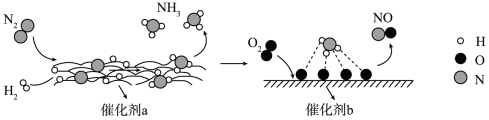
A. , , 均属于氮的固定 均属于氮的固定 |
| B.催化剂a、b表面均有极性共价键形成 |
C.如果向容器中放入1mol 和3mol 和3mol ,最终可以生成2mol ,最终可以生成2mol |
D.在催化剂b表面2.24L 反应生成NO转移电子数目为0.5NA 反应生成NO转移电子数目为0.5NA |
您最近一年使用:0次
2022-05-27更新
|
371次组卷
|
3卷引用:宁夏平罗中学2022-2023学年高一下学期期中考试化学试题
12-13高一下·四川广安·期末
名校
解题方法
2 . 向四个体积相同的密闭容器中分别充入一定量的 和
和 ,开始反应时,按正反应速率由大到小的顺序排列,正确的是
,开始反应时,按正反应速率由大到小的顺序排列,正确的是
①500℃,10mol 和5mol
和5mol 反应
反应
②500℃,用 作催化剂,10mol
作催化剂,10mol 和5mol
和5mol 反应
反应
③450℃,8mol 和5mol
和5mol 反应
反应
④500℃,8mol 和5mol
和5mol 反应
反应
 和
和 ,开始反应时,按正反应速率由大到小的顺序排列,正确的是
,开始反应时,按正反应速率由大到小的顺序排列,正确的是 ①500℃,10mol
 和5mol
和5mol 反应
反应②500℃,用
 作催化剂,10mol
作催化剂,10mol 和5mol
和5mol 反应
反应③450℃,8mol
 和5mol
和5mol 反应
反应④500℃,8mol
 和5mol
和5mol 反应
反应| A.①②③④ | B.②①③④ | C.②①④③ | D.④③②① |
您最近一年使用:0次
2022-05-19更新
|
1497次组卷
|
77卷引用:宁夏回族自治区银川一中2021-2022学年高一下学期期中考试化学试题
宁夏回族自治区银川一中2021-2022学年高一下学期期中考试化学试题(已下线)2012-2013学年四川省广安市高一下学期期末考试化学试卷2014-2015学年吉林省长春外国语学校高一下期末化学试卷12014-2015学年吉林省长春外国语学校高一下期末化学试卷22015-2016学年山东省青岛市华侨中学高二上学期10月月考化学试卷2015-2016学年河北省秦皇岛市卢龙县高一下学期期中考试化学试卷2015-2016学年新疆生产建设兵团二中高一下期中化学试卷2015-2016学年江西省丰城中学高一下学期第二次月考化学试卷2016-2017学年湖北省七校(荆州中学、襄阳五中、襄阳四中等)高一下学期期中联考化学试卷河北省秦皇岛市卢龙县2016-2017学年高一下学期期末考试化学试题黑龙江省哈尔滨市第六中学2016-2017学年高一下学期期末考试化学试题青海省西宁市第四高级中学2017-2018学年高二上学期第一次月考化学试题福建省南安第一中学2017-2018学年高二上学期期中考试化学试题2017-2018学年高一化学人教版必修2:第二章检测题《课时同步君》2017-2018学年高一化学人教必修2-2.3.1 化学反应的速率(已下线)《周末培优君》2017-2018学年高一下学期化学-第07周 化学反应的速率和限度【全国市级联考】江苏省宿迁市2017-2018学年高一下学期期中考试化学试题【全国市级联考】黑龙江省齐齐哈尔市2017-2018学年高一下学期期末考试化学试题河北省安平中学2017-2018学年高一下学期期末考试化学试题1山西省长治市沁县中学2018-2019学年高一下学期期中考试化学试题【全国百强校】江西省南昌市第二中学2018-2019学年高一下学期第二次月考化学试题吉林省吉林市第五十五中学2018-2019学年高一下学期期中考试化学试题陕西省咸阳百灵中学2019-2020学年高二上学期期中考试化学(理)试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 影响化学反应速率的因素(强化练习)2020年人教版高中化学必修2第二章《化学反应与能量》测试卷26.2.1 化学反应的速率——2020年春高一新人教版第二册化学一课一练(已下线)【南昌新东方】2019 南昌二中 高一下 第二次月考山东省烟台市第二中学2019-2020学年高一下学期4月月考化学试题四川省成都外国语学校2019-2020学年高一下学期开学考试化学试题湖南省双峰县第一中学2019-2020学年高一下学期入学考试化学试题2020年春高一化学新人教版第二册课后同步:6.2.1 化学反应的速率福建省莆田第二十四中学2019-2020学年高一化学下学期期中测试卷黑龙江省牡丹江市第一高级中学2019-2020学年高一下学期5月线上月考化学试题江西省南昌市第二中学2019-2020学年高一下学期第一次月考化学试题甘肃省张掖市高台县第一中学2019-2020学年高一下学期期中考试化学试题山东省烟台市第三中学2019-2020学年高一下学期4月月考化学试题辽宁省朝阳市凌源市凌源中学2019-2020高一下学期5月考试化学试题辽宁省葫芦岛市2019-2020学年高一下学期期末考试化学试题江西省南昌市第十中学2019-2020学年高二上学期第一次月考化学试题陕西省渭南市临渭区铁路自立中学2019-2020学年高一下学期5月月考化学试题山东省临沂第一中学2019-2020学年高一下学期期中考试化学试题鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第3节 化学反应的速率甘肃省平凉市庄浪县第一中学2019-2020学年高一下学期期中考试化学试题鲁科版(2019)高一必修第二册 第2章 化学键 反应规律 第三节 化学反应的快慢和限度 方法帮辽宁省葫芦岛市第八高级中学2020-2021学年高二上学期实验班第一次月考化学试题(人教版2019)必修第二册 第六章 化学反应与能量 第二节 化学反应的速率与限度人教版2019必修第二册 第六章 第二节 第1课时 化学反应的速率湖北省襄阳市第五中学2019-2020学年高一下学期6月月考化学试题江西省赣州市会昌县第五中学2020-2021学年高二上学期第一次月考化学试题兰州市第二十七中学2020-2021学年高一下学期期中考试化学试题四川省乐山市十校2020-2021学年高一下学期期中联考化学试题黑龙江省嫩江市第一中学校等五校2020-2021学年高一下学期期中联考化学试题四川省夹江中学校2020-2021学年高二下学期期中考试化学试题安徽省合肥市六校2020-2021学年高一下学期期末教学质量检测化学试题(已下线)课时35 化学反应速率及影响因素-2022年高考化学一轮复习小题多维练(全国通用)江苏省淮安市车桥中学2021-2022学年高二上学期入学调研(A)化学试题(已下线)选择性必修1 期中检测(基础过关卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)吉林省永吉县第四中学2021-2022学年高二上学期第一次月考化学试题(已下线)2.1.2 影响化学反应速率的因素(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)第09讲 化学反应速率(讲义)-【寒假自学课】2023年高一化学寒假精品课(人教版2019必修第二册)浙江省温州市平阳县万全综合高级中学2021-2022学年高二上学期期中考试化学试题(已下线)6.1.2 化学反应速率(第2课时 影响化学反应速率的因素)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)(已下线)第13讲 化学反应速率(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)课后-6.2.1 化学反应的速率-人教2019必修第二册湖北省襄阳市第三十六中学2021-2022学年高一下学期期中考试化学试题北京市清华大学附属中学2021-2022学年高一下学期期中考试化学试题山东省济宁市泗水县2021-2022学年高一下学期期中考试化学试题辽宁省鞍山市第一中学2021-2022学年高一下学期期中考试化学试题黑龙江省七台河市勃利县高级中学2021-2022学年高一下学期期中考试化学试题山东师范大学附属中学2021-2022学年高一下学期期中考试(等级考)化学试题内蒙古自治区包头市2020-2021高一下学期期末教学质量检测试卷化学试题黑龙江省伊春市伊美区第二中学2022-2023学年高二上学期开学考试化学试题 云南省楚雄天人中学2021-2022学年高二上学期12月月考化学试题(B卷)重庆市二0三中学2021-2022学年高一下学期第二次月考化学试题山东省聊城市颐中外国语学校2021-2022学年高一下学期期中考试化学试题新疆乌鲁木齐市第八十中学2022-2023学年高二上学期期中考试化学试题(已下线)专题03 化学反应速率与化学平衡(知识串讲+专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(沪科版2020必修第二册)
名校
3 . 某小组对一定条件下的反应2SO2(g)+O2(g) 2SO3(g) ΔH=-197.7 kJ/mol进行研究。
2SO3(g) ΔH=-197.7 kJ/mol进行研究。
(1)相同条件下,在某恒容密闭容器中充入2molSO2和1molO2,发生上述反应。下列情况能说明反应达到化学平衡状态的是_______ (填标号)。
A.v(SO2)=2v(O2)
B.容器内气体的压强保持不变
C.SO2与O2的浓度比保持不变
D.混合气体的平均相对分子质量保持不变
E.O2的分压保持不变
F.气体的密度保持不变
(2)在一个容积为2L的恒温恒容密闭容器中,以不同投料方式研究上述反应,得到的数据如下表:
①表中a=_______ ,b=_______ ,甲组实验在该条件下的平衡常数K=_______ 。
②在相同条件下,若将甲组实验按1molSO2、0.5molO2、2molSO3进行投料,则反应开始时v正_______ v逆(填“>”“=”或“<”),平衡时SO3的百分含量与原甲组实验相比_______ (填“变大”“变小”或“不变”)。
③为加快乙组实验的反应速率,下列措施可行的是_______ (填标号)。
A.升高温度 B.降低温度 C.充入适量N2 D.移走SO2
若将乙组实验的容器改为恒温恒压容器,则b值_______ (填“变大”“变小”或“不变”)。
 2SO3(g) ΔH=-197.7 kJ/mol进行研究。
2SO3(g) ΔH=-197.7 kJ/mol进行研究。(1)相同条件下,在某恒容密闭容器中充入2molSO2和1molO2,发生上述反应。下列情况能说明反应达到化学平衡状态的是
A.v(SO2)=2v(O2)
B.容器内气体的压强保持不变
C.SO2与O2的浓度比保持不变
D.混合气体的平均相对分子质量保持不变
E.O2的分压保持不变
F.气体的密度保持不变
(2)在一个容积为2L的恒温恒容密闭容器中,以不同投料方式研究上述反应,得到的数据如下表:
| 实验分组 | 甲组 | 乙组 |
| 反应物 | 2molSO2、1molO2 | 2molSO3 |
| 反应热量 | 放热158.16kJ | 吸热bkJ |
| 反应物的平衡转化率 | a |
②在相同条件下,若将甲组实验按1molSO2、0.5molO2、2molSO3进行投料,则反应开始时v正
③为加快乙组实验的反应速率,下列措施可行的是
A.升高温度 B.降低温度 C.充入适量N2 D.移走SO2
若将乙组实验的容器改为恒温恒压容器,则b值
您最近一年使用:0次
名校
解题方法
4 . 我国科学家使用双功能催化剂催化水煤气变换反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH<0,在低温下获得高转化率与高反应速率,反应过程示意图如下,下列说法正确的是


| A.过程Ⅰ、过程Ⅱ均为放热过程 |
| B.图中显示:起始时的2个H2O都参与了反应过程 |
| C.过程Ⅲ只生成了极性共价键 |
| D.使用催化剂降低了水煤气变换反应的ΔH |
您最近一年使用:0次
2022-05-16更新
|
371次组卷
|
15卷引用:宁夏银川市第二中学2021-2022学年高二下学期期中考试化学试题
宁夏银川市第二中学2021-2022学年高二下学期期中考试化学试题【市级联考】四川省攀枝花市2019届高三下学期第三次统考理科综合化学试题(已下线)专题07 化学反应中的能量变化——2019年高考真题和模拟题化学分项汇编2019年湖南省郴州市高三第一次教学质量监测化学试题2020届高三《新题速递·化学》1月第02期(考点01-06)北京市通州区2020届高三上学期期末摸底考试化学试题北京市2020届高三下学期周末测试化学试题广东省佛山市第一中学2019-2020学年高一下学期第一次段考化学试题河南省顶级名校2021届高三年级上学期期中考试化学试题山西省潞城第一中学2020-2021学年高二下学期3月月考化学试卷题福建省莆田第一中学2020-2021学年高二下学期期中考试化学试题第34届(2021年)高中化学奥林匹克竞赛浙江省预赛试题甘肃省嘉峪关市第一中学2021届高三下学期六模考试理综化学试题天津市第二南开学校2022-2023学年度高二上学期期中质量调查化学试题上海财经大学附属中学2022-2023学年高二上学期期中考试化学试题
名校
5 . 某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)实验室中现有Na2SO3、MgSO4、Ag2SO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是_______ ;
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中: V9=_______ ;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_______ 。
(3)一定量的锌粉和6mol·L-1的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2的总量的是
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓硫酸
(4)把锌片投入盛有盐酸的敞口容器中,产生氢气的速率变化曲线如图所示,刚开始反应速率增大的原因是_______ ,后反应速率又减小的原因是_______ 。(填正确选项前的序号)
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
(1)实验室中现有Na2SO3、MgSO4、Ag2SO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验/混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
(3)一定量的锌粉和6mol·L-1的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2的总量的是
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓硫酸
| A.①②④ | B.①③⑤ | C.③④⑤ | D.①③④ |
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度

您最近一年使用:0次
名校
6 . Ⅰ 氮及其化合物的转化过程如图1所示,其中图2为反应①过程中能量变化的曲线图。
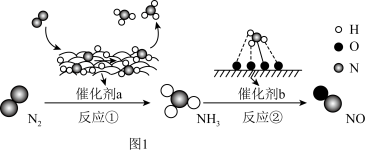
(1)图2中曲线_______ (填字母)是加入催化剂a时的能量变化曲线,该反应破坏生成物全部化学键所需要的总能量_______ (填“大于”或“小于”或“等于”)破坏反应物全部化学键所需要的总能量

(2)标准状况下进行反应②,若有1.25mol电子发生转移,则参加反应的NH3的体积为_______
(3)下列说法正确的是
Ⅱ.以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径

(4)请写出CO2的电子式_______ ,该反应的机理及各分子化学键完全断裂时的能量变化如图所示,根据数据计算,分解1molCO2需_______ (填“吸收”或“放出”) _______ kJ的能量。


(1)图2中曲线

(2)标准状况下进行反应②,若有1.25mol电子发生转移,则参加反应的NH3的体积为
(3)下列说法正确的是
| A.合成氨在工业生产中常将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B.工业合成氨中,为加快化学反应速率,压强和温度越高越好 |
| C.合成氨工业要用合适的催化剂,目的是降低该反应的活化能 |
| D.工业合成氨中反应物不能百分之百转化为生成物 |
Ⅱ.以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径

(4)请写出CO2的电子式

您最近一年使用:0次
名校
7 . 2L恒容密闭容器中通入A、B各10mol,在一定温度下进行反应:3A(g)+B(g)  2C(g)+2D(s),下列说法不正确的是
2C(g)+2D(s),下列说法不正确的是
 2C(g)+2D(s),下列说法不正确的是
2C(g)+2D(s),下列说法不正确的是| A.①体系气体密度不变;②B的体积分数不变;③2v逆(A)=3v正(C),三种现象均可以说明该反应达到平衡 |
| B.①增加D的质量;②向体系中充入He;③抽出A减小体系压强,三种操作都不能增大逆反应速率 |
| C.对于该反应,无论正反应还是逆反应,升高温度,反应速率均上升 |
| D.若向容器内同时加入四种物质的物质的量均为6mol,则反应达到其限度时,2mol/L<c(B)<4.5mol/L |
您最近一年使用:0次
2022-04-26更新
|
323次组卷
|
3卷引用:宁夏石嘴山第三中学2021-2022学年高一下学期期末考试化学试题
名校
解题方法
8 . 20世纪初,德国化学家哈伯在实验室首次利用氯气和氢气合成了氨:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ·mol-1,从此人类进入了新的农业时代,化肥的使用大大提高了粮食产量。双催化剂“TM—LiH(TM表示过渡金属)”催化合成氨反应的原理示意如图:
2NH3(g) △H=-92.4kJ·mol-1,从此人类进入了新的农业时代,化肥的使用大大提高了粮食产量。双催化剂“TM—LiH(TM表示过渡金属)”催化合成氨反应的原理示意如图:
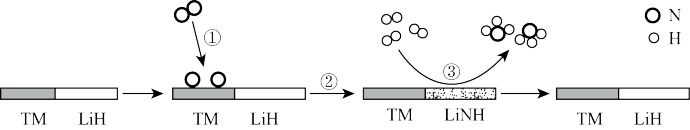
下列说法正确的是
 2NH3(g) △H=-92.4kJ·mol-1,从此人类进入了新的农业时代,化肥的使用大大提高了粮食产量。双催化剂“TM—LiH(TM表示过渡金属)”催化合成氨反应的原理示意如图:
2NH3(g) △H=-92.4kJ·mol-1,从此人类进入了新的农业时代,化肥的使用大大提高了粮食产量。双催化剂“TM—LiH(TM表示过渡金属)”催化合成氨反应的原理示意如图:
下列说法正确的是
| A.过程①中,N2分子断键变成N原子会释放能量 |
| B.当1molN2参与反应,过程②中生成1molLiNH |
| C.过程③中,没有化学键的断裂,只有化学键的形成 |
| D.双催化剂“TM—LiH”能加快合成氨反应的速率 |
您最近一年使用:0次
2022-04-22更新
|
182次组卷
|
2卷引用:宁夏石嘴山市平罗中学2021-2022学年高一下学期期中考试化学试题
名校
解题方法
9 . 已知分解1mol H2O2放出热量98kJ,在含少量I-的溶液中,H2O2的分解机理为:
H2O2+I-→H2O+IO-慢
H2O2+IO-→H2O+O2+I-快
下列说法正确的是
H2O2+I-→H2O+IO-慢
H2O2+IO-→H2O+O2+I-快
下列说法正确的是
| A.该反应的速率与I-的浓度有关 |
| B.IO-也是该反应的催化剂 |
| C.总反应中反应物的总能量小于生成物的总能量 |
| D.在相同时间内:v(H2O2)=v(H2O)=v(O2) |
您最近一年使用:0次
2022-04-22更新
|
203次组卷
|
3卷引用:宁夏石嘴山市平罗中学2021-2022学年高一下学期期中考试化学试题
宁夏石嘴山市平罗中学2021-2022学年高一下学期期中考试化学试题浙江省七彩阳光新高考研究联盟2021-2022学年高一下学期期中联考化学试题(已下线)【2023】【高一下】【期中考】【杭九】【高中化学】【赵燕丽收集】
名校
解题方法
10 . 回答下列问题:
(1)我校化学社团做了如下探究实验:利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究外界条件改变对化学反应速率的影响。实验数据如表所示:
①写出该反应的离子方程式:_______ 。
②通过实验A、B可探究_______ (填外部因素)的改变对反应速率的影响,其中V1=_______ ;通过实验_______ (填实验序号)可探究温度变化对化学反应速率的影响。
③利用实验B中数据计算,用KMnO4溶液的浓度变化表示的反应速率v(KMnO4)=_______ 。
④实验中发现:反应一段时间后该反应速率会突然加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是_______ ,相应的粒子最有可能是_______ 。
(2)一种新型催化剂能使NO和CO发生反应:2NO+2CO 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。
①表中a=_______ ,b=_______ 。
②能验证温度对化学反应速率影响规律的是实验_______ (填实验编号)。
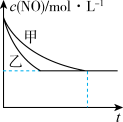
③实验I和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验II的是曲线_______ (填“甲”或“乙”)。
(1)我校化学社团做了如下探究实验:利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究外界条件改变对化学反应速率的影响。实验数据如表所示:
| 实验 序号 | 实验温度/K | KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | 溶液颜色褪至无色时所需时间/s | ||
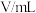 |  | 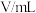 |  | 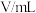 | |||
| A | 293 | 2 | 0.02 | 5 | 0.1 | 3 |  |
| B | 293 | 2 | 0.02 | 3 | 0.1 |  | 8 |
| C | 313 | 2 | 0.02 |  | 0.1 | 5 |  |
②通过实验A、B可探究
③利用实验B中数据计算,用KMnO4溶液的浓度变化表示的反应速率v(KMnO4)=
④实验中发现:反应一段时间后该反应速率会突然加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是
(2)一种新型催化剂能使NO和CO发生反应:2NO+2CO
 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。实验 编号 | t/℃ | NO初始浓度/mol·L-1 | CO初始浓度/mol·L-1 | 催化剂的比表面积/m2/g |
| I | 280 | 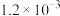 | 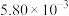 | 82 |
| II | 280 | 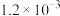 | b | 124 |
| Ⅲ | 350 | a | 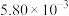 | 82 |
②能验证温度对化学反应速率影响规律的是实验
③实验I和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验II的是曲线

您最近一年使用:0次



