名校
1 . 在容积固定的密闭容器中存在如下反应: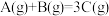 ;(正反应为放热反应)某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:下列判断
;(正反应为放热反应)某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:下列判断一定错误 的是
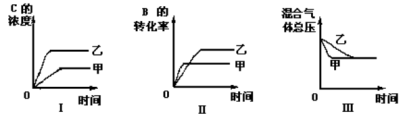
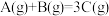 ;(正反应为放热反应)某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:下列判断
;(正反应为放热反应)某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:下列判断
| A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高 |
| B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高 |
| C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高 |
| D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高 |
您最近一年使用:0次
2021-01-02更新
|
121次组卷
|
3卷引用:宁夏回族自治区贺兰县第二高级中学2023-2024学年高二上学期10月第一次阶段性考试化学试题
名校
解题方法
2 . 阳离子交换膜法电解饱和食盐水具有综合能耗低、环境污染小等优点。生产流程如图所示:

(1)电解饱和食盐水的化学方程式为____________ 。
(2)电解结束后,能够脱去阳极液中游离氯的试剂或方法是________ (填字母序号)。
a.Na2SO4b.NaNO3
c.热空气吹出d.降低阳极区液面上方的气压
(3)食盐水中的I-若进入电解槽,可被电解产生的Cl2氧化为ICl,并进一步转化为 。
。 可继续被氧化为高碘酸根(
可继续被氧化为高碘酸根(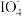 ),与Na+结合生成溶解度较小的NaIO4沉积于阳离子交换膜上,影响膜的寿命。
),与Na+结合生成溶解度较小的NaIO4沉积于阳离子交换膜上,影响膜的寿命。
①ICl为有毒的黑色晶体,可用氢氧化钠溶液吸收,请写出相应的离子反应方程式:_______________________ 。
②请写出NaIO3被氧化为NaIO4的离子反应方程式为________________________ 。
(4)在酸性条件下加入NaClO溶液,可将食盐水中的I-转化为I2,再进一步除去。通过测定体系的吸光度,可以检测不同pH下I2的生成量随时间的变化,如下图所示。已知:吸光度越高表明该体系中c(I2)越大。

①结合化学用语解释10min时不同pH体系吸光度不同的原因:__________________ 。
②pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因____________________ 。
③研究表明食盐水中I-含量≤0.2mg•L-1时对离子交换膜影响可忽略。现将1m3含I-浓度为1.47mg•L-1的食盐水进行处理,为达到使用标准,理论上至少 需要0.05mol•L-1NaClO溶液_____________ L。(已知NaClO的反应产物为NaCl,溶液体积变化忽略不计)

(1)电解饱和食盐水的化学方程式为
(2)电解结束后,能够脱去阳极液中游离氯的试剂或方法是
a.Na2SO4b.NaNO3
c.热空气吹出d.降低阳极区液面上方的气压
(3)食盐水中的I-若进入电解槽,可被电解产生的Cl2氧化为ICl,并进一步转化为
 。
。 可继续被氧化为高碘酸根(
可继续被氧化为高碘酸根(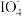 ),与Na+结合生成溶解度较小的NaIO4沉积于阳离子交换膜上,影响膜的寿命。
),与Na+结合生成溶解度较小的NaIO4沉积于阳离子交换膜上,影响膜的寿命。①ICl为有毒的黑色晶体,可用氢氧化钠溶液吸收,请写出相应的离子反应方程式:
②请写出NaIO3被氧化为NaIO4的离子反应方程式为
(4)在酸性条件下加入NaClO溶液,可将食盐水中的I-转化为I2,再进一步除去。通过测定体系的吸光度,可以检测不同pH下I2的生成量随时间的变化,如下图所示。已知:吸光度越高表明该体系中c(I2)越大。

①结合化学用语解释10min时不同pH体系吸光度不同的原因:
②pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因
③研究表明食盐水中I-含量≤0.2mg•L-1时对离子交换膜影响可忽略。现将1m3含I-浓度为1.47mg•L-1的食盐水进行处理,为达到使用标准,理论上
您最近一年使用:0次
名校
3 . 反应2X(g)+Y(g) 2Z(g);△H<0,在不同温度(T1和T2)下,产物Z的物质的量n与反应时间t的关系如图所示,则下列判断中正确的是( )
2Z(g);△H<0,在不同温度(T1和T2)下,产物Z的物质的量n与反应时间t的关系如图所示,则下列判断中正确的是( )
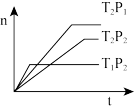
 2Z(g);△H<0,在不同温度(T1和T2)下,产物Z的物质的量n与反应时间t的关系如图所示,则下列判断中正确的是( )
2Z(g);△H<0,在不同温度(T1和T2)下,产物Z的物质的量n与反应时间t的关系如图所示,则下列判断中正确的是( )
| A.T1<T2,P1<P2 |
| B.T1<T2,P1>P2 |
| C.T1>T2,P1>P2 |
| D.T1>T2,P1<P2 |
您最近一年使用:0次
2020-12-02更新
|
177次组卷
|
6卷引用:宁夏贺兰县景博中学2019-2020学年高二上学期第一次月考化学试题
名校
解题方法
4 . 汽车尾气处理存在反应:NO2(g)+CO(g) NO(g)+CO2(g),该反应过程及能量变化如图所示,下列说法正确的是( )
NO(g)+CO2(g),该反应过程及能量变化如图所示,下列说法正确的是( )
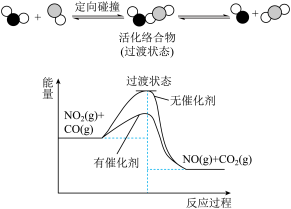
 NO(g)+CO2(g),该反应过程及能量变化如图所示,下列说法正确的是( )
NO(g)+CO2(g),该反应过程及能量变化如图所示,下列说法正确的是( )
| A.升高温度,平衡正向移动 |
| B.该反应生成了具有非极性共价键的CO2 |
| C.反应物转化为活化络合物需要吸收能量 |
| D.使用催化剂可以有效提高反应物的平衡转化率 |
您最近一年使用:0次
2020-11-14更新
|
252次组卷
|
8卷引用:宁夏银川市唐徕中学2023-2024学年高二上学期9月月考化学试题
名校
5 . 反应C(s)+H2O(g) CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量 ②保持体积不变,充入N2使体系压强增大
③将容器的体积缩小一半 ④保持压强不变,充入N2使容器体积变大
 CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是①增加C的量 ②保持体积不变,充入N2使体系压强增大
③将容器的体积缩小一半 ④保持压强不变,充入N2使容器体积变大
| A.①④ | B.②③ | C.①② | D.③④ |
您最近一年使用:0次
2020-11-11更新
|
504次组卷
|
16卷引用:宁夏石嘴山市第三中学2019-2020学年高二6月月考化学试题
宁夏石嘴山市第三中学2019-2020学年高二6月月考化学试题青海省西宁市第四高级中学2017-2018学年高二上学期第二次月考化学试题【全国百强校】黑龙江省大庆实验中学2018-2019学年高二上学期10月月考化学试题河南省安阳市第三十六中学2018-2019学年高二上学期第一次月考化学试题内蒙古呼伦贝尔市阿荣旗第一中学2020-2021学年高二上学期月考化学试题甘肃省张掖市第二中学2021-2022学年高二上学期10月月考(B班)化学试题甘肃省张掖市第二中学2021-2022学年高二上学期10月月考(A班)化学试题辽宁省辽河油田第一高级中学2021-2022学年高二上学期月考化学试题(A部)(已下线)2018年9月13日 《每日一题》人教选修4-影响化学平衡移动的因素(一)内蒙古翁牛特旗乌丹第二中学2019-2020学年高二上学期期中考试化学试题(已下线)2.3.2 压强变化对化学平衡的影响(重点练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)广东省惠州市惠东中学2020-2021学年高二上学期期中考试化学试题辽宁省沈阳市郊联体2020-2021学年高二上学期期中考试化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第2节 化学反应的限度课时2 反应条件对化学平衡的影响第二节 化学平衡 第3课时 影响化学平衡的因素(已下线)化学反应速率与化学平衡——课时5影响化学平衡的因素
名校
6 . 在恒容条件下,能使NO2(g)+CO(g) CO2(g)+NO(g)正反应速率增大且活化分子的百分数也增大的措施是:
CO2(g)+NO(g)正反应速率增大且活化分子的百分数也增大的措施是:
 CO2(g)+NO(g)正反应速率增大且活化分子的百分数也增大的措施是:
CO2(g)+NO(g)正反应速率增大且活化分子的百分数也增大的措施是:| A.增大NO2或CO的浓度 |
| B.减小CO2或NO的浓度 |
| C.通入Ne使气体的压强增大 |
| D.升高反应的温度 |
您最近一年使用:0次
2020-11-02更新
|
644次组卷
|
22卷引用:宁夏大学附属中学2020-2021学年高二下学期第一次月考化学试题
宁夏大学附属中学2020-2021学年高二下学期第一次月考化学试题2016-2017学年江苏省泰州中学高二上月考一化学试卷山东师范大学附属中学2017-2018学年高二上学期第五次学分认定考试化学(理)试题福建省漳州市长泰县第一中学2019-2020学年高二10月月考化学试题重庆市第一中学2020-2021学年高二10月月考化学试题河南省安阳县第三高级中学2020-2021学年高二上学期第一次阶段考试化学试题重庆市清华中学2020-2021学年高二11月月考化学试题河南省新乡县龙泉高级中学2021-2022学年高二上学期9月月考化学试题四川省南充高级中学2021-2022学年高一下学期第二次月考化学试题2015-2016学年安徽省舒城晓天中学高二上学期期中测试化学试卷2016-2017学年山西省怀仁一中高二上开学考化学试卷2016-2017学年湖北沙市中学高二上第一次双周练化学卷安徽师范大学附属中学2017-2018学年高二上学期期中考查化学试题山东省师范大学附属中学2017-2018学年高二上学期第五次学分认定(期中)考试(理)化学试题【全国百强校】山西省平遥中学2018-2019学年高二上学期期中考试化学试题【校级联考】天津市静海区2019届高三上学期12月四校联考化学试题(已下线)第10单元 化学反应速率与化学平衡(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷吉林省辽源市田家炳高级中学校2020-2021学年高二上学期期中考试化学试题浙江省浙北G2(嘉兴一中、湖州中学)2020-2021学年高二上学期期中联考化学试题广东省广州市协和中学等3校2022-2023学年高二上学期(12月)期末考试化学试题上海市上海中学2022-2023学年高一下学期期末考试化学试题广东省汕头市潮阳黄图盛中学2023-2024学年高二上学期期中考试化学试题
7 . 随着新能源汽车销量的猛增,动力电池退役高峰将至,磷酸铁锂(LFP)是目前使用最多的动力电池材料,因此回收磷酸铁锂具有重要意义。一种从废旧磷酸铁锂正极片( LiFePO4、导电石墨、铝箔)中回收锂的工艺流程如图:
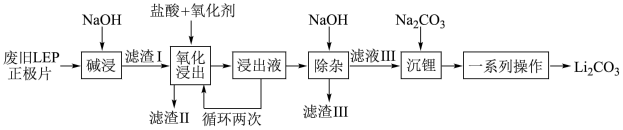
已知:Li2CO3在水中的溶解度随温度升高而降低,但煮沸时发生水解。回答下列问题:
(1)在“碱浸”时,为加快浸出速率,下列措施不可行的是_______ (填标号)。
a.适当提高浸出温度
b.使用电动搅拌器
c.适当提高氢氧化钠的浓度
d.增大废料的颗粒
(2)“氧化浸出”时,保持其他条件不变,不同氧化剂对锂的浸出实验结果如表,实际生产中氧化剂选用H2O2,不选用 NaClO3的原因是______ 。在“氧化浸出”时,温度不宜超过50℃,其目的是________ 。“氧化浸出”时生成了难溶的FePO4,该反应的离子方程式为_________ 。
(3)“浸出液”循环两次的目的是________ 。
(4)“沉锂”的温度保持在95℃,最适宜的加热方式为________ 。“一系列操作”具体包括______ 、洗涤、干燥。
(5)“滤渣Ⅱ”经纯化可得FePO4,流程中生成的Li2CO3、FePO4在高温条件下与H2C2O4煅烧可得 LiFePO4,实现再生利用,其化学方程式为_________ 。

已知:Li2CO3在水中的溶解度随温度升高而降低,但煮沸时发生水解。回答下列问题:
(1)在“碱浸”时,为加快浸出速率,下列措施不可行的是
a.适当提高浸出温度
b.使用电动搅拌器
c.适当提高氢氧化钠的浓度
d.增大废料的颗粒
(2)“氧化浸出”时,保持其他条件不变,不同氧化剂对锂的浸出实验结果如表,实际生产中氧化剂选用H2O2,不选用 NaClO3的原因是
| 序号 | 锂含量/% | 氧化剂 | pH | 浸出液体Li浓度/(g·L-1) | 浸出渣中Li含量/% |
| 1 | 3.7 | H2O2 | 3.5 | 9.02 | 0.10 |
| 2 | 3.7 | NaClO3 | 3.5 | 9.05 | 0.08 |
| 3 | 3.7 | O2 | 3.5 | 7.05 | 0.93 |
| 4 | 3.7 | NaClO | 3.5 | 8.24 | 0.43 |
(4)“沉锂”的温度保持在95℃,最适宜的加热方式为
(5)“滤渣Ⅱ”经纯化可得FePO4,流程中生成的Li2CO3、FePO4在高温条件下与H2C2O4煅烧可得 LiFePO4,实现再生利用,其化学方程式为
您最近一年使用:0次
2020-11-02更新
|
509次组卷
|
3卷引用:宁夏银川一中2021届高三第三次月考理综化学试题
名校
8 . 自然界中时刻存在着氮的转化。实现氮气按照一定方向转化一直是科学领域研究的重要课题,如图为N2分子在催化剂的作用下发生的一系列转化示意图。下列叙述正确的是
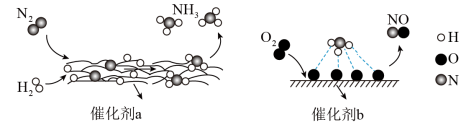

| A.N2→NH3,NH3→NO均属于氮的固定 |
| B.在催化剂b作用下,O2发生了氧化反应 |
| C.使用催化剂a、b均可以提高单位时间内生成物的产量 |
| D.催化剂a、b表面均发生了极性共价键的断裂 |
您最近一年使用:0次
2020-10-31更新
|
762次组卷
|
14卷引用:宁夏回族自治区固原市第一中学2021届高三上学期第四次月考理综化学试题
宁夏回族自治区固原市第一中学2021届高三上学期第四次月考理综化学试题湖南省浏阳一中、株洲二中等湘东七校2020届高三12月联考化学试题江西省南昌市安义中学2020届高三上学期第五次月考化学试题安徽省蚌埠市2021届高三上学期第一次质量监测化学试题黑龙江省大庆中学2021届高三10月月考化学试题河南省三门峡市2021届高三10月阶段性考试化学试题黑龙江省哈尔滨市第一中学校2021-2022学年高三上学期第一次月考化学试题安徽师范大学附属中学2021-2022学年高三上学期11月考试化学试题福建省仙游第一中学、福州八中2020届高三上学期第三次质检(期中)考试化学试题湖南省永州市2020届高三第二次模拟考试理科综合化学试题山东省泰安市肥城市2020届高三适应性训练(一)化学试题(已下线)第12讲 氮及其化合物-2021年高考化学一轮复习名师精讲练广东省惠州市2021届高三上学期第一次调研考试化学试题(已下线)热点10 新信息反应机理分析-2021年高考化学专练【热点·重点·难点】
9-10高一下·浙江宁波·期末
名校
解题方法
9 . 反应C(s)+H2O(g) CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变能增大反应速率的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变能增大反应速率的是( )
 CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变能增大反应速率的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变能增大反应速率的是( )| A.增加C的量 |
| B.将容器的体积缩小一半 |
| C.保持体积不变,充入N2使体系压强增大 |
| D.保持压强不变,充入N2使容器体积变大 |
您最近一年使用:0次
2020-10-18更新
|
681次组卷
|
40卷引用:宁夏回族自治区青铜峡市高级中学2020-2021学年高二上学期第一次月考化学试题
宁夏回族自治区青铜峡市高级中学2020-2021学年高二上学期第一次月考化学试题2015-2016学年河南省信阳高中高二上学期第一次月考化学试卷2015-2016学年宁夏育才中学高二上学期期中测试化学试卷2016-2017学年广东实验中学顺德学校高二上阶段质检化学试卷山东省烟台市第二中学2016-2017学年高一6月月考化学试题1山东省烟台市第二中学2016-2017学年高一6月月考化学试题2河南省鹤壁市淇滨高级中学2017-2018学年高二上学期第一次月考化学试题黑龙江省饶河县高级中学2017-2018学年高二上学期第一次月考化学试题山东省昌乐第一中学2017-2018学年高一下学期第一次月考化学试题山西省汾阳市第二高级中学2018-2019学年高二上学期第二次半月考化学试题四川省遂宁市遂宁中学外国语实验学校2018-2019学年高二上学期第二学段考试化学试题北京市清华附中2019-2020学年高一下学期居家自主学习在线检测化学试题河北省秦皇岛市卢龙县中学2019-2020学年高一下学期第二次调研考试化学试题贵州省思南中学2020-2021学年高二上学期第一次月考化学试题贵州省遵义市航天高级中学2020-2021学年高二上学期第一次月考化学(理)试题海南儋州市第一中学2020-2021学年高二上学期第一次月考化学试题湖南省湘阴县知源学校2020-2021学年高二上学期9月月考化学试题安徽省灵璧县第一中学2020-2021学年高一下学期5月月考化学试题宁夏青铜峡市高级中学2021-2022学年高二下学期开学考试化学试题河北省保定市博野中学2021-2022学年高二上学期12月月考化学试题北京市顺义区第一中学2022-2023学年高二上学期10月月考化学试题安徽省六安市舒城晓天中学2023-2024学年高二上学期第一次月考化学试题(已下线)09-10学年宁波市高一下学期期末化学卷2015-2016学年山西省怀仁一中高一下期中化学试卷山东省潍坊市2016-2017学年高一下学期期中考试化学试题河北省正定中学2016-2017学年高一下学期期末考试化学试题安徽省阜阳市第三中学2018-2019学年高二下学期开学考试化学试题【全国百强校】山东省济南市外国语学校三箭分校2018-2019学年高一下学期期中考试化学试题云南省施甸县县第二完全中学2018-2019学年高二下学期期末考试化学试题安徽省合肥市2019—2020学年高二下学期期中考试化学试题广东省潮州市潮安区2019-2020学年高一下学期期末考试化学试题广东省潮州市2019-2020学年高一下学期期末考试化学试题(已下线)第二章 化学反应速率和化学平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版选修4)(已下线)第2章 章末检测-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 易错疑难集训(一)贵州省北师大遵义附属高级中学2020-2021学年高二上学期期中考试化学试题山东省德州市第一中学2020-2021学年高二上学期期中检测化学试题江苏省南通市海门实验学校2019-2020学年高一下学期期中考试化学试题第2课时 影响化学反应速率的因素陕西省西安市蓝田县部分学校联考2023-2024学年高二上学期11月期中化学试题
名校
解题方法
10 . 对于可逆反应:2A(g)+B(g) 2C(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是
2C(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是
 2C(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是
2C(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是| A.增大压强 | B.升高温度 | C.使用催化剂 | D.多充入A |
您最近一年使用:0次
2020-10-17更新
|
340次组卷
|
22卷引用:宁夏银川市景博中学2021-2022学年高二上学期第二次月考化学试题
宁夏银川市景博中学2021-2022学年高二上学期第二次月考化学试题新疆博尔塔拉蒙古自治州第五师高级中学2019-2020学年高二上学期第二次月考化学试题河南省洛阳市豫西名校2020-2021学年高二上学期第一次联考化学试题辽宁省沈阳市法库县高级中学2020-2021学年高二9月月考化学试题黑龙江省哈尔滨市宾县第一中学2020-2021学年高二上学期第二次月考化学试题湖北省黄冈麻城市第二中学2021届高三上学期第一次质量检测化学试题湖北省咸宁市通城二中2020-2021学年高二上学期10月月考化学试题山东省潍坊市临朐县实验中学2021-2022学年高二上学期9月月考化学试题山西省长治市上党区一中2021-2022学年高二上学期10月月考化学试题陕西省西安市雁塔区第二中学2021-2022学年高二上学期第一次月考化学试题四川省雅安市2019-2020学年高二上学期期末检测化学试题四川省广安市岳池县第一中学2019-2020学年高二下学期入学考试化学试题鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 章末综合检测卷吉林省汪清县第六中学2020-2021学年高二上学期期中考试化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 素养拓展区 过综合福建省南平市高级中学2020-2021学年高二上学期期中考试化学(选考)试题四川省苍溪实验中学校2020-2021学年高二上学期期中质量检测化学试题甘肃省兰州市第一中学2020-2021学年高二上学期期末考试化学试题新疆阿勒泰地区2020-2021学年高二上学期期末考试化学试题黑龙江省鹤岗市绥滨县第一中学2020-2021学年高二上学期期中考试化学(理)试题黑龙江省齐齐哈尔市第十六中学2021-2022学年高二上学期期中考试化学(理)试题湖南省衡阳县第四中学2023-2024年高二上学期期中考试化学B卷



