名校
1 . 少量铁片与100mL 0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变 的产量,可以使用如下方法中的
的产量,可以使用如下方法中的
①加 ②加
②加 溶液 ③滴入几滴浓盐酸 ④加入少量铁粉 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改为足量的浓盐酸
溶液 ③滴入几滴浓盐酸 ④加入少量铁粉 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改为足量的浓盐酸
 的产量,可以使用如下方法中的
的产量,可以使用如下方法中的 ①加
 ②加
②加 溶液 ③滴入几滴浓盐酸 ④加入少量铁粉 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改为足量的浓盐酸
溶液 ③滴入几滴浓盐酸 ④加入少量铁粉 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改为足量的浓盐酸| A.①⑥⑦ | B.③⑤⑧ | C.③⑦⑧ | D.③④⑥⑦⑧ |
您最近一年使用:0次
名校
2 . 某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)实验室中现有Na2SO3、MgSO4、Ag2SO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是_______ ;
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中: V9=_______ ;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_______ 。
(3)一定量的锌粉和6mol·L-1的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2的总量的是
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓硫酸
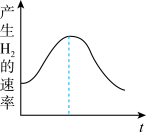
(4)把锌片投入盛有盐酸的敞口容器中,产生氢气的速率变化曲线如图所示,刚开始反应速率增大的原因是_______ ,后反应速率又减小的原因是_______ 。(填正确选项前的序号)
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
(1)实验室中现有Na2SO3、MgSO4、Ag2SO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验/混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
(3)一定量的锌粉和6mol·L-1的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2的总量的是
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓硫酸
| A.①②④ | B.①③⑤ | C.③④⑤ | D.①③④ |
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度

您最近一年使用:0次
名校
3 . Ⅰ 氮及其化合物的转化过程如图1所示,其中图2为反应①过程中能量变化的曲线图。
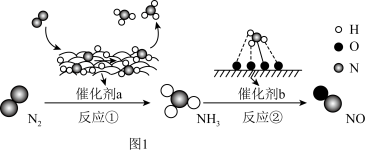
(1)图2中曲线_______ (填字母)是加入催化剂a时的能量变化曲线,该反应破坏生成物全部化学键所需要的总能量_______ (填“大于”或“小于”或“等于”)破坏反应物全部化学键所需要的总能量

(2)标准状况下进行反应②,若有1.25mol电子发生转移,则参加反应的NH3的体积为_______
(3)下列说法正确的是
Ⅱ.以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径

(4)请写出CO2的电子式_______ ,该反应的机理及各分子化学键完全断裂时的能量变化如图所示,根据数据计算,分解1molCO2需_______ (填“吸收”或“放出”) _______ kJ的能量。


(1)图2中曲线

(2)标准状况下进行反应②,若有1.25mol电子发生转移,则参加反应的NH3的体积为
(3)下列说法正确的是
| A.合成氨在工业生产中常将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B.工业合成氨中,为加快化学反应速率,压强和温度越高越好 |
| C.合成氨工业要用合适的催化剂,目的是降低该反应的活化能 |
| D.工业合成氨中反应物不能百分之百转化为生成物 |
Ⅱ.以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径

(4)请写出CO2的电子式

您最近一年使用:0次
名校
解题方法
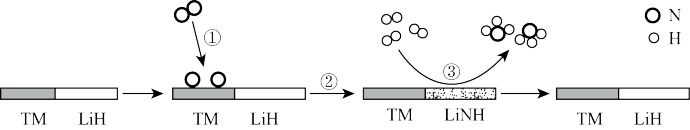
4 . 20世纪初,德国化学家哈伯在实验室首次利用氯气和氢气合成了氨:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ·mol-1,从此人类进入了新的农业时代,化肥的使用大大提高了粮食产量。双催化剂“TM—LiH(TM表示过渡金属)”催化合成氨反应的原理示意如图:
2NH3(g) △H=-92.4kJ·mol-1,从此人类进入了新的农业时代,化肥的使用大大提高了粮食产量。双催化剂“TM—LiH(TM表示过渡金属)”催化合成氨反应的原理示意如图:
下列说法正确的是
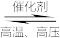 2NH3(g) △H=-92.4kJ·mol-1,从此人类进入了新的农业时代,化肥的使用大大提高了粮食产量。双催化剂“TM—LiH(TM表示过渡金属)”催化合成氨反应的原理示意如图:
2NH3(g) △H=-92.4kJ·mol-1,从此人类进入了新的农业时代,化肥的使用大大提高了粮食产量。双催化剂“TM—LiH(TM表示过渡金属)”催化合成氨反应的原理示意如图:
下列说法正确的是
| A.过程①中,N2分子断键变成N原子会释放能量 |
| B.当1molN2参与反应,过程②中生成1molLiNH |
| C.过程③中,没有化学键的断裂,只有化学键的形成 |
| D.双催化剂“TM—LiH”能加快合成氨反应的速率 |
您最近一年使用:0次
2022-04-22更新
|
182次组卷
|
2卷引用:宁夏石嘴山市平罗中学2021-2022学年高一下学期期中考试化学试题
名校
解题方法
5 . 已知分解1mol H2O2放出热量98kJ,在含少量I-的溶液中,H2O2的分解机理为:
H2O2+I-→H2O+IO-慢
H2O2+IO-→H2O+O2+I-快
下列说法正确的是
H2O2+I-→H2O+IO-慢
H2O2+IO-→H2O+O2+I-快
下列说法正确的是
| A.该反应的速率与I-的浓度有关 |
| B.IO-也是该反应的催化剂 |
| C.总反应中反应物的总能量小于生成物的总能量 |
| D.在相同时间内:v(H2O2)=v(H2O)=v(O2) |
您最近一年使用:0次
2022-04-22更新
|
203次组卷
|
3卷引用:宁夏石嘴山市平罗中学2021-2022学年高一下学期期中考试化学试题
宁夏石嘴山市平罗中学2021-2022学年高一下学期期中考试化学试题浙江省七彩阳光新高考研究联盟2021-2022学年高一下学期期中联考化学试题(已下线)【2023】【高一下】【期中考】【杭九】【高中化学】【赵燕丽收集】
12-13高一下·宁夏·期中
名校
解题方法
6 . 反应:C(s)+H2O(g)⇋CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
| A.增加C的量 | B.将容器的体积缩小一半 |
| C.保持体积不变,通入H2O(g) | D.保持压强不变,充入N2使容器体积增大 |
您最近一年使用:0次
2022-01-08更新
|
1010次组卷
|
27卷引用:2012-2013学年宁夏育才中学高一下学期期中考试化学试卷
(已下线)2012-2013学年宁夏育才中学高一下学期期中考试化学试卷2015-2016学年福建省仙游一中高二上期中测试化学试卷新疆阿瓦提县第四中学2019-2020学年高二上学期期中考试化学试卷广西壮族自治区桂林市逸仙中学2019-2020学年高二上学期期中考试(二)化学试题甘肃省兰州市第四片区2020-2021学年高二上学期期中考试化学(理)试题四川省乐山市峨眉第二中学2022-2023学年高二上学期期中考试化学试题山西省阳泉市第一中学校2022-2023学年高一下学期期中考试化学试题上海市杨浦高级中学2023-2024学年高一下学期期中质量调研 化学学科试卷 天津市第四十三中学2023-2024学年高一下学期阶段性质量检测 化学试卷 (已下线)2014年高二化学人教版选修四 6影响化学反应速率的因素练习卷2016届广东省广州六中等六校高三第一次联考化学试卷(已下线)第17天 对化学反应速率的理解——《2019年暑假作业总动员》高二化学贵州省毕节金沙县二中2018-2019学年高一下学期期末考试化学试题人教版高中化学必修2第二章《化学反应与能量》测试卷1北京市通州区2019-2020学年高二下学期期末考试化学试题河北省石家庄市第二中学2019-2020学年高一下学期期末考试化学试题广东省梅州市2020-2021学年高二上学期第二次质检考试化学试题高中化学苏教2019版必修第二册-专题6 第一单元综合拔高练贵州省龙里县九八五实验学校2020-2021学年高二上学期1月月考化学试题甘肃省兰州市教育局第四片区2021-2022学年高二上学期期末考试化学(理)试题第二章 本章复习提升3(已下线)2.1.2 化学反应速率的影响因素——同步学习必备知识山西师范大学实验中学2021-2022学年高一下学期第二次月考化学试题甘肃省酒泉市玉门油田第一中学2022-2023学年高二上学期10月月考化学试题四川省凉山宁南中学2020-2021学年高一下学期第二次月考化学试题(已下线)化学反应速率与化学平衡——进阶学习作业(十二) 压强对化学平衡的影响 勒·夏特列原理
名校
解题方法
7 . 化学反应的速率和限度对人类生产生活有重要的意义。
(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响,设计实验如表(所取溶液体积均为2mL):
①上述实验中溶液最先变浑浊的是___________ (填实验编号,下同)。
②控制变量是科学研究的重要方法,为探究浓度对化学反应速率的影响,应选择___________
(2)在10 L的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
请回答:
①该反应的化学平衡常数表达式为K =___________ 。
②该反应为___________ (填“吸热”或“放热”)反应。
③能说明该反应达到化学平衡状态的是___________ (填字母)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
④某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为___________ ℃。
(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响,设计实验如表(所取溶液体积均为2mL):
| 实验编号 | 温度/℃ | c(Na2S2O3)/mol·L-1 | c(H2SO4)/mol·L-1 |
| Ⅰ | 25 | 0.1 | 0.1 |
| Ⅱ | 25 | 0.2 | 0.1 |
| Ⅲ | 50 | 0.2 | 0.1 |
①上述实验中溶液最先变浑浊的是
②控制变量是科学研究的重要方法,为探究浓度对化学反应速率的影响,应选择
(2)在10 L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答:
①该反应的化学平衡常数表达式为K =
②该反应为
③能说明该反应达到化学平衡状态的是
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
④某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
您最近一年使用:0次
名校
8 . 某温度下,CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K=1,该温度下在体积均为1L的甲、乙两个恒容密闭容器中,投入CO(g)和H2O(g)的起始浓度及5min时的浓度如表所示。
CO2(g)+H2(g)的平衡常数K=1,该温度下在体积均为1L的甲、乙两个恒容密闭容器中,投入CO(g)和H2O(g)的起始浓度及5min时的浓度如表所示。
下列判断不正确的是
 CO2(g)+H2(g)的平衡常数K=1,该温度下在体积均为1L的甲、乙两个恒容密闭容器中,投入CO(g)和H2O(g)的起始浓度及5min时的浓度如表所示。
CO2(g)+H2(g)的平衡常数K=1,该温度下在体积均为1L的甲、乙两个恒容密闭容器中,投入CO(g)和H2O(g)的起始浓度及5min时的浓度如表所示。| 甲 | 乙 | |||
| 起始浓度 | 5min时浓度 | 起始浓度 | 5min时浓度 | |
| c(CO)/mol/L | 0.1 | 0.08 | 0.2 | x |
| c(H2O)/mol/L | 0.1 | 0.08 | 0.2 | y |
| A.甲中0-5min平均反应速率v(CO)=0.004mol•L-1•min-1 |
| B.反应开始时,乙中反应速率快 |
| C.x=y=0.16 |
| D.平衡时,乙中的转化率是50% |
您最近一年使用:0次
2021-12-04更新
|
124次组卷
|
3卷引用:宁夏银川一中2021-2022学年高二上学期期中考试化学试题
9-10高一下·河南郑州·期末
名校
解题方法
9 . 200 mL浓度为1 mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的量,可采用的方法是
| A.加入适量的6 mol/L的盐酸 | B.加入数滴氯化铜溶液 |
| C.加入适量蒸馏水 | D.加入适量的氯化钠溶液 |
您最近一年使用:0次
2021-12-04更新
|
235次组卷
|
64卷引用:宁夏青铜峡市高级中学2019-2020学年高二上学期期中考试化学试题
宁夏青铜峡市高级中学2019-2020学年高二上学期期中考试化学试题宁夏青铜峡市高级中学2021-2022学年高二上学期期中考试化学试题(已下线)2010—2011浙江省嘉兴一中高一下学期期中考试化学试卷(已下线)2011-2012年云南省建水一中高二上学期期中考试化学(理)试题(已下线)2011-2012学年山东省日照一中高二上学期期中考试化学(理)试卷(已下线)2011-2012学年辽宁省东北育才学校高一下学期期中考试化学试卷(已下线)2011-2012学年四川省资阳中学高一下半期考试化学试卷(已下线)2011-2012学年河北省保定三中高二上学期期中考试文科化学试卷(已下线)2013-2014学年江苏省响水中学高二上学期期中考试化学试卷(选修)(已下线)2013-2014学年浙江省温州市十校联合体高一下学期期中联考化学试卷2016届贵州省习水县第一中学高三下学期期中化学试卷【全国百强校】黑龙江省双鸭山市第一中学2018-2019学年高一下学期期中考试化学试题【全国百强校】内蒙古北方重工业集团有限公司第三中学2018-2019学年高一下学期期中考试化学试题安徽省蚌埠铁路中学2019-2020学年高二上学期期中考试化学试题广东省广州市2019-2020学年高二上学期期中模拟测试化学试题(二)浙江省宁波市咸祥中学2019-2020学年高一下学期期中考试化学试题上海市金山中学2019-2020学年高一下学期期中考试化学试题山东省济宁市泗水县2019-2020学年高二上学期期中考试化学试题甘肃省张掖市第二中学2020-2021学年高二上学期期中考试化学试题新疆哈密市第八中学2019-2020学年高一下学期期中考试化学试题陕西省宝鸡市陈仓区2020-2021学年高一下学期期中考试化学试题陕西省宝鸡市陈仓区2021-2022学年高一下学期期中考试化学试题 陕西省咸阳市武功县2021--2022学年高二上学期质量调研化学试题甘肃省民勤县第四中学2021-2022学年高二上学期期中考试化学试题陕西省渭南市杜桥中学2023-2024学年高二上学期期中考试化学试卷 (已下线)2010年郑州市智林学校高一下学期期末考试化学试题(已下线)2010-2011学年山西省临汾一中高二上学期期末考试化学试卷(已下线)2011-2012学年内蒙古巴彦淖尔市中学巴市一中高二上学期12月月考化学试卷(已下线)2012年苏教版高中化学选修4 1.2化学能与电能的转化(已下线)2012-2013学年福建省晋江市养正中学高二下学期第一次月考化学试卷2014-2015学年福建省清流一中高二上学期月考化学理试卷2014-2015学年河北省成安县第一中学高一6月月考化学试卷2015-2016学年安徽省亳州市高二上学期期末质检化学试卷2015-2016学年湖北市宜昌夷陵中学高一5月月考化学试卷2016-2017学年吉林省长春实验中学高二上9月月考化学卷2016-2017学年贵州省思南中学高二上半期考试化学卷【全国百强校】重庆市第八中学2017-2018学年高一下学期期末考试化学试题吉林省扶余市第一中学2017-2018学年高一下学期期末考试化学试题【校级联考】吉林省辽源市田家炳高级中学(第六十六届友好学校)2018-2019学年高二上学期期末联考化学试题(已下线)2019年3月24日 《每日一题》 必修2 每周一测山东省惠民县第一中学2018-2019学年高一下学期联考化学试题河北省黄骅中学2018-2019学年高一下学期第二次月考化学试题安徽省滁州市六校2019-2020学年高二12月联考化学试题2020届高三化学化学二轮复习——原电池【精编选择24题】河北省邯郸市第一中学2019—2020学年高一4月月考化学试题贵州省铜仁第一中学2019-2020学年高一下学期第七次周测化学试题河北省石家庄市元氏县第四中学2019-2020学年高一下学期月考化学试题黑龙江省鸡西市鸡东县第二中学2019-2020学年高一下学期期末考试化学试题云南省云天化中学、下关一中2021届高三复习备考联合质量检测卷(一) 化学试题河南省驻马店市正阳县高级中学2020-2021学年高二上学期第一次月考化学试题北京市北大附中实验学校2020-2021学年高二上学期10月月考化学试题吉林省长春市第一五一中学2020-2021学年高二上学期第一次月考化学试题(希望班)北京市理工大学附属中学2020-2021学年高二上学期10月月考化学试题黑龙江省哈尔滨市第三十二中学2020-2021学年高二上学期期末考试化学试题江苏省泗洪县洪翔中学2019-2020学年高一下学期6月月考化学试题河南省豫南九校2020-2021学年高二上学期第四次联考化学试题新疆维吾尔自治区呼图壁县第一中学2020-2021学年高二上学期期末考试化学试题江苏省沭阳县修远中学2020-2021学年高二下学期第一次联考化学试题湖南省长沙市第一中学2020-2021学年高一下学期第一次月考化学试题(已下线)1.2.1 原电池的工作原理(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)(已下线)第14讲 原电池-2020-2021学年秋季班高一上学期化学教材知识点精讲练(沪科版)海南省海口市第四中学2021-2022学年高二上学期第一次月考化学试题5.3.2 化学变化中的能量变化(第2课时)-【帮课堂】高一化学同步精品讲义(沪科版2020必修第二册)海南省海口市第一中学2023-2024学年高二上学期期末考试化学试题(非重点班)
名校
解题方法
10 . 某同学探究外界条件对H2O2分解速率的影响实验所用试剂:0.4mol·L-1H2O2溶液、蒸馏水、MnO2粉末、Fe2O3粉。
(1)实验1、2的目的是其他条件相同时,研究___________ 对H2O2分解速率的影响。
(2)表中a处所用试剂为___________ 。对比实验3、4可得出的结论是___________ 。
(3)实验3、5是其他条件相同时,探究浓度对该化学反应速率的影响。b处取用10mL0.4mol·L-1H2O2溶液,还应添加的试剂及用量为___________ 。
(4)控制其他条件相同,印刷电路板的金属粉末用0.4mol·L-1H2O2溶液和3.0mol·L-1 H2SO4溶液处理。
①请配平方程式:___________
___________Cu+___________H2O2+___________H+=___________Cu2++___________H2O
②某同学在不同温度下完成该实验,测得铜的平均溶解速率分别为:
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是:___________ 。
实验序号 | H2O2浓度(mol·L-1) | v(H2O2溶液)(mL) | 温度 | 催化剂 | 收集112mLO2所需时间(s) |
1 | 0.4 | 20 | 室温 | 无 | 几乎无气体产生 |
2 | 0.4 | 20 | 50℃水浴 | 无 | 296 |
3 | 0.4 | 20 | 室温 | 0.5g a | 45 |
4 | 0.4 | 20 | 室温 | 0.5gMnO2粉末 | 100 |
5 | 0.4 | b | 室温 | a | >45 |
(2)表中a处所用试剂为
(3)实验3、5是其他条件相同时,探究浓度对该化学反应速率的影响。b处取用10mL0.4mol·L-1H2O2溶液,还应添加的试剂及用量为
(4)控制其他条件相同,印刷电路板的金属粉末用0.4mol·L-1H2O2溶液和3.0mol·L-1 H2SO4溶液处理。
①请配平方程式:
___________Cu+___________H2O2+___________H+=___________Cu2++___________H2O
②某同学在不同温度下完成该实验,测得铜的平均溶解速率分别为:
温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜的平均溶解速率( | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
您最近一年使用:0次
2021-12-02更新
|
184次组卷
|
7卷引用:宁夏六盘山高级中学2021-2022学年高二上学期期中考试化学试题
宁夏六盘山高级中学2021-2022学年高二上学期期中考试化学试题北京市丰台区2020-2021学年高一下学期期中联考化学(A卷)试题安徽省黄山市屯溪第一中学2022-2023学年高二上学期期中质量检测(选择性考试) 化学试题(已下线)作业03 化学反应速率-2021年高二化学暑假作业(人教版2019)(已下线)2.2 影响化学反应速率的因素-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)第2章 化学反应速率和化学平衡(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)(已下线)2.1.2 影响化学反应速率的因素(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)

 )
)

