1 . 氮氧化物( 、
、 等)的处理和资源化利用具有重要意义。
等)的处理和资源化利用具有重要意义。
(1) 的处理。研究证明:
的处理。研究证明: 能提高
能提高 的分解速率,
的分解速率, 参与了第Ⅱ步、第Ⅲ步反应。反应历程(
参与了第Ⅱ步、第Ⅲ步反应。反应历程( 为反应活化能):
为反应活化能):
第Ⅰ步:
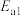
第Ⅱ步:……
第Ⅲ步: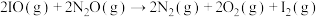
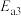
①第Ⅱ步发生反应的方程式为___________ 。
②总反应的反应速率取决于第Ⅱ步,则
___________ 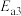 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2) 的应用。
的应用。 分解
分解 制取
制取 和
和 的原理如下:
的原理如下:
反应Ⅰ:

反应Ⅱ: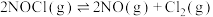

反应的 (
( 值为平衡时用各气体的分压表示得出的值)的关系如图-1所示。
值为平衡时用各气体的分压表示得出的值)的关系如图-1所示。

①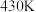 时,反应
时,反应 的
的 为
为___________ 。
② 时,向容积不变的容器中充入
时,向容积不变的容器中充入 和
和 进行反应,测得反应过程中容器内压强与时间的关系如图-2所示(反应开始和平衡后容器的温度相同)。在
进行反应,测得反应过程中容器内压强与时间的关系如图-2所示(反应开始和平衡后容器的温度相同)。在 时间段内,容器中压强增大的主要原因是
时间段内,容器中压强增大的主要原因是___________ 。

(3)催化电解 吸收液可将
吸收液可将 还原为
还原为 ,其催化机理如图-3所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(
,其催化机理如图-3所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率( )随电解电压的变化如图-4所示。已知
)随电解电压的变化如图-4所示。已知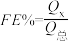 ,
,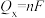 ,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数;
,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数; 表示电解过程中通过的总电量。
表示电解过程中通过的总电量。
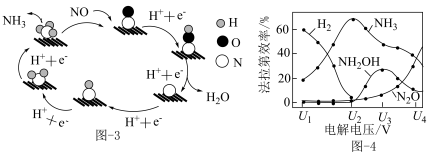
①当电解电压为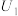 时,电解生成的
时,电解生成的 和
和 的物质的量之比为
的物质的量之比为___________ 。
②当电解电压为 时,催化电解
时,催化电解 生成
生成 的电极反应式为
的电极反应式为___________ 。
③电解电压大于 后,随着电解电压的不断增大,
后,随着电解电压的不断增大, 的法拉第效率迅速增大,可能原因是
的法拉第效率迅速增大,可能原因是___________ (吸附在催化剂上的物种加“*”表示,如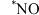 、
、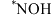 等)。
等)。
 、
、 等)的处理和资源化利用具有重要意义。
等)的处理和资源化利用具有重要意义。(1)
 的处理。研究证明:
的处理。研究证明: 能提高
能提高 的分解速率,
的分解速率, 参与了第Ⅱ步、第Ⅲ步反应。反应历程(
参与了第Ⅱ步、第Ⅲ步反应。反应历程( 为反应活化能):
为反应活化能):第Ⅰ步:

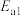
第Ⅱ步:……

第Ⅲ步:
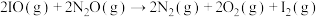
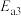
①第Ⅱ步发生反应的方程式为
②总反应的反应速率取决于第Ⅱ步,则

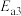 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(2)
 的应用。
的应用。 分解
分解 制取
制取 和
和 的原理如下:
的原理如下:反应Ⅰ:


反应Ⅱ:
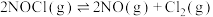

反应的
 (
( 值为平衡时用各气体的分压表示得出的值)的关系如图-1所示。
值为平衡时用各气体的分压表示得出的值)的关系如图-1所示。
①
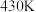 时,反应
时,反应 的
的 为
为②
 时,向容积不变的容器中充入
时,向容积不变的容器中充入 和
和 进行反应,测得反应过程中容器内压强与时间的关系如图-2所示(反应开始和平衡后容器的温度相同)。在
进行反应,测得反应过程中容器内压强与时间的关系如图-2所示(反应开始和平衡后容器的温度相同)。在 时间段内,容器中压强增大的主要原因是
时间段内,容器中压强增大的主要原因是
(3)催化电解
 吸收液可将
吸收液可将 还原为
还原为 ,其催化机理如图-3所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(
,其催化机理如图-3所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率( )随电解电压的变化如图-4所示。已知
)随电解电压的变化如图-4所示。已知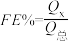 ,
,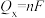 ,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数;
,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数;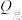 表示电解过程中通过的总电量。
表示电解过程中通过的总电量。
①当电解电压为
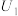 时,电解生成的
时,电解生成的 和
和 的物质的量之比为
的物质的量之比为②当电解电压为
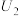 时,催化电解
时,催化电解 生成
生成 的电极反应式为
的电极反应式为③电解电压大于
 后,随着电解电压的不断增大,
后,随着电解电压的不断增大, 的法拉第效率迅速增大,可能原因是
的法拉第效率迅速增大,可能原因是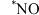 、
、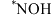 等)。
等)。
您最近一年使用:0次
名校
解题方法
2 . 基于非金属原子嵌入石墨烯三嗪基 中,用于催化一氧化碳加氢生成甲醇的反应历程如图,其中吸附在催化剂表面上的物种用“
中,用于催化一氧化碳加氢生成甲醇的反应历程如图,其中吸附在催化剂表面上的物种用“ ”标注,下列说法中错误的是
”标注,下列说法中错误的是
 中,用于催化一氧化碳加氢生成甲醇的反应历程如图,其中吸附在催化剂表面上的物种用“
中,用于催化一氧化碳加氢生成甲醇的反应历程如图,其中吸附在催化剂表面上的物种用“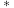 ”标注,下列说法中错误的是
”标注,下列说法中错误的是
| A.整个反应历程中有极性键的断裂和生成 | B.过渡态相对能量:TS55>TS44>TS77 |
| C.物种吸附在催化剂表面的过程为吸热过程 | D.反应决速步的活化能为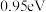 |
您最近一年使用:0次
2024-01-13更新
|
1401次组卷
|
7卷引用:江苏省南京师范大学附属中学2024届高三下学期5月模拟化学试题
江苏省南京师范大学附属中学2024届高三下学期5月模拟化学试题辽宁省沈阳市部分高中2023-2024学年高三上学期教学质量监测(一)化学试题2024届辽宁省沈阳市高三教学质量检测(一模)化学试题(已下线)专题05 化学反应与能量-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)辽宁省沈阳市2024届高三一模化学试题河北省石家庄市河北正定中学2023-2024学年高三下学期4月模拟考试化学试题2024届广东省广州市高三下学期三模化学试卷
名校
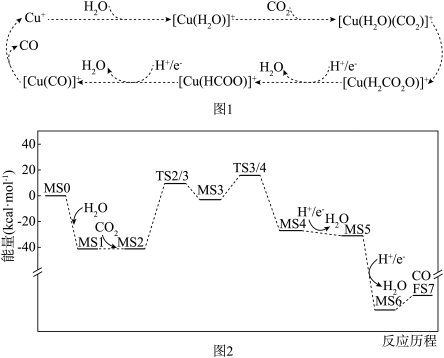
3 . 在 催化剂和水存在下,
催化剂和水存在下, 被还原为CO的反应机理示意图如下:图1为通过实验观察捕获中间体和产物推演出
被还原为CO的反应机理示意图如下:图1为通过实验观察捕获中间体和产物推演出 被还原为CO的反应过程;图2为
被还原为CO的反应过程;图2为 转化为CO反应过程经历的中间体的能垒变化。已知:MS代表反应物或中间产物;TS代表过渡态;FS代表终态产物。下列推断正确的是
转化为CO反应过程经历的中间体的能垒变化。已知:MS代表反应物或中间产物;TS代表过渡态;FS代表终态产物。下列推断正确的是
 催化剂和水存在下,
催化剂和水存在下, 被还原为CO的反应机理示意图如下:图1为通过实验观察捕获中间体和产物推演出
被还原为CO的反应机理示意图如下:图1为通过实验观察捕获中间体和产物推演出 被还原为CO的反应过程;图2为
被还原为CO的反应过程;图2为 转化为CO反应过程经历的中间体的能垒变化。已知:MS代表反应物或中间产物;TS代表过渡态;FS代表终态产物。下列推断正确的是
转化为CO反应过程经历的中间体的能垒变化。已知:MS代表反应物或中间产物;TS代表过渡态;FS代表终态产物。下列推断正确的是
A.由图1可知, 能提高总反应的平衡转化率 能提高总反应的平衡转化率 |
B.图1中, 中存在非极性键 中存在非极性键 |
C.由图2知,各步反应的 都小于0 都小于0 |
D.在图2涉及的反应中, 决定总反应速率 决定总反应速率 |
您最近一年使用:0次
2023-06-08更新
|
410次组卷
|
4卷引用:江苏省淮阴中学2023届高三下学期最后一模化学试题
名校
4 . 酯在碱性条件下发生水解反应的历程如图,下列说法正确的是
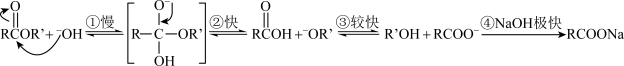
| A.反应④为该反应的决速步 |
B.若用 进行标记,反应结束后醇和羧酸钠中均存在 进行标记,反应结束后醇和羧酸钠中均存在 |
| C.该反应历程中碳原子杂化方式没有发生改变 |
D.反应①中 攻击的位置由碳和氧电负性大小决定 攻击的位置由碳和氧电负性大小决定 |
您最近一年使用:0次
2022-12-17更新
|
724次组卷
|
3卷引用:江苏省靖江市2022-2023学年高三上学期调研测试化学试题
名校
解题方法
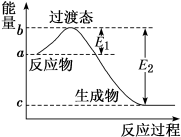
5 . 如图为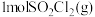 和
和 反应生成
反应生成 过程中的能量变化示意图,已知
过程中的能量变化示意图,已知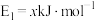 、
、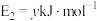 ,下列有关说法中正确的是
,下列有关说法中正确的是
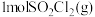 和
和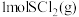 反应生成
反应生成 过程中的能量变化示意图,已知
过程中的能量变化示意图,已知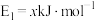 、
、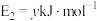 ,下列有关说法中正确的是
,下列有关说法中正确的是
| A.若在反应体系中加入催化剂,E1不变 |
| B.若在反应体系中加入催化剂,△H减小 |
C.反应的活化能等于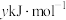 |
D.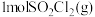 和 和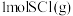 反应生成 反应生成 的 的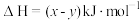 |
您最近一年使用:0次
2022-10-08更新
|
492次组卷
|
10卷引用:2017届江苏省南通市高三高考全真模拟(一)化学试卷
2017届江苏省南通市高三高考全真模拟(一)化学试卷江苏省启东中学2020-2021学年高二上学期期初考试化学试题辽宁省六校协作体2016-2017学年高一下学期期中考试化学试题吉林省延边安图第一中学2016-2017学年高二练习化学试题河北省邢台市第二中学2018届高三上学期第一次月考(开学考试)化学试题陕西省咸阳市武功县普集高中2017-2018学年高二上学期第二次月考(9月)化学试题贵州省思南中学2019-2020学年高二9月月考化学试题四川省阆中中学校2020-2021学年高一(仁智班)下学期第一次月考化学试题天津汇文中学2022-2023学年高二上学期第一次阶段性测试化学试题天津市第二中学2022-2023学年高二上学期期中检测化学试题
2022·江苏·模拟预测
名校
解题方法
6 . 科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(Ⅲ)表面发生解离时四个路径与相对能量关系如图所示,其中附在Pd(Ⅲ)表面的物种用*标注。下列说法错误的是
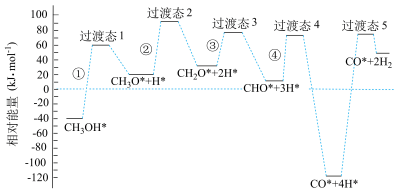
| A.②中包含C—H键的断裂过程 |
| B.该历程中能垒(反应活化能)最小的是③ |
| C.该历程中制约反应速率的方程式为CH3O*+3H*→CO*+4H* |
D.由此历程可知:CH3OH(g) CO(g)+2H2(g) ΔH>0 CO(g)+2H2(g) ΔH>0 |
您最近一年使用:0次
2022-05-13更新
|
945次组卷
|
16卷引用:押江苏卷第14题 反应机理、化学反应速率与平衡 -备战2022年高考化学临考题号押题(江苏卷)
(已下线)押江苏卷第14题 反应机理、化学反应速率与平衡 -备战2022年高考化学临考题号押题(江苏卷)辽宁省抚顺市第二中学2022届高三下学期高考预测化学试题广东省珠海市第二中学2021-2022学年高三下学期3000分第四次考试化学试题(已下线)第22练 新高考模式综合练(辽宁卷)-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)2.1.2 影响化学反应速率的因素 活化能 -2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)湖南省株洲市第八中学2022-2023学年高三上学期第五次月考化学试题湖南省株洲市十三中2022-2023学年高三第五次月考化学试题(已下线)化学反应速率与化学平衡——课时2化学反应速率的影响因素广东省深圳市新安中学2022-2023学年高三上学期周末测试(2022.9.11)化学试题河北省石家庄市第四十二中学2023-2024学年高二上学期第一次月考化学试题新疆乌鲁木齐市高级中学2023-2024学年高二上学期第一次月考化学试题湖北省宜城市第一中学2023-2024学年高二上学期9月月考化学试题宁夏银川市贺兰县第一中学2023-2024学年高二上学期第一阶段考试化学试题辽宁省沈阳市外国语学校2023-2024学年高二10月月考化学试题(已下线)化学反应速率及其影响因素云南省昆明市第三中学2023-2024学年高二下学期4月第二次综合测试化学试题
名校
7 . 我国科学家研究了Fe+循环催化N2O+CO=N2+CO2的反应机理。反应过程中的物种及能量变化如图所示,其中A-F表示反应过程中过渡态物质。下列说法正确的是


| A.基态Fe+的核外电子排布式为[Ar]3d54s2 |
| B.适当升高温度,有利于提高CO和N2O的平衡转化率 |
| C.该条件下,N2O转化为N2的反应速率主要由A→B步骤决定 |
| D.该催化过程中,铁元素的化合价发生了变化 |
您最近一年使用:0次
2022-05-07更新
|
416次组卷
|
4卷引用:江苏省南通泰州等七市2022届高三第三次调研测试化学试题
8 . 工厂烟气(主要污染物SO2、NO)直接排放会造成空气污染,需处理后才能排放。
(1)O3氧化。O3氧化过程中部分反应的能量变化如图所示。
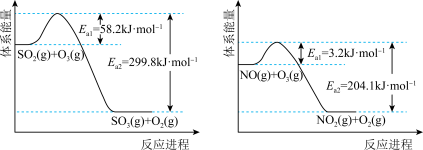
①已知2SO2(g)+O2(g) =2SO3(g) ΔH =−198 kJ·mol−1。则反应2O3(g)=3O2(g)的 ΔH=_______ kJ·mol−1。
②其他条件不变时,增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是_______ 。
(2)NaClO2氧化。40 ℃时向一定量NaClO2溶液中按一定流速持续通入工厂烟气,溶液的pH与ORP值(氧化还原电位)随时间变化如图所示。

①写出NO与ClO 反应的离子方程式:
反应的离子方程式:_______ 。
②烟气中含有少量SO2,能提高NO的脱除率,可能原因是_______ 。
(3)TiO2光催化。主要是利用TiO2光催化剂在紫外线作用下产生的高活性自由基(·OH、·O )和h+(h+代表空位,空位有很强的得电子能力),将烟气中的SO2、NO等氧化除去。TiO2光催化剂粒子表面产生·OH的机理如图所示(图中部分产物略去)。已知TiO2中电子跃迁的能量hv=3.2eV。
)和h+(h+代表空位,空位有很强的得电子能力),将烟气中的SO2、NO等氧化除去。TiO2光催化剂粒子表面产生·OH的机理如图所示(图中部分产物略去)。已知TiO2中电子跃迁的能量hv=3.2eV。
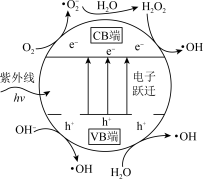
①TiO2光催化剂在紫外线作用下产生·OH的过程可描述为_______ 。
②在TiO2中掺杂一定量的金属离子可提高光催化活性。对所掺杂金属离子的要求是_______ 。
(1)O3氧化。O3氧化过程中部分反应的能量变化如图所示。

①已知2SO2(g)+O2(g) =2SO3(g) ΔH =−198 kJ·mol−1。则反应2O3(g)=3O2(g)的 ΔH=
②其他条件不变时,增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是
(2)NaClO2氧化。40 ℃时向一定量NaClO2溶液中按一定流速持续通入工厂烟气,溶液的pH与ORP值(氧化还原电位)随时间变化如图所示。

①写出NO与ClO
 反应的离子方程式:
反应的离子方程式:②烟气中含有少量SO2,能提高NO的脱除率,可能原因是
(3)TiO2光催化。主要是利用TiO2光催化剂在紫外线作用下产生的高活性自由基(·OH、·O
 )和h+(h+代表空位,空位有很强的得电子能力),将烟气中的SO2、NO等氧化除去。TiO2光催化剂粒子表面产生·OH的机理如图所示(图中部分产物略去)。已知TiO2中电子跃迁的能量hv=3.2eV。
)和h+(h+代表空位,空位有很强的得电子能力),将烟气中的SO2、NO等氧化除去。TiO2光催化剂粒子表面产生·OH的机理如图所示(图中部分产物略去)。已知TiO2中电子跃迁的能量hv=3.2eV。
①TiO2光催化剂在紫外线作用下产生·OH的过程可描述为
②在TiO2中掺杂一定量的金属离子可提高光催化活性。对所掺杂金属离子的要求是
您最近一年使用:0次
2022-04-06更新
|
838次组卷
|
6卷引用:江苏省连云港市2022届高三第二次调研考试化学试题
江苏省连云港市2022届高三第二次调研考试化学试题(已下线)必刷卷03-2022年高考化学考前信息必刷卷(江苏专用)(已下线)必刷卷05-2022年高考化学考前信息必刷卷(江苏专用)(已下线)黄金卷10-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(江苏卷)(已下线)必刷卷02-2022年高考化学考前信息必刷卷(辽宁地区专用)江苏省昆山六校2022~2023学年高三上学期10月联合教学质量调研化学试题
9 . NO的治理是当前生态环境保护中的重要课题之一。
I.电化学技术
(1)利用固体氧化物电解池可将NO直接转化为N2,实际应用中常将若干个电化学还原器结构单元组装在一起,形成电堆,以提高NO的去除效率。
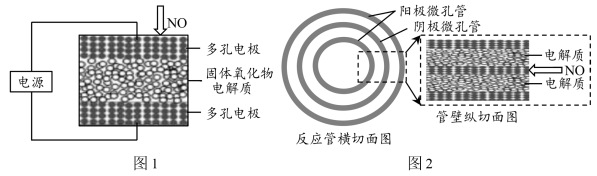
①纽扣式电化学还原器结构单元(其装置如图1所示)可叠加组装成电堆使用。电解时,阴极发生的电极反应式为_______ 。
②长管式电化学还原器结构单元(其剖面结构如图2所示)采用阴极微孔管作支撑,在管内外壁各设置一个对称的阳极微孔管,阴阳极管壁之间填充有固体氧化物电解质,使用时常将该结构单元组装成蜂窝状电堆。当电堆体积一定时,相比于纽扣式反应器,长管式反应器的优点是_______ 。
II.NH3-SCR技术
(2)Cu基催化剂是NH3-SCR技术脱除NO中性能较为优异的新型催化剂,但烟气中的SO2会造成Cu基催化剂的催化性能下降。加入CeO2(基态Ce原子核外电子排布式为[Xe]4f15d16s2)可抑制SO2对Cu基催化剂的影响,其作用机理如图3所示(含Ce化合物的比例系数均未标定)。
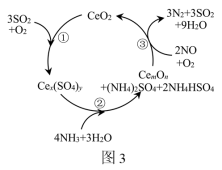
①从整个反应机理来看,总反应中起还原作用的物质是_______ (填化学式)。
②在上述反应机理图中,CemOn的化学式为_______ 。
(3)将3%NO、6%NH3、21%O2和70%N2的混合气体(N2为平衡气)以一定流速通过装有Cu基催化剂的反应器,NO去除率随反应温度的变化曲线如图4所示。
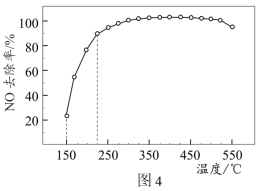
①在150-225°C范围内,NO去除率随温度的升高而迅速上升的原因是_______ 。
②燃煤烟气中伴有一定浓度的HCl气体,它会造成NO去除率下降,其原因可能是_______ 。
I.电化学技术
(1)利用固体氧化物电解池可将NO直接转化为N2,实际应用中常将若干个电化学还原器结构单元组装在一起,形成电堆,以提高NO的去除效率。

①纽扣式电化学还原器结构单元(其装置如图1所示)可叠加组装成电堆使用。电解时,阴极发生的电极反应式为
②长管式电化学还原器结构单元(其剖面结构如图2所示)采用阴极微孔管作支撑,在管内外壁各设置一个对称的阳极微孔管,阴阳极管壁之间填充有固体氧化物电解质,使用时常将该结构单元组装成蜂窝状电堆。当电堆体积一定时,相比于纽扣式反应器,长管式反应器的优点是
II.NH3-SCR技术
(2)Cu基催化剂是NH3-SCR技术脱除NO中性能较为优异的新型催化剂,但烟气中的SO2会造成Cu基催化剂的催化性能下降。加入CeO2(基态Ce原子核外电子排布式为[Xe]4f15d16s2)可抑制SO2对Cu基催化剂的影响,其作用机理如图3所示(含Ce化合物的比例系数均未标定)。

①从整个反应机理来看,总反应中起还原作用的物质是
②在上述反应机理图中,CemOn的化学式为
(3)将3%NO、6%NH3、21%O2和70%N2的混合气体(N2为平衡气)以一定流速通过装有Cu基催化剂的反应器,NO去除率随反应温度的变化曲线如图4所示。

①在150-225°C范围内,NO去除率随温度的升高而迅速上升的原因是
②燃煤烟气中伴有一定浓度的HCl气体,它会造成NO去除率下降,其原因可能是
您最近一年使用:0次
2022-04-02更新
|
1065次组卷
|
5卷引用:江苏省苏锡常镇四市2022届高三下学期教学情况调研(一)化学试题
江苏省苏锡常镇四市2022届高三下学期教学情况调研(一)化学试题(已下线)化学-2022年高考押题预测卷03(江苏卷)(已下线)必刷卷04-2022年高考化学考前信息必刷卷(江苏专用)(已下线)化学-2022年高考考前押题密卷(江苏卷)新疆克孜勒苏柯尔克孜自治州阿合奇县2022-2023学年高三上学期11月期中考试化学试题
解题方法
10 . 氨气是一种重要的化工原料,以氨为原料可以生产化肥和硝酸,在催化剂条件下,氨催化氧化生成NO,进而继续被氧化为NO2,再与水反应生成硝酸,氨气与硝酸反应可得氮肥硝酸铵。4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905.8kJ·mol-1。工业上将含NO2废气通入氢氧化钠溶液中可获得NaNO3和NaNO2,也可向废气中通入NH3在催化剂的条件转化为无毒无害的气体排放。对于反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g) △H=-905.8kJ·mol-1。工业上将含NO2废气通入氢氧化钠溶液中可获得NaNO3和NaNO2,也可向废气中通入NH3在催化剂的条件转化为无毒无害的气体排放。对于反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列说法不正确的是
4NO(g)+6H2O(g),下列说法不正确的是
 4NO(g)+6H2O(g) △H=-905.8kJ·mol-1。工业上将含NO2废气通入氢氧化钠溶液中可获得NaNO3和NaNO2,也可向废气中通入NH3在催化剂的条件转化为无毒无害的气体排放。对于反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g) △H=-905.8kJ·mol-1。工业上将含NO2废气通入氢氧化钠溶液中可获得NaNO3和NaNO2,也可向废气中通入NH3在催化剂的条件转化为无毒无害的气体排放。对于反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列说法不正确的是
4NO(g)+6H2O(g),下列说法不正确的是| A.该反应在高温、低温条件下都能自发进行 |
| B.催化剂的使用能改变反应的活化能但不能降低反应的焓变 |
| C.分离出H2O(g),平衡右移,正反应速率增大 |
| D.1molN—H断裂的同时有1molO—H断裂说明反应到达该条件下的平衡状态 |
您最近一年使用:0次



