 和
和 的催化重整对温室气体的减排具有重要意义,其反应为:
的催化重整对温室气体的减排具有重要意义,其反应为:
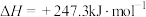 。回答下列问题:
。回答下列问题:(1)已知相关物质的燃烧热(25℃、101kPa):
| 物质 |  |  |  |
燃烧热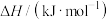 | ? | -283.0 | -285.8 |
 燃烧热
燃烧热
 。
。(2)其他条件相同,在不同催化剂(A、B)作用下,反应
 进行相同时间后,CO的产率随反应温度的变化如图所示。
进行相同时间后,CO的产率随反应温度的变化如图所示。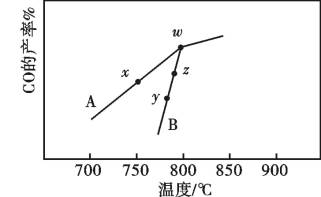
①由图可知,催化效果较好的催化剂是
 、
、 表示,则
表示,则
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②w点
③速率大小比较:y点对应的

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(3)将原料
 和
和 按等物质的量充入密闭容器中,保持体系压强为100kPa发生反应:
按等物质的量充入密闭容器中,保持体系压强为100kPa发生反应:
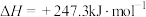 。达到平衡时,
。达到平衡时, 体积分数与温度的关系如图所示。
体积分数与温度的关系如图所示。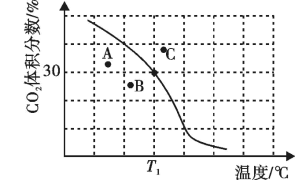
①若A、B、C三点表示不同温度和压强下达到平衡时
 的体积分数,则
的体积分数,则②
 、100kPa下,达平衡时
、100kPa下,达平衡时 转化率=
转化率=
 (以分压表示,分压=总压强×气体成分的物质的量分数)。
(以分压表示,分压=总压强×气体成分的物质的量分数)。
(1)工业上用丙烯加成法制备1,2-二氯丙烷,主要副产物为3-氯丙烯,反应原理为:
①
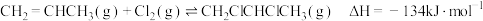
②

已知:
 的活化能
的活化能 为
为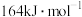 ,则该反应的活化能
,则该反应的活化能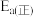 为
为 。
。(2)某研究小组向密闭容器中充入一定量的
 和
和 ,分别在
,分别在 、
、 两种不同催化剂作用下发生反应①,一段时间后测得
两种不同催化剂作用下发生反应①,一段时间后测得 的产率与温度的关系如下图所示。
的产率与温度的关系如下图所示。
A.使用催化剂
 的最佳温度约为
的最佳温度约为
B.相同条件下,改变压强不影响
 的产率
的产率C.两种催化剂均能降低反应的活化能,但
 不变
不变D.P点是对应温度下
 的平衡产率
的平衡产率②在催化剂
 作用下,温度低于
作用下,温度低于 时,
时, 的产率随温度升高变化不大,主要原因是
的产率随温度升高变化不大,主要原因是(3)
 在不同温度下达到平衡,在总压强分别为
在不同温度下达到平衡,在总压强分别为 和
和 时,测得丙烷及丙烯的物质的量分数如图所示。
时,测得丙烷及丙烯的物质的量分数如图所示。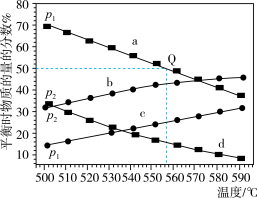

 (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。②起始时充入一定量丙烷,在恒压
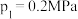 条件下发生反应,
条件下发生反应, 点对应温度下丙烷的转化率为
点对应温度下丙烷的转化率为
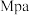 (用平衡分压代替平衡浓度计算,分压
(用平衡分压代替平衡浓度计算,分压 总压
总压 物质的量分数)。
物质的量分数)。
 溶液中通入
溶液中通入 气体至饱和,观察到溶液由棕黄色迅速变为红棕色[经检验无
气体至饱和,观察到溶液由棕黄色迅速变为红棕色[经检验无 胶体],较长时间后变为浅绿色。
胶体],较长时间后变为浅绿色。已知:①反应I:
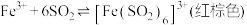
反应II:
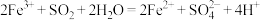
②溶液酸性越强,
 溶解度越低
溶解度越低下列说法正确的是
A.反应II中 体现漂白性 体现漂白性 | B.反应II的活化能比反应I的活化能高 |
C. 在反应I、II中均作氧化剂 在反应I、II中均作氧化剂 | D.向红棕色溶液中滴加浓盐酸,颜色加深 |
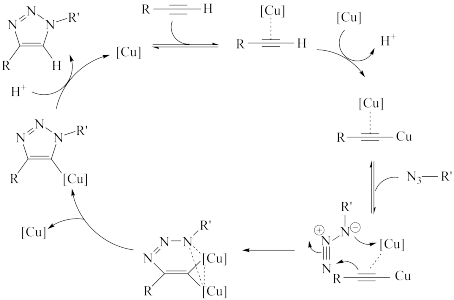
下列说法错误的是
| A.H+是点击反应的中间产物 | B.反应前后碳元素的化合价不变 |
| C.铜催化时点击反应的活化能减小 | D.总反应式为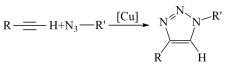 |
 转化为有机物并非植物的“专利”,科学家通过多种途径实现了
转化为有机物并非植物的“专利”,科学家通过多种途径实现了 合成甲醛,总反应为
合成甲醛,总反应为 .转化步骤如图1所示:
.转化步骤如图1所示: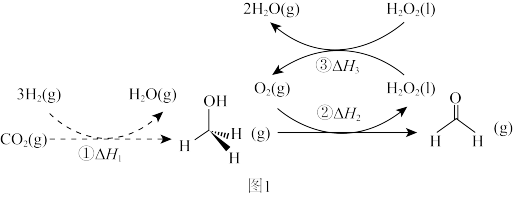
(1)原料
 可通过捕捉技术从空气中或工业尾气中获取,写出一种常见的可作
可通过捕捉技术从空气中或工业尾气中获取,写出一种常见的可作 捕捉剂的廉价试剂
捕捉剂的廉价试剂(2)已知
 ,则总反应的
,则总反应的
 表示)。
表示)。(3)
 ,在容积为
,在容积为 的恒容密闭容器中充入
的恒容密闭容器中充入 和一定量
和一定量 ,只发生可逆反应①。若起始时容器内气体压强为
,只发生可逆反应①。若起始时容器内气体压强为 ,达到平衡时,
,达到平衡时, 的分压与起始投料比
的分压与起始投料比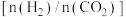 的变化关系如图2所示。
的变化关系如图2所示。
(ⅰ)若
 时到达c点,则
时到达c点,则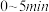 时的平均反应速率
时的平均反应速率
 ;
;(ⅱ)

(ⅲ)c点时,再加入
 和
和 ,使两者分压均增大
,使两者分压均增大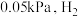 的转化率
的转化率(4)在恒温恒容条件下只发生反应②。关于该步骤的下列说法错误的是____________。
A.若反应②正向为自发反应,需满足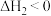 |
| B.若气体的平均相对分子质量保持不变,说明反应②体系已经达到平衡 |
C.增大 的浓度, 的浓度,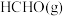 的平衡物质的量分数一定增大 的平衡物质的量分数一定增大 |
D.反应②体系存在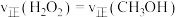 |
 (
( 为活化能,k为速率常数,R和C为常数)。反应①②的有关数据分别如图3所示,
为活化能,k为速率常数,R和C为常数)。反应①②的有关数据分别如图3所示, 相对较小的是
相对较小的是
(1)CO用于处理大气污染物N2O的反应为CO(g)+N2O(g)
 CO2(g)+N2(g)。在Zn+作用下该反应的具体过程如图1所示,反应过程中能量变化情况如图2所示。
CO2(g)+N2(g)。在Zn+作用下该反应的具体过程如图1所示,反应过程中能量变化情况如图2所示。
总反应:CO(g)+N2O(g)
 CO2(g)+N2(g) ΔH=
CO2(g)+N2(g) ΔH=(2)已知:CO(g)+N2O(g)

 CO2(g)+N2(g)的速率方程为v=k·c(N2O),k为速率常数,只与温度有关。为提高反应速率,可采取的措施是_______(填字母序号)。
CO2(g)+N2(g)的速率方程为v=k·c(N2O),k为速率常数,只与温度有关。为提高反应速率,可采取的措施是_______(填字母序号)。| A.恒容时,再充入CO | B.恒压时,再充入N2O | C.恒压时,再充入N2 | D.升温 |
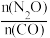 、在
、在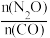 =1时N2O的转化率与
=1时N2O的转化率与 的变化曲线如图3所示:
的变化曲线如图3所示:
①表示N2O的转化率随
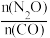 的变化曲线为
的变化曲线为②T1
(4)已知:该反应的标准平衡常数
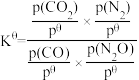 ,其中pθ为标准压强(100kPa),p(CO2)、p(N2)、p(N2O)和p(CO)为各组分的平衡分压,则T4时,该反应的标准平衡常数Kθ=
,其中pθ为标准压强(100kPa),p(CO2)、p(N2)、p(N2O)和p(CO)为各组分的平衡分压,则T4时,该反应的标准平衡常数Kθ=
 ;反应进程中的能量变化如图所示,Ea为反应的活化能,下列说法正确的是
;反应进程中的能量变化如图所示,Ea为反应的活化能,下列说法正确的是
| A.使用催化剂可以降低反应热 |
B.反应的 与活化能(Ea)的关系为 与活化能(Ea)的关系为 |
| C.该反应中断键吸收的能量高于成键放出的能量 |
D.该反应 ,反应在任何温度条件下均无法自发进行 ,反应在任何温度条件下均无法自发进行 |
(1)二氧化氯
 是黄绿色、易溶于水的气体,具有强氧化性,可用于烟气中
是黄绿色、易溶于水的气体,具有强氧化性,可用于烟气中 和NO的脱除。研究表明:
和NO的脱除。研究表明: 氧化
氧化 和NO的反应历程与下列反应有关。
和NO的反应历程与下列反应有关。| 序号 | 反应机理 | 反应热 | 速率常数 | |
| 脱硝 | ⅰ |  |  | 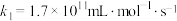 |
| ⅱ | 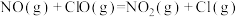 |  | 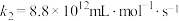 | |
| 脱硫 | ⅲ | 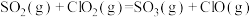 |  |  |
| ⅳ |  |  | 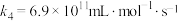 |
实验测得:
 分别对纯
分别对纯 、纯NO以及同时氧化的氧化率随时间的变化情况如图所示。据此分析:
、纯NO以及同时氧化的氧化率随时间的变化情况如图所示。据此分析:
①其它因素都相同,判断
 氧化
氧化 的活化能
的活化能 氧化NO的活化能;
氧化NO的活化能;②NO的存在
 氧化
氧化 。请结合ⅰ、ⅲ、ⅳ的速率常数分析原因:
。请结合ⅰ、ⅲ、ⅳ的速率常数分析原因:(2)一定时间内,NaClO溶液在不同温度下对硫、硝脱除率影响曲线如图。
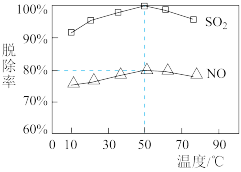
①
 脱除率高于NO,可能的原因是
脱除率高于NO,可能的原因是②烟气中
 和NO体积比为4∶1,烟气与50℃时的吸收液转化生成的
和NO体积比为4∶1,烟气与50℃时的吸收液转化生成的
9 . 氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理和化学平衡对于消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g) 2NO2(g)ΔH。上述反应分两步完成,其反应历程如图所示。
2NO2(g)ΔH。上述反应分两步完成,其反应历程如图所示。

请回答下列问题:
①写出反应II的热化学方程式
②反应I和反应II中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g) 2NO2(g)反应速率的是
2NO2(g)反应速率的是
(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及12min和15min时各物质的平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及12min和15min时各物质的平衡浓度如表所示:
浓度(mol·L-1) 时间(min) | NO | CO2 | N2 |
0 | 0.200 | 0 | 0 |
12 | 0.050 | 0.075 | 0.075 |
15 | 0.100 | 0.050 | 0.450 |
①T℃时,该反应的平衡常数为
②在12min时,若只改变某一条件使平衡发生移动,15min时重新达到平衡,则改变的条件是
③在15min时,保持温度和容器体积不变再充入NO和N2,使NO、N2的浓度分别增加至原来的2倍4倍,此时反应v正
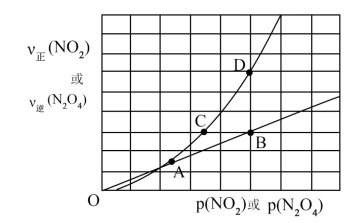
(3)NO2存在如下平衡:2NO2(g) N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系式:v正(NO2)=k1·P2(NO2),v逆(N2O4)=k2·P(N2O4),速率与分压关系如图所示。一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是Kp=
N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系式:v正(NO2)=k1·P2(NO2),v逆(N2O4)=k2·P(N2O4),速率与分压关系如图所示。一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是Kp=

下列说法不正确的是
| A.1,4—加成产物比1,2—加成产物更稳定 |
| B.1,3—丁二烯与HBr发生加成反应是放热反应 |
| C.适当升高反应温度,可能有利于1,4—加成的进行 |
| D.选择合适的催化剂加入,可使1,2—加成的焓变小于1,4—加成 |



