名校
解题方法
1 . 科研人员提出催化合成碳酸二甲酯(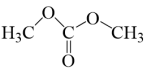 )的示意图如图所示,下列说法错误的是
)的示意图如图所示,下列说法错误的是

 )的示意图如图所示,下列说法错误的是
)的示意图如图所示,下列说法错误的是
A.过程①中有 键的断裂 键的断裂 |
B. 是中间产物 是中间产物 |
C.总反应的化学方程式为CO2+2CH3OH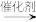  +H2O +H2O |
| D.二氧化碳、甲醇、碳酸二甲酯均能与NaOH溶液反应 |
您最近一年使用:0次
2022-07-21更新
|
92次组卷
|
6卷引用:福建省福州第三中学2021-2022学年高三上学期第六次质量检测化学试题
福建省福州第三中学2021-2022学年高三上学期第六次质量检测化学试题河南省濮阳市2021-2022学年高三上学期期中考试(11月考)化学试题江西省石城中学2022-2023学年高二下学期第三次半月考化学试题河南省名校大联考2021-2022学年高三上学期期中考试化学试题 江西省抚州市部分中学2021-2022学年高二下学期联考化学试题(已下线)押新高考卷11题 反应机理分析-备战2022年高考化学临考题号押题(新高考通版)
2 . 在相同条件下研究催化剂I、Ⅱ对反应 的影响,各物质浓度c随反应时间t的部分变化曲线如图,则
的影响,各物质浓度c随反应时间t的部分变化曲线如图,则
 的影响,各物质浓度c随反应时间t的部分变化曲线如图,则
的影响,各物质浓度c随反应时间t的部分变化曲线如图,则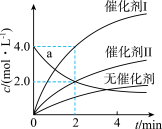
| A.无催化剂时,反应不能进行 |
| B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低 |
| C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化 |
D.使用催化剂Ⅰ时, 内, 内,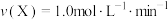 |
您最近一年使用:0次
2022-06-10更新
|
14492次组卷
|
61卷引用:福建省厦门集美中学2022-2023学年高三上学期10月月考化学试题
福建省厦门集美中学2022-2023学年高三上学期10月月考化学试题上海市复旦大学附属中学2022-2023学年高二上学期9月月考化学试题湖南省长沙市雅礼中学2022-2023学年高二上学期第一次月考化学试题江苏省扬州中学2022-2023学年高二上学期10月月考化学试题山东省莱州一中2022-2023学年高二上学期第一次月考化学试题湖北省沙市中学2022-2023学年高二上学期第二次月考化学试题河南省洛阳市新安县第一高级中学2022-2023学年高三上学期9月阶段性考试化学试题宁夏银川市第二中学2022-2023学年高三上学期统练三化学试题吉林省延边第二中学2022-2023学年高三上学期第三次阶段测试化学试题广东省高州市第七中学等三校2022-2023学年高二上学期11月月考化学试题福建省厦门外国语学校石狮分校2022-2023学年高二上学期期中考试化学试题河南省开封市祥符高级中学2023-2024学年高二上学期第一次月考化学试题广东省肇庆市封开县广信中学、四会中学2023-2024学年高二上学期第一次联考化学试题江苏省苏州实验中学科技城校2023-2024学年高二上学期10月月考化学试题广东省佛山市顺德区郑裕彤中学2023-2024学年上学期高一10月月考化学试题安徽省当涂第一中学2023-2024学年高二上学期10月月考化学试题福建省泉州市晋江市南侨中学2023-2024学年高二上学期11月期中考试化学试题广东省乐昌市第二中学2023-2024学年高三下学期保温测试(5月模拟)化学试题2022年新高考广东化学高考真题(已下线)2022年广东卷高考真题变式题(11-16)(已下线)专题09 化学反应速率、化学平衡-2022年高考真题模拟题分项汇编(已下线)专题09 化学反应速率、化学平衡-三年(2020-2022)高考真题分项汇编(已下线)第11练 以化学平衡图像突破化学平衡移动原理-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)考点21 化学反应速率-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点25 化学反应速率与平衡图象-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第26练 化学反应速率-2023年高考化学一轮复习小题多维练(全国通用)(已下线)专题13 化学反应速率与化学平衡-备战2023年高考化学母题题源解密(广东卷)(已下线)第20讲 化学反应速率(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第18讲 化学反应速率(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第二章 化学反应速率与化学平衡(A卷·知识通关练)【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)(已下线)易错点21 化学反应速率-备战2023年高考化学考试易错题(已下线)【2022】【高二上】【期中考】【高中化学】59(已下线)专题09 化学反应速率与化学平衡(讲)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题17 化学平衡图表分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型114 影响化学反应速率的因素(已下线)【2022】【高二化学】【期中考】-178(已下线)回归教材重难点08 聚焦热、速率、平衡-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)专题15 化学反应速率和化学平衡(已下线)专题15 化学反应速率和化学平衡(已下线)第13练 化学反应速率与化学平衡的综合考查 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)天津市红桥区2022-2023学年高三上学期期末考试化学试题广东省信宜市第二中学2022-2023学年高二上学期期中考试化学试题章末检测卷(二) 化学反应速率与化学平衡四川省成都市树德中学2022-2023学年高一下学期期末考试化学试题(已下线)专题08 反应速率与化学平衡-2023年高考化学真题题源解密(新高考专用)(已下线)专题11 化学反应速率与化学平衡-2023年高考化学真题题源解密(全国通用)(已下线)考点25 化学反应速率与平衡图象(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)安徽省滁州市实验中学等2校2022-2023学年高二上学期1月期末考试化学试题第二章 化学反应速率与化学平衡 第一节 化学反应速率 第2课时 影响化学反应速率的因素 活化能(已下线)实验02 定性与定量研究影响化学反应速率的因素-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)(已下线)考点1 化学反应速率(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)广东省珠海市2023-2024年高二上学期期中联考化学试题安徽省马鞍山市第二中学2022-2023学年高二上学期11月期中考试化学试题河南省实验中学2023-2024学年高二上学期期中考试化学试题北京市第二十二中学2022-2023学年高二上学期期中考试化学试题广东省广州市第四十一中学2023-2024学年高二上学期期中考试化学试题(已下线)题型10 反应微观机理分析 速率方程及其应用-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)天津市和平区2023-2024学年高二上学期期末考试化学试卷广东省台山市某校2023-2024学年高二上学期期中考试化学试题山西省运城市河津中学2023-2024学年高二下学期开学考试化学试题北京市第五十五中学2022-2023学年高三上学期期中考试化学试题
名校
3 . 甲烷可在铑/铈氧化物的催化下与过氧化氢反应,转化为甲醇和甲基过氧化氢(CH3OOH),实现了天然气的高效利用,其原理如图所示,下列说法错误的是


| A.反应③中有极性键的断裂与生成 |
| B.反应⑤中,Ce的化合价降低 |
| C.铑/铈氧化物改变了CH4和H2O2的反应历程,降低了反应的活化能 |
| D.若用H2l8O2作反应物,一段时间后CH3OH、CH3OOH和铑/铈氧化物中均含有18O |
您最近一年使用:0次
2022-06-05更新
|
385次组卷
|
3卷引用:福建省惠安第一中学2022-2023学年高三上学期第三次月考化学试题
名校
4 . 以Pd纳米粒子为核、空心多孔碳球为壳的封装型催化剂将H2和O2直接合成 的机理如图(a)所示。电催化还原O2时的两种可能转化路径如图(b)所示(其中吸附在催化剂表面的物种用*标注)。下列说法错误的是
的机理如图(a)所示。电催化还原O2时的两种可能转化路径如图(b)所示(其中吸附在催化剂表面的物种用*标注)。下列说法错误的是
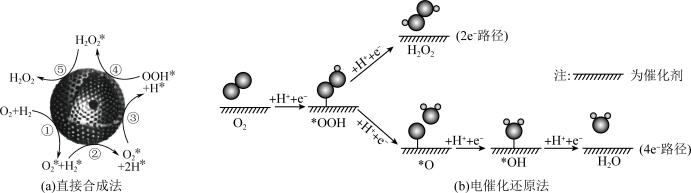
 的机理如图(a)所示。电催化还原O2时的两种可能转化路径如图(b)所示(其中吸附在催化剂表面的物种用*标注)。下列说法错误的是
的机理如图(a)所示。电催化还原O2时的两种可能转化路径如图(b)所示(其中吸附在催化剂表面的物种用*标注)。下列说法错误的是
| A.直接合成法中,步骤②吸收能量,步骤④释放能量 |
| B.电催化还原法制备H2O2的优点之一是避免了H2和O2共存的易爆环境 |
| C.电催化还原时,2e-路径的步骤少,反应速率快 |
D.若催化剂表面对*OOH吸附过强,则易生成O*,导致 的产率降低 的产率降低 |
您最近一年使用:0次
2022-05-05更新
|
626次组卷
|
6卷引用:福建省连城县第一中学2022-2023学年高二上学期第一次月考化学试题
福建省连城县第一中学2022-2023学年高二上学期第一次月考化学试题福建省三明市2022届普通高中毕业班下学期5月质量测试化学试题重庆市缙云教育联盟2021-2022学年高一6月质量检测化学试题湖南省岳阳市一中2021-2022学年高三下学期第三次模拟考试试题(已下线)专题07 化学反应中的能量变化-2022年高考真题模拟题分项汇编(已下线)微专题36 高考“明星”考点—催化剂-备战2023年高考化学一轮复习考点微专题
名校
5 . 过氧化钙是一种温和的氧化剂,常温下为白色的固体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。某实验小组拟选用如下操作与装置(部分固定装置略)制备过氯化钙。
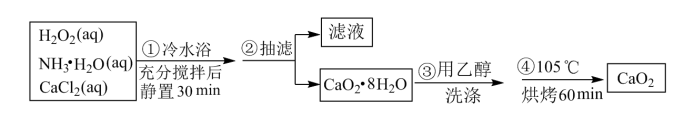

(1)三颈烧瓶中发生的主要反应的化学方程式为_______ 。
(2)用恒压分液漏斗盛装H2O2和浓氨水相比用普通分液漏斗盛装的好处是_______ 。
(3)该反应常用冰水浴控制温度在0°C左右,其可能的原因分析:其一,该反应是放热反应,温度低有利于提高CaO2·8H2O的产率;其二,_______ ;
(4)反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。检验CaO2·8H2O是否洗涤干净的试剂为_______ 。
(5)过氧化钙产品纯度测定实验步骤如下:
第一步:准确称取ag产品于烧杯中,加入适量的盐酸使其完全溶解;
第二步:向上述溶液中加入稍过量的(NH4)2C2O4,沉淀完全,过滤并洗涤沉淀;
第三步:将洗涤好的沉淀用稍过量的稀硫酸溶解,溶解液和洗涤液全部转移至锥形瓶中;
第四步:向锥形瓶中滴入几滴MnSO4溶液,然后逐滴滴入浓度为cmol·L-1的KMnO4溶液至终点,消耗KMnO4溶液VmL。
①滴定前,滴入MnSO4溶液的目的是_______ 。
②滴定终点的现象为_______ 。
③产品的纯度为_______ (用字母表示)。
④若第三步用稀盐酸溶解,所测纯度_______ (填“偏低”“不变”或“偏高”)


(1)三颈烧瓶中发生的主要反应的化学方程式为
(2)用恒压分液漏斗盛装H2O2和浓氨水相比用普通分液漏斗盛装的好处是
(3)该反应常用冰水浴控制温度在0°C左右,其可能的原因分析:其一,该反应是放热反应,温度低有利于提高CaO2·8H2O的产率;其二,
(4)反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。检验CaO2·8H2O是否洗涤干净的试剂为
(5)过氧化钙产品纯度测定实验步骤如下:
第一步:准确称取ag产品于烧杯中,加入适量的盐酸使其完全溶解;
第二步:向上述溶液中加入稍过量的(NH4)2C2O4,沉淀完全,过滤并洗涤沉淀;
第三步:将洗涤好的沉淀用稍过量的稀硫酸溶解,溶解液和洗涤液全部转移至锥形瓶中;
第四步:向锥形瓶中滴入几滴MnSO4溶液,然后逐滴滴入浓度为cmol·L-1的KMnO4溶液至终点,消耗KMnO4溶液VmL。
①滴定前,滴入MnSO4溶液的目的是
②滴定终点的现象为
③产品的纯度为
④若第三步用稀盐酸溶解,所测纯度
您最近一年使用:0次
名校
6 . 已知反应2NO(g)+2H2(g) N2(g)+2H2O(g)△H=-752kJ·mol-1的反应机理如下:
N2(g)+2H2O(g)△H=-752kJ·mol-1的反应机理如下:
①2NO(g) N2O2(g)(快)
N2O2(g)(快)
②N2O2(g)+H2(g) N2O(g)+H2O(g)(慢)
N2O(g)+H2O(g)(慢)
③N2O(g)+H2(g) N2(g)+H2O(g)(快)
N2(g)+H2O(g)(快)
下列有关说法错误的是
 N2(g)+2H2O(g)△H=-752kJ·mol-1的反应机理如下:
N2(g)+2H2O(g)△H=-752kJ·mol-1的反应机理如下:①2NO(g)
 N2O2(g)(快)
N2O2(g)(快)②N2O2(g)+H2(g)
 N2O(g)+H2O(g)(慢)
N2O(g)+H2O(g)(慢)③N2O(g)+H2(g)
 N2(g)+H2O(g)(快)
N2(g)+H2O(g)(快)下列有关说法错误的是
| A.增大H2(g)的浓度能增大单位体积内气体的活化分子数,有效碰撞次数增多,速率加快 |
| B.该反应的速率主要取决于②的快慢 |
| C.N2O2和N2O是该反应的催化剂 |
| D.总反应中逆反应的活化能比正反应的活化能大 |
您最近一年使用:0次
2022-04-18更新
|
262次组卷
|
3卷引用:福建省平潭翰英中学2022-2023学年高二上学期第一次月考化学试题
名校
7 . I.氢气是一种清洁能源,水煤气变换反应的制氢原理为: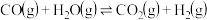
 ,回答下列问题:
,回答下列问题:
(1)水煤气变换部分基元反应如下:
第②步基元反应逆反应的活化能为___________ eV。
(2)某研究所探究CuO/ 的系列催化剂(包括C/Z-120、C/Z-250、C/Z-350、C/Z-450)在水煤气变换反应中的催化活性。常压下,原料气在不同温度下相同时间内CO的转化率如图:
的系列催化剂(包括C/Z-120、C/Z-250、C/Z-350、C/Z-450)在水煤气变换反应中的催化活性。常压下,原料气在不同温度下相同时间内CO的转化率如图:___________ 。
②C/Z-120曲线先上升后下降的原因___________ 。
II.长征运载火箭推进剂为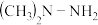 和
和 。
。
(3)在t℃、pMPa下,将 (g)和物质的量分数为m%的
(g)和物质的量分数为m%的 (g)通入反应器:①
(g)通入反应器:①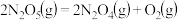 ,②
,②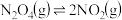 ,一段时间后
,一段时间后 完全反应,反应②达平衡,
完全反应,反应②达平衡, 与
与 的体积比为1:2,则反应②的平衡常数
的体积比为1:2,则反应②的平衡常数
___________ MPa。
(4)T℃时,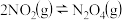 ,该反应正、逆反应速率与浓度的关系为:
,该反应正、逆反应速率与浓度的关系为: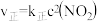 ,
,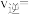
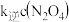 (
( 、
、 这是速率常数)。
这是速率常数)。
①图中表示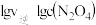 的线是
的线是___________ (填“m”或“n”) 气体,平衡后测得
气体,平衡后测得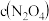 为1.0
为1.0 ,则平衡时,
,则平衡时, =
=________ (用含a的表达式表示)。
③T℃时,向2L的容器中充入5mol 气体和1mol
气体和1mol 气体,此时
气体,此时
______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
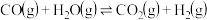
 ,回答下列问题:
,回答下列问题:(1)水煤气变换部分基元反应如下:
| 基元反应 | 活化能Ea(eV) | 反应热△H(eV) |
①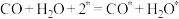 | 0 | -1.73 |
② | 0.81 | -0.41 |
(2)某研究所探究CuO/
 的系列催化剂(包括C/Z-120、C/Z-250、C/Z-350、C/Z-450)在水煤气变换反应中的催化活性。常压下,原料气在不同温度下相同时间内CO的转化率如图:
的系列催化剂(包括C/Z-120、C/Z-250、C/Z-350、C/Z-450)在水煤气变换反应中的催化活性。常压下,原料气在不同温度下相同时间内CO的转化率如图: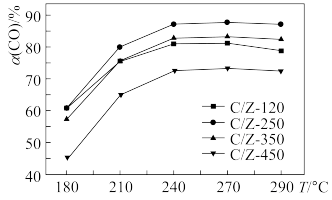
②C/Z-120曲线先上升后下降的原因
II.长征运载火箭推进剂为
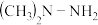 和
和 。
。(3)在t℃、pMPa下,将
 (g)和物质的量分数为m%的
(g)和物质的量分数为m%的 (g)通入反应器:①
(g)通入反应器:①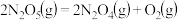 ,②
,②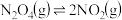 ,一段时间后
,一段时间后 完全反应,反应②达平衡,
完全反应,反应②达平衡, 与
与 的体积比为1:2,则反应②的平衡常数
的体积比为1:2,则反应②的平衡常数
(4)T℃时,
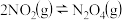 ,该反应正、逆反应速率与浓度的关系为:
,该反应正、逆反应速率与浓度的关系为: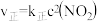 ,
,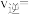
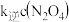 (
( 、
、 这是速率常数)。
这是速率常数)。①图中表示
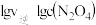 的线是
的线是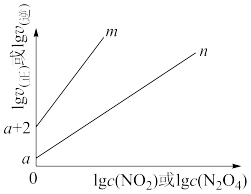
 气体,平衡后测得
气体,平衡后测得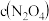 为1.0
为1.0 ,则平衡时,
,则平衡时, =
=③T℃时,向2L的容器中充入5mol
 气体和1mol
气体和1mol 气体,此时
气体,此时
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
2022-03-06更新
|
660次组卷
|
4卷引用:福建省连城县第一中学2022-2023学年高三上学期第二次月考化学试题
福建省连城县第一中学2022-2023学年高三上学期第二次月考化学试题山东省日照市 2022届高三第一次模拟考试化学试题(已下线)必刷卷01-2022年高考化学考前信息必刷卷(山东专用)2024届重庆市乌江新高考协作体高三下学期模拟预测化学试题
名校
8 . 某小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应。
[实验I ]试剂:酸化的0.5mol·L-1FeSO4溶液(pH = 0.2), 5% H2O2溶液(pH = 5)
(1)上述实验中H2O2溶液与FeSO4溶液反应的离子方程式是___________ 。
(2)产生气泡的原因是___________ 。
[实验II]试剂:未酸化的0.5mol·L-1FeSO4溶液(pH =3), 5% H2O2溶液(pH= 5)
(3)将上述混合物分离,得到棕黄色沉淀和红褐色胶体,取部分棕黄色沉淀洗净,加4mol·L-1盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有Fe2O3,经检验还含有SO 。检验棕黄色沉淀中SO
。检验棕黄色沉淀中SO 的方法是
的方法是___________ 。
(4)对于生成红褐色胶体的原因,提出两种假设:
i.H2O2溶液氧化Fe2+消耗H+
ii.Fe2+氧化的产物发生了水解
①根据实验II记录否定假设i, 理由是___________ 。
②实验验证假设ii:取___________ ,加热,溶液变为红褐色,pH下降,证明假设ii成立。
[实验III]若用FeCl2溶液替代FeSO4溶液,其余操作与实验II相同,除了产生与II 相同的现象外,还生成刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色。
(5)产生刺澉性气味气体的原因是___________ 。
(6)由实验I、II、III可知,亚铁盐与H2O2反应的现象与___________ (至少写两点)有关。
[实验I ]试剂:酸化的0.5mol·L-1FeSO4溶液(pH = 0.2), 5% H2O2溶液(pH = 5)
| 操作 | 现象 |
| 取2mL上述FeSO4溶液于试管中,加入5滴5% H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡,测得反应后溶液pH= 0.9 |
| 向反应后的溶液中加入KSCN溶液 | 溶液变红 |
(2)产生气泡的原因是
[实验II]试剂:未酸化的0.5mol·L-1FeSO4溶液(pH =3), 5% H2O2溶液(pH= 5)
| 操作 | 现象 |
| 取2mL 5% H2O2溶液于试管中,加入5滴上述FeSO4溶液 | 溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊,测得反应后溶液pH = 1.4 |
 。检验棕黄色沉淀中SO
。检验棕黄色沉淀中SO 的方法是
的方法是(4)对于生成红褐色胶体的原因,提出两种假设:
i.H2O2溶液氧化Fe2+消耗H+
ii.Fe2+氧化的产物发生了水解
①根据实验II记录否定假设i, 理由是
②实验验证假设ii:取
[实验III]若用FeCl2溶液替代FeSO4溶液,其余操作与实验II相同,除了产生与II 相同的现象外,还生成刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色。
(5)产生刺澉性气味气体的原因是
(6)由实验I、II、III可知,亚铁盐与H2O2反应的现象与
您最近一年使用:0次
名校
9 . 某科研团队研制出“TM-LiH (TM表示过渡金属)”双催化剂体系,显著提高了在温和条件下氮气和氢气合成NH3的效率,原理示意如下:
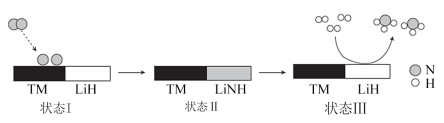
下列分析不合理的是

下列分析不合理的是
| A.状态I,N2吸附并发生解离,N≡N键发生断裂并吸收能量 |
B.合成NH3总反应的原子利用率是 |
C.“TM-LiH”能降低合成氨反应的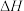 |
D.生成 |
您最近一年使用:0次
10 . 以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
(1)工业上采用NH3-SCR法是消除氮氧化物的常用方法。它利用氨在一定条件下将NOx在脱硝装置中转化为N2主要反应原理为:
主反应:a. 4NH3(g)+4NO(g)+O2(g)⇌4N2(g)+6H2O(g) ΔH1;
副反应:b. 4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g) ΔH2=-1267.1kJ·mol-1;
c.4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g) ΔH3=-907.3kJ·mol-1
①主反应的ΔH1=_______ kJ·mol-1
②将氮氧化合物按一定的流速通过脱硝装置,测得出口的NO残留浓度与温度的关系如图所示,试分析脱硝的适宜温度是_______ (填序号)。
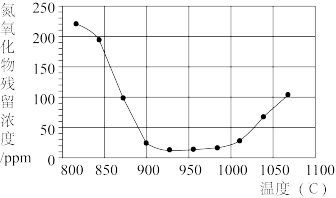
a.<850℃ b.900~1000℃ c.>1050℃
温度超过1000℃,NO浓度升高的原因是_______ 。
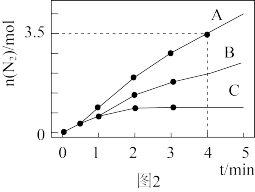
(2)已知:8NH3(g)+6NO2(g)⇌7N2(g) +12H2O(l) ΔH<0.相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。该反应活化能Ea(A)、Ea(B)、Ea(C)由大到小的顺序是_______ ,理由是_______ 。
(3)随着各地治霾力度的加大,大力发展高性能燃料电池汽车成为研究课题。某课题组设计的液体燃料电池示意图如图:
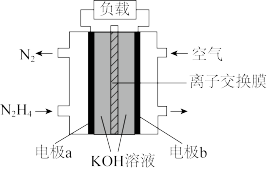
①该电池中通入N2H4的电极为_______ (填“负极”或“正极”), 其电极反应式是_______ 。
②电池工作时,K+移向_______ (填“a”或“b”)。
(1)工业上采用NH3-SCR法是消除氮氧化物的常用方法。它利用氨在一定条件下将NOx在脱硝装置中转化为N2主要反应原理为:
主反应:a. 4NH3(g)+4NO(g)+O2(g)⇌4N2(g)+6H2O(g) ΔH1;
副反应:b. 4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g) ΔH2=-1267.1kJ·mol-1;
c.4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g) ΔH3=-907.3kJ·mol-1
①主反应的ΔH1=
②将氮氧化合物按一定的流速通过脱硝装置,测得出口的NO残留浓度与温度的关系如图所示,试分析脱硝的适宜温度是

a.<850℃ b.900~1000℃ c.>1050℃
温度超过1000℃,NO浓度升高的原因是
(2)已知:8NH3(g)+6NO2(g)⇌7N2(g) +12H2O(l) ΔH<0.相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。该反应活化能Ea(A)、Ea(B)、Ea(C)由大到小的顺序是

(3)随着各地治霾力度的加大,大力发展高性能燃料电池汽车成为研究课题。某课题组设计的液体燃料电池示意图如图:

①该电池中通入N2H4的电极为
②电池工作时,K+移向
您最近一年使用:0次



