名校
解题方法
1 . 超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)前2 s内的平均反应速率υ(N2)=_______ 。
(2)达到平衡时NO的转化率为_______ 。
(3)若上述反应在密闭恒容容器中进行,判断该反应达到平衡的依据为_______(填字母)。
(4)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
①表中t2=_______ ℃,c1=_______ mol·L−1,c2= _______ mol·L−1。
②三组实验中的浓度随时间的变化如下图所示:
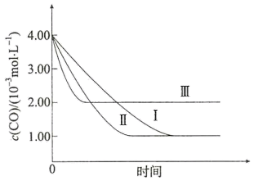
由曲线Ⅰ、Ⅱ可知,其它条件相同时,增大催化剂的比表面积,该化学反应的速率将_______ (填“增大”、“减小”或“无影响”)。由实验Ⅰ和Ⅲ可得出的结论是_______ 。
 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol·L−1 | 1.00×10−3 | 4.50×10−4 | 2.50×10−4 | 1.50×10−4 | 1.00×10−4 | 1.00×10−4 |
| c(CO)/mol·L−1 | 3.60×10−3 | 3.05×10−3 | 2.85×10−3 | 2.75×10−3 | 2.70×10−3 | 2.70×10−3 |
(1)前2 s内的平均反应速率υ(N2)=
(2)达到平衡时NO的转化率为
(3)若上述反应在密闭恒容容器中进行,判断该反应达到平衡的依据为_______(填字母)。
| A.c(N2)不随时间改变 | B.气体的密度不随时间改变 |
| C.压强不随时间改变 | D.单位时间内消耗2 mol NO的同时生成1 mol N2 |
| 编号 | t/℃ | NO初始浓度/mol·L−1 | CO初始浓度/mol·L−1 | 催化剂的比表面积/m2·g−1 |
| Ⅰ | 280 | 6.50×10−3 | 4.00×10−3 | 80.0 |
| Ⅱ | t2 | c1 | 4.00×10−3 | 120 |
| Ⅲ | 350 | 6.50×10−3 | c2 | 80.0 |
②三组实验中的浓度随时间的变化如下图所示:

由曲线Ⅰ、Ⅱ可知,其它条件相同时,增大催化剂的比表面积,该化学反应的速率将
您最近一年使用:0次
2021-11-17更新
|
284次组卷
|
3卷引用:福建省南安市侨光中学、昌财实验中学2021-2022学年高二上学期第二次阶段考化学试题
2 . 回答下列问题:
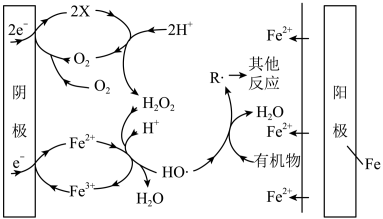
(1)EF、H2O2、FeOx,法可用于水体中有机污染物降解,其反应机理如图所示。阳极的电极反应式为____ ,X微粒的化学式为____ ,阴极附近Fe2+参与反应的离子方程式为___ 。
(2)将一定量的氢基甲酸铵置于恒容真空密闭容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是___ 。
a.2v正(NH3)=V逆(CO2)
b.密闭容器中c(NH3):c(CO2)=2:1
c.密闭容器中混合气体的密度不变
d.混合气体压强不再发生变化
e.气体的平均相对分子质量不变
(3)中科院化学所研究了下列反应的反应历程,如图所示:
CH3OH(g)+CO2(g)+H2(g) CH3COOH(g)+H2O(g)
CH3COOH(g)+H2O(g)
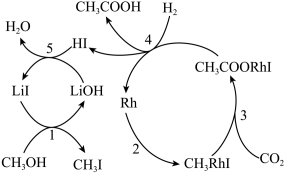
反应历程中,能降低反应活化能的物质有___ (填化学式);中间产物有___ 种。
(1)EF、H2O2、FeOx,法可用于水体中有机污染物降解,其反应机理如图所示。阳极的电极反应式为

(2)将一定量的氢基甲酸铵置于恒容真空密闭容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)
 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是a.2v正(NH3)=V逆(CO2)
b.密闭容器中c(NH3):c(CO2)=2:1
c.密闭容器中混合气体的密度不变
d.混合气体压强不再发生变化
e.气体的平均相对分子质量不变
(3)中科院化学所研究了下列反应的反应历程,如图所示:
CH3OH(g)+CO2(g)+H2(g)
 CH3COOH(g)+H2O(g)
CH3COOH(g)+H2O(g)
反应历程中,能降低反应活化能的物质有
您最近一年使用:0次
解题方法
3 . H2O2在Fe2+、Cu2+的存在下生成具有强氧化性的•OH(羟基自由基),•OH可将有机物氧化降解。
(1)Cu2+—H2O2体系中存在下列反应:
Cu2+(aq)+H2O2(aq)=CuOOH+(aq)+H+(aq) △H1=akJ/mol
CuOOH+(aq)=Cu+(aq)+•OH(aq)+ O2(g) △H2=bkJ/mol
O2(g) △H2=bkJ/mol
2CuOOH+(aq)=2Cu+(aq)+H2O2(aq)+O2(g) △H3=ckJ/mol
则H2O2(aq)=2•OH(aq)△H=___ kJ•mol-1。
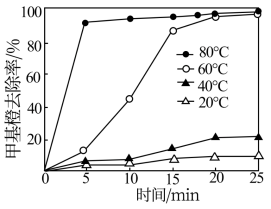
(2)为探究温度对Cu2+—H2O2甲基橙去除率的影响,某研究小组在不同温度下进行实验(其他条件相同),实验结果如图所示。相同条件下,温度升高,甲基橙去除率增大,其原因是___ 。
(3)为探究Fe2+—Cu2+—H2O2能够协同催化氧化降解甲基橙,某研究小组的实验结果如图所示。得出“Fe2+—Cu2+—H2O2催化氧化降解甲基橙效果优于单独加入Fe2+或Cu2+”结论的证据为___ 。
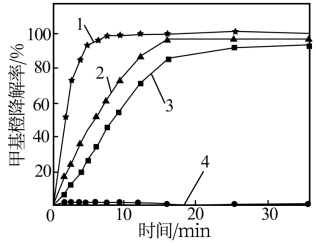
实验条件:200mL甲基橙模拟废水(1.5g•L-1,pH=3.0),温度60℃、V(H2O2)=2.0mL。
曲线1—V(H2O2):m(FeSO4):m(CuSO4)=2:0.02:0.4
曲线2—V(H2O2):m(FeSO4):m(CuSO4)=2:0.02:0
曲线3—V(H2O2):m(FeSO4):m(CuSO4)=2:0:0.4
曲线4—V(H2O2):m(FeSO4):m(CuSO4)=2:0:0
(1)Cu2+—H2O2体系中存在下列反应:
Cu2+(aq)+H2O2(aq)=CuOOH+(aq)+H+(aq) △H1=akJ/mol
CuOOH+(aq)=Cu+(aq)+•OH(aq)+
 O2(g) △H2=bkJ/mol
O2(g) △H2=bkJ/mol2CuOOH+(aq)=2Cu+(aq)+H2O2(aq)+O2(g) △H3=ckJ/mol
则H2O2(aq)=2•OH(aq)△H=
(2)为探究温度对Cu2+—H2O2甲基橙去除率的影响,某研究小组在不同温度下进行实验(其他条件相同),实验结果如图所示。相同条件下,温度升高,甲基橙去除率增大,其原因是

(3)为探究Fe2+—Cu2+—H2O2能够协同催化氧化降解甲基橙,某研究小组的实验结果如图所示。得出“Fe2+—Cu2+—H2O2催化氧化降解甲基橙效果优于单独加入Fe2+或Cu2+”结论的证据为

实验条件:200mL甲基橙模拟废水(1.5g•L-1,pH=3.0),温度60℃、V(H2O2)=2.0mL。
曲线1—V(H2O2):m(FeSO4):m(CuSO4)=2:0.02:0.4
曲线2—V(H2O2):m(FeSO4):m(CuSO4)=2:0.02:0
曲线3—V(H2O2):m(FeSO4):m(CuSO4)=2:0:0.4
曲线4—V(H2O2):m(FeSO4):m(CuSO4)=2:0:0
您最近一年使用:0次
名校
4 . 由下列实验操作及现象能得出相应结论的是
| 实验操作 | 现象 | 结论 | |
| A | 向KBr、KI混合溶液中依次加入少量氯水和CCl4,振荡,静置 | 溶液分层,下层呈紫红色 | 氧化性:Cl2>Br2>I2 |
| B | 在火焰上灼烧搅拌过某无色溶液的玻璃棒 | 火焰出现黄色 | 溶液中含Na元素 |
| C | 用pH计测定pH: ①NaHCO3溶液②CH3COONa溶液 | pH:①>② | H2CO3酸性弱于CH3COOH |
| D | 将一块未经打磨的铝片剪成相同的两小片,相同温度下分别投入5.0mL浓度均为2.0 mol∙L−1的CuSO4溶液和CuCl2溶液中 | CuSO4溶液中无明显现象;CuCl2溶液中反应剧烈,铝片表面有红色物质生成 | 则Cl-能加速破坏铝片表面的氧化膜 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
5 . 某化学小组运用控制变量法研究外界条件对化学反应速率的影响,做了如下实验。请按要求回答下列问题:
(1)室温下,探究影响 分解速率的因素,见下表和如图:
分解速率的因素,见下表和如图:
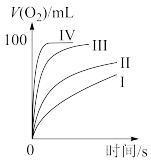
①表中x为_______ ;
②实验Ⅱ、Ⅲ探究的是_______ 对 分解速率的影响,根据图上图,得出的结论是
分解速率的影响,根据图上图,得出的结论是_______ 。
③根据上图,实验Ⅰ、Ⅳ对比得出的结论是_______ 。
(2)为进一步研究离子对 分解的影响,小组同学又做了比较
分解的影响,小组同学又做了比较 和
和 对
对 分解影响的下列实验:
分解影响的下列实验:
①定性分析:用如图装置可通过观察_______ ,定性得出结论。
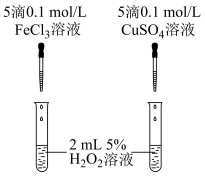
某同学认为将 溶液改为
溶液改为 溶液更合理,其理由是
溶液更合理,其理由是_______ .
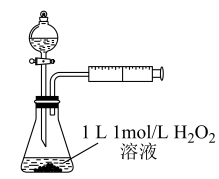
②定量分析:为了更精确地研究催化剂对反应速率的影响,利用如图装置进行定量实验。实验测得,在硫酸铜催化下过 发生分解反应,2min时生成气体1.12L(气体体积已换算为标准状况),则
发生分解反应,2min时生成气体1.12L(气体体积已换算为标准状况),则 的分解速率为
的分解速率为_______  。
。
(1)室温下,探究影响
 分解速率的因素,见下表和如图:
分解速率的因素,见下表和如图:
| 实验 | 所用试剂 | |
| Ⅰ | 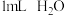 |  |
| Ⅱ | 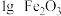 | 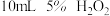 |
| Ⅲ | 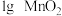 | 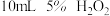 |
| Ⅳ |  | 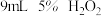 |
②实验Ⅱ、Ⅲ探究的是
 分解速率的影响,根据图上图,得出的结论是
分解速率的影响,根据图上图,得出的结论是③根据上图,实验Ⅰ、Ⅳ对比得出的结论是
(2)为进一步研究离子对
 分解的影响,小组同学又做了比较
分解的影响,小组同学又做了比较 和
和 对
对 分解影响的下列实验:
分解影响的下列实验:①定性分析:用如图装置可通过观察

某同学认为将
 溶液改为
溶液改为 溶液更合理,其理由是
溶液更合理,其理由是②定量分析:为了更精确地研究催化剂对反应速率的影响,利用如图装置进行定量实验。实验测得,在硫酸铜催化下过
 发生分解反应,2min时生成气体1.12L(气体体积已换算为标准状况),则
发生分解反应,2min时生成气体1.12L(气体体积已换算为标准状况),则 的分解速率为
的分解速率为 。
。
您最近一年使用:0次
2021-10-28更新
|
153次组卷
|
2卷引用:福建省南安市侨光中学2021-2022学年高二上学期第一次阶段考化学试题
名校
6 . “接触法制硫酸”的主要反应是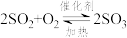 在催化剂表面的反应历程如下:
在催化剂表面的反应历程如下:
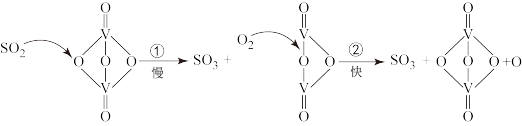
下列说法正确的是
 在催化剂表面的反应历程如下:
在催化剂表面的反应历程如下:
下列说法正确的是
| A.使用催化剂只能加快正反应速率 | B.该反应的催化剂是 |
| C.反应②的活化能比反应①大 | D.过程中有 键的形成 键的形成 |
您最近一年使用:0次
名校
解题方法
7 . 科学家致力于将大气中过多的 转化为有益于人类的物质,下图是一种可以从空气中捕获
转化为有益于人类的物质,下图是一种可以从空气中捕获 直接转化为甲醇的方法。下列说法正确的是。
直接转化为甲醇的方法。下列说法正确的是。
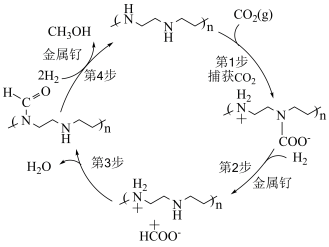
 转化为有益于人类的物质,下图是一种可以从空气中捕获
转化为有益于人类的物质,下图是一种可以从空气中捕获 直接转化为甲醇的方法。下列说法正确的是。
直接转化为甲醇的方法。下列说法正确的是。
A.从空气中每捕获 ,转移的电子数为 ,转移的电子数为 |
| B.第1步反应的原子利用率为100% |
| C.第4步反应中有极性键和非极性键的断裂和生成 |
D.该历程以金属钌、 作催化剂 作催化剂 |
您最近一年使用:0次
2021-10-12更新
|
358次组卷
|
5卷引用:福建省南平市高级中学2021-2022学年高三上学期第三次月考化学试题
福建省南平市高级中学2021-2022学年高三上学期第三次月考化学试题重庆市2022届高三第二次质量检测化学试题重庆市南开中学2022届高三第二次(10月)质量检测化学试题辽宁省渤海大学附属高级中学2021-2022学年高三上学期第三次考试化学试题(已下线)押新高考卷11题 反应机理分析-备战2022年高考化学临考题号押题(新高考通版)
名校
8 . 利用如图实验装置进行相应实验,能达到实验目的的是
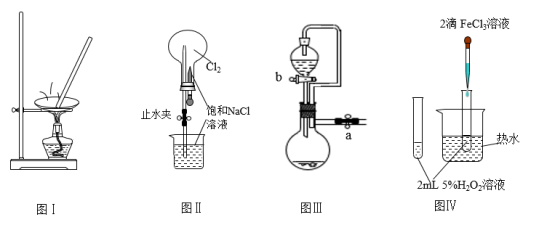
| A.利用图Ⅰ装置蒸发KCl溶液制备无水KCl |
| B.利用图Ⅱ装置进行喷泉实验 |
| C.图Ⅲ装置中,关闭a、打开b,可检查装置的气密性 |
D.利用图Ⅳ装置验证 分解反应有催化作用 分解反应有催化作用 |
您最近一年使用:0次
2021-10-11更新
|
507次组卷
|
6卷引用:福建省莆田市第二中学2022届高三10月月考化学试题
福建省莆田市第二中学2022届高三10月月考化学试题福建省泉州市城东中学2021-2022学年高三上学期10月月考化学试题福建省福州市六校联考2022-2023学年高一下学期期末考试化学试题四川省宜宾市叙州区第二中学校2023-2024学年高二上学期12月月考化学试题(已下线)提升卷02-【新高考新题型】2022年高考化学选择题标准化练习20卷(山东专用)(已下线)综合01 期末压轴80题之选择题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(人教版2019必修第二册)
名校
9 . 为了探究外界条件对过氧化氢分解速率的影响,某化学兴趣小组的同学做了以下实验。请回答下列问题:
(1)实验①的目的是___ 。
(2)实验②未观察到预期的实验现象,为了帮助该组同学达到实验目的,你提出的对上述操作的改进意见是____ (用实验中所提供的几种试剂)。
(3)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该兴趣化学小组的同学分别设计了如图所示的实验。请回答相关问题:
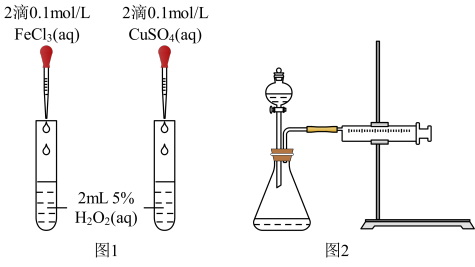
①定性分析:如图1可通过观察____ ,定性比较得出结论;该实验中将FeCl3溶液改为Fe2(SO4)3溶液的原因是___ 。
②定量分析:用图2所示装置做对照试验,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是___ 。
(4)MnO2对H2O2分解反应也有催化作用,另一个同学用图2装置,将状态不同的1gMnO2分别加入盛有30mL等浓度的H2O2溶液的锥形瓶中,产生气体进入注射器针筒中,记录结果如下:
①实验结果表明,催化剂的催化效果与___ 有关。
②实验过程中放出气体的体积(标准状况)和时间的关系如图所示。解释反应速率变化的原因___ 。
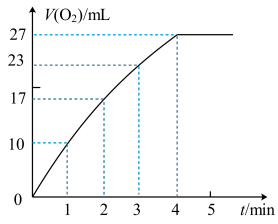
| 编号 | 实验操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL5%H2O2溶液,各滴入3滴FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 | 试管A中不再产生气泡;试管B中产生的气泡量增多 |
| ② | 另取两支试管分别加入5mL5%H2O2溶液和5mL10%H2O2溶液 | 两支试管中均未明显见到有气泡产生 |
(2)实验②未观察到预期的实验现象,为了帮助该组同学达到实验目的,你提出的对上述操作的改进意见是
(3)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该兴趣化学小组的同学分别设计了如图所示的实验。请回答相关问题:

①定性分析:如图1可通过观察
②定量分析:用图2所示装置做对照试验,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是
(4)MnO2对H2O2分解反应也有催化作用,另一个同学用图2装置,将状态不同的1gMnO2分别加入盛有30mL等浓度的H2O2溶液的锥形瓶中,产生气体进入注射器针筒中,记录结果如下:
| MnO2状态 | 触摸锥形瓶情况 | 该温度下针筒内收集到气体的体积 | 所需时间 |
| 粉末状 | 很烫 | 30mL | 3min |
| 块状 | 微热 | 30mL | 9min |
②实验过程中放出气体的体积(标准状况)和时间的关系如图所示。解释反应速率变化的原因
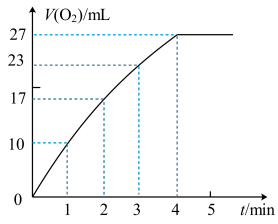
您最近一年使用:0次
名校
解题方法
10 . 以二氧化钛表面覆盖Cu2Al2O4为催化剂,可将CO2和CH4直接转化成乙酸,如图为反应过程中催化剂的催化效率(实线)与乙酸的生成速率(虚线)随温度的变化情况。下列说法不正确的是
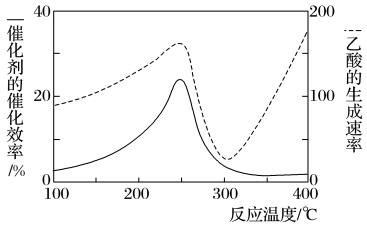

| A.该制备乙酸的反应中,原子利用率为100% |
| B.Cu2Al2O4写成氧化物的形式是Cu2O·Al2O3 |
| C.由图可知,工业上制备乙酸最适宜的温度应为250℃或者400℃ |
| D.250~300℃时,温度升高而乙酸的生成速率降低的主要原因是催化剂的催化效率降低 |
您最近一年使用:0次



