1 . 18O标记的乙酸甲酯在足量NaOH溶液中发生水解,部分反应历程可表示为如下所示:
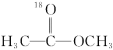 +OH-
+OH-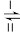
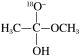
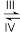
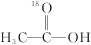 +CH3O-
+CH3O-
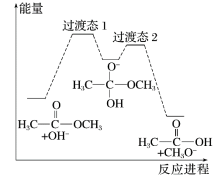
已知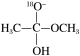

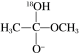 为快速平衡,下列说法正确的是
为快速平衡,下列说法正确的是
| A.反应Ⅱ、Ⅲ为决速步 |
| B.反应结束后,溶液中存在18OH- |
| C.反应结束后,溶液中存在CH318OH |
| D.反应Ⅰ与反应Ⅳ活化能的差值等于图示总反应的焓变 |
您最近一年使用:0次
2 .  催化重整能够有效去除大气中的
催化重整能够有效去除大气中的 ,是实现“碳中和”的重要途径之一,发生的反应如下:
,是实现“碳中和”的重要途径之一,发生的反应如下:
重整反应:
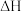
积炭反应I: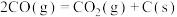

积炭反应II:

在恒压、起始投料比 条件下,体系中含碳组分平衡时的物质的量随温度变化关系曲线如图所示。下列说法正确的是
条件下,体系中含碳组分平衡时的物质的量随温度变化关系曲线如图所示。下列说法正确的是
 催化重整能够有效去除大气中的
催化重整能够有效去除大气中的 ,是实现“碳中和”的重要途径之一,发生的反应如下:
,是实现“碳中和”的重要途径之一,发生的反应如下:重整反应:

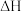
积炭反应I:
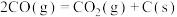

积炭反应II:


在恒压、起始投料比
 条件下,体系中含碳组分平衡时的物质的量随温度变化关系曲线如图所示。下列说法正确的是
条件下,体系中含碳组分平衡时的物质的量随温度变化关系曲线如图所示。下列说法正确的是
| A.升高温度积碳反应I,正反应速率减小,逆反应速率增大,平衡逆向移动 |
B.曲线B表示 平衡时物质的量随温度的变化 平衡时物质的量随温度的变化 |
C.积炭会导致催化剂失活,降低 的平衡转化率 的平衡转化率 |
D.低于600℃时,降低温度有利于减少积炭的量并去除 气体 气体 |
您最近一年使用:0次
名校
3 . 工业上常采用氨氧化法制硝酸,其流程是将氨和空气混合后通入灼热的铂铑合金网,反应生成NO(g),生成的一氧化氮与残余的氧气继续反应生成二氧化氮:2NO(g)+O2(g) = 2NO2(g);ΔH = -116.4 kJ·mol-1。随后将二氧化氮通入水中制取硝酸。对于反应2NO(g)+O2(g)  2NO2(g),下列说法正确的是
2NO2(g),下列说法正确的是
 2NO2(g),下列说法正确的是
2NO2(g),下列说法正确的是| A.该反应能够自发的原因是ΔS > 0 |
| B.工业上使用合适的催化剂可提高NO2的生产效率 |
| C.升高温度,该反应V(逆)减小,V(正)增大,平衡向逆反应方向移动 |
| D.2 mol NO(g)和1 mol O2(g)中所含化学键能总和比2 mol NO2(g)中大116.4 kJ·mol-1 |
您最近一年使用:0次
4 . N2O是温室气体之一、CO和N2O在Fe+作用下转化为N2和CO2,反应的能量变化及反应历程如图所示,两步基元反应为:①Fe++N2O=N2+FeO+、K1,②FeO++CO=Fe++CO2、K2。下列说法正确的是
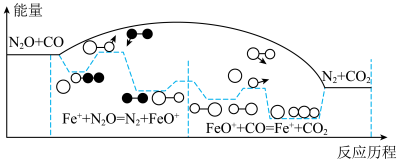

| A.该反应△H>0 |
| B.升高温度,将降低N2O的平衡转化率 |
| C.两步反应中,决定总反应速率的是反应② |
| D.Fe+既改变反应历程,也改变了反应的△H |
您最近一年使用:0次
2024-03-08更新
|
84次组卷
|
2卷引用:贵州省贵阳市白云区第二高级中学2023-2024学年高三上学期质量监测化学试卷
名校
5 . 氢气是一种理想的绿色清洁能源,氢气的制取是氢能源利用领域的研究热点。
(1)用氧缺位铁酸铜(CuFe2O4-x)作催化剂,利用太阳能热化学循环分解H2O可制H2。
①氧缺位铁酸铜通过两步反应分解水制氢。已知第二步反应为2CuFe2O4=2CuFe2O4-x+xO2↑,则第一步反应的化学方程式为___________ 。
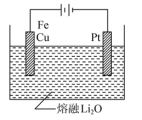
②CuFe2O4可用电化学方法得到,其原理如图所示,则阳极的电极反应式为___________ 。
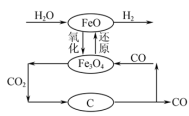
(2)可利用FeO/Fe3O4之间的相互转化,来裂解水制取氢气,其制氢流程如图所示。该工艺制氢的总反应为C(s)+H2O(g)=CO(g)+H2(g),对比水和碳在高温下直接接触反应制氢,分析该工艺制氢的最大优点是___________ 。
(3)硼氢化钠(NaBH4)的强碱溶液在催化剂作用下与水反应可获取氢气,其可能反应机理如图所示。已知:常温下,NaB(OH)4在水中的溶解度不大,易以NaBO2形式结晶析出。
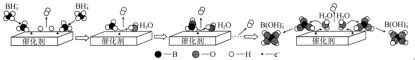
①若用D2O代替H2O,依据反应机理,则反应后生成的气体中含有___________ 。
②其他条件相同时,测得平均每克催化剂使用量下,NaBH4的浓度和放氢速率的变化关系如图所示。随着NaBH4浓度的增大,放氢速率先增大后减小,导致放氢速率下降的原因可能是___________ 。

(1)用氧缺位铁酸铜(CuFe2O4-x)作催化剂,利用太阳能热化学循环分解H2O可制H2。
①氧缺位铁酸铜通过两步反应分解水制氢。已知第二步反应为2CuFe2O4=2CuFe2O4-x+xO2↑,则第一步反应的化学方程式为
②CuFe2O4可用电化学方法得到,其原理如图所示,则阳极的电极反应式为

(2)可利用FeO/Fe3O4之间的相互转化,来裂解水制取氢气,其制氢流程如图所示。该工艺制氢的总反应为C(s)+H2O(g)=CO(g)+H2(g),对比水和碳在高温下直接接触反应制氢,分析该工艺制氢的最大优点是

(3)硼氢化钠(NaBH4)的强碱溶液在催化剂作用下与水反应可获取氢气,其可能反应机理如图所示。已知:常温下,NaB(OH)4在水中的溶解度不大,易以NaBO2形式结晶析出。

①若用D2O代替H2O,依据反应机理,则反应后生成的气体中含有
②其他条件相同时,测得平均每克催化剂使用量下,NaBH4的浓度和放氢速率的变化关系如图所示。随着NaBH4浓度的增大,放氢速率先增大后减小,导致放氢速率下降的原因可能是

您最近一年使用:0次
名校
6 . 二维锑片(Sb)是一种新型的CO2电化学还原催化剂。酸性条件下,人工固碳装置中的CO2气体在二维锑片表面发生三种催化竞争反应,其反应历程如下图所示(*表示吸附态中间体)。下列说法不正确 的是
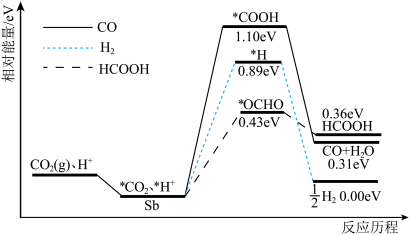

| A.三种催化竞争的总反应中,生成HCOOH吸收的能量最多 |
| B.在二维锑片表面生成CO的反应可表示为*CO2+*H++2e−=CO+H2O |
| C.使用二维锑片可以改变反应的路径 |
| D.生成各种不同的产物时,有极性键和非极性键形成 |
您最近一年使用:0次
7 . 二氧化碳合成二甲醚的主要反应有:
Ⅰ.
Ⅱ.
Ⅲ.
一定温度下,将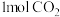 、
、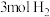 和双催化剂(通常由甲醇合成催化剂和甲醇脱水制醚催化剂组成),加入1L密闭容器中充分接触反应,测得各产物占所有含碳物质的物质的量分数(例:CO的物质的量分数
和双催化剂(通常由甲醇合成催化剂和甲醇脱水制醚催化剂组成),加入1L密闭容器中充分接触反应,测得各产物占所有含碳物质的物质的量分数(例:CO的物质的量分数 )随时间变化如图所示
)随时间变化如图所示
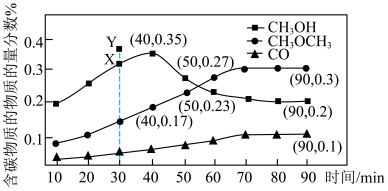
下列说法正确的是
Ⅰ.

Ⅱ.

Ⅲ.

一定温度下,将
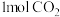 、
、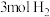 和双催化剂(通常由甲醇合成催化剂和甲醇脱水制醚催化剂组成),加入1L密闭容器中充分接触反应,测得各产物占所有含碳物质的物质的量分数(例:CO的物质的量分数
和双催化剂(通常由甲醇合成催化剂和甲醇脱水制醚催化剂组成),加入1L密闭容器中充分接触反应,测得各产物占所有含碳物质的物质的量分数(例:CO的物质的量分数 )随时间变化如图所示
)随时间变化如图所示
下列说法正确的是
A.40min前, |
| B.30min时,使用活性更高的甲醇合成催化剂,有可能使图中的X点升至Y点 |
C.40min后, 物质的量分数减小,原因可能是反应Ⅰ向逆反应方向移动 物质的量分数减小,原因可能是反应Ⅰ向逆反应方向移动 |
D.90min时, 的转化率为60% 的转化率为60% |
您最近一年使用:0次
解题方法
8 . 实验小组探究Cu和 溶液的反应原理。
溶液的反应原理。
(1)配制溶液
用 标准试剂配制
标准试剂配制 溶液,下列仪器中无需使用的有
溶液,下列仪器中无需使用的有_______ (填名称)。
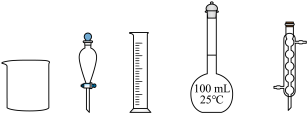
(2)测定 溶液的pH
溶液的pH
用_______ (填仪器名称)测得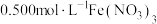 溶液的pH为1.10。
溶液的pH为1.10。
(3)提出假设
假设ⅰ:_______ ,反应的离子方程式为:
假设ⅱ: 将Cu氧化,反应的离子方程式为:
将Cu氧化,反应的离子方程式为:
(4)实验探究
实验Ⅰ:向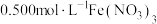 溶液中加入过量铜粉并充分振荡,溶液变成深棕色,无气泡产生。实验小组取少量上层清液于另一洁净试管中,往其中滴加
溶液中加入过量铜粉并充分振荡,溶液变成深棕色,无气泡产生。实验小组取少量上层清液于另一洁净试管中,往其中滴加_______ (填化学式)溶液,观察到_______ 的实验现象,证明了反应中有 生成。
生成。
实验Ⅱ:向pH=1.10的_______ (填化学式)溶液中加入过量铜粉并充分振荡,无明显现象。
探究结论:综合“实验Ⅰ”和“实验Ⅱ”可知,假设_______ (填“ⅰ”或“ⅱ”)成立。
(5)查阅资料知,铜粉与 溶液可能涉及的反应有;
溶液可能涉及的反应有;
反应①: ;
;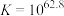 ;速率很慢。
;速率很慢。
反应②: ;
;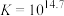 ,速率较快。
,速率较快。
反应③: ;
;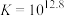 ;速率很快。
;速率很快。
反应④: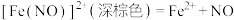
(a)对反应①来说, 起到的作用为
起到的作用为_______ ;为验证这一作用,设计的实验方案为_______ 。
(b)“实验Ⅰ”反应中无论Cu过量多少,始终都能检测到 的存在,原因是
的存在,原因是_______ 。
 溶液的反应原理。
溶液的反应原理。(1)配制溶液
用
 标准试剂配制
标准试剂配制 溶液,下列仪器中无需使用的有
溶液,下列仪器中无需使用的有
(2)测定
 溶液的pH
溶液的pH用
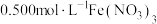 溶液的pH为1.10。
溶液的pH为1.10。(3)提出假设
假设ⅰ:

假设ⅱ:
 将Cu氧化,反应的离子方程式为:
将Cu氧化,反应的离子方程式为:
(4)实验探究
实验Ⅰ:向
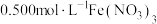 溶液中加入过量铜粉并充分振荡,溶液变成深棕色,无气泡产生。实验小组取少量上层清液于另一洁净试管中,往其中滴加
溶液中加入过量铜粉并充分振荡,溶液变成深棕色,无气泡产生。实验小组取少量上层清液于另一洁净试管中,往其中滴加 生成。
生成。实验Ⅱ:向pH=1.10的
探究结论:综合“实验Ⅰ”和“实验Ⅱ”可知,假设
(5)查阅资料知,铜粉与
 溶液可能涉及的反应有;
溶液可能涉及的反应有;反应①:
 ;
;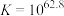 ;速率很慢。
;速率很慢。反应②:
 ;
;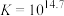 ,速率较快。
,速率较快。反应③:
 ;
;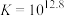 ;速率很快。
;速率很快。反应④:
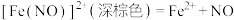
(a)对反应①来说,
 起到的作用为
起到的作用为(b)“实验Ⅰ”反应中无论Cu过量多少,始终都能检测到
 的存在,原因是
的存在,原因是
您最近一年使用:0次
名校
解题方法
9 . 为应对全球气候问题,实现碳达峰、碳中和。科学家使用TiO2/Cu的络合物作催化剂,用多聚物来捕获CO2,使 CO2与H2在催化剂表面生成 CH3OH和H2O,反应可能的历程机理如图所示。下列叙述错误的是


| A.反应历程中催化剂只参与中间反应 |
| B.Step1 和Step3 的反应是非氧化还原反应 |
| C.反应过程中多聚胺中氮元素化合价发生了变化 |
D.总反应方程式为 CO2+3H2 CH3OH+H2O CH3OH+H2O |
您最近一年使用:0次
名校
解题方法
10 .  催化剂光助一芬顿反应用于漂白有机染料的一种机理如图所示,其中包括①②光激发产生光电子与光生空穴(
催化剂光助一芬顿反应用于漂白有机染料的一种机理如图所示,其中包括①②光激发产生光电子与光生空穴( ,具有很强的得电子能力)、③④空穴氧化、⑥超氧自由基氧化、⑦光生电子还原铁离子等。下列说法正确的是
,具有很强的得电子能力)、③④空穴氧化、⑥超氧自由基氧化、⑦光生电子还原铁离子等。下列说法正确的是

 催化剂光助一芬顿反应用于漂白有机染料的一种机理如图所示,其中包括①②光激发产生光电子与光生空穴(
催化剂光助一芬顿反应用于漂白有机染料的一种机理如图所示,其中包括①②光激发产生光电子与光生空穴( ,具有很强的得电子能力)、③④空穴氧化、⑥超氧自由基氧化、⑦光生电子还原铁离子等。下列说法正确的是
,具有很强的得电子能力)、③④空穴氧化、⑥超氧自由基氧化、⑦光生电子还原铁离子等。下列说法正确的是
A.反应⑤每消耗1mol  ,共转移4mol ,共转移4mol 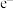 |
| B.反应⑨中双氧水将颜料直接氧化成无色物质 |
C.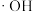 、 、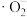 和 和 在漂白颜料时体现了强还原性 在漂白颜料时体现了强还原性 |
| D.催化剂可以降低反应活化能,提高单位体积内活化分子百分数 |
您最近一年使用:0次
2024-02-26更新
|
204次组卷
|
2卷引用:江西省五市九校协作体2023-2024学年高三上学期第一次联考化学试题



