名校
解题方法
1 . MTP是一类重要的药物中间体,可以由TOME经环化后合成。其反应式如下所示:
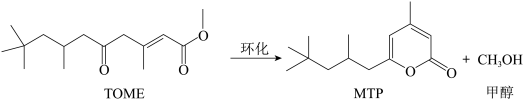
为了提高TOME的转化率,反应进行时需及时从溶液体系中移出部分甲醇。TOME的转化率随反应时间的变化如图所示。设TOME的初始浓度为a mol/L,反应过程中的液体体积变化忽略不计,发生的其他副反应忽略不计。

已知:转化率= ,也可以用百分数表示。下列说法错误的是
,也可以用百分数表示。下列说法错误的是

为了提高TOME的转化率,反应进行时需及时从溶液体系中移出部分甲醇。TOME的转化率随反应时间的变化如图所示。设TOME的初始浓度为a mol/L,反应过程中的液体体积变化忽略不计,发生的其他副反应忽略不计。

已知:转化率=
 ,也可以用百分数表示。下列说法错误的是
,也可以用百分数表示。下列说法错误的是| A.X、Y两点消耗反应物TOME的速率v正(X)<v正(Y) |
| B.X、Z两点该化学反应的瞬时速率大小为v(X)>v(Z) |
C.210℃时,0~150 min之间用MTP表示该化学反应的速率为 |
D.若Z点处于化学平衡,则平衡时溶液体系中甲醇的百分含量为 |
您最近一年使用:0次
名校
解题方法
2 . 实验室中模拟合成氨反应: 在恒容密闭容器中,初始投入量相等的条件下,得到三组实验数据如表所示:
在恒容密闭容器中,初始投入量相等的条件下,得到三组实验数据如表所示:
下列有关说法不正确的是
 在恒容密闭容器中,初始投入量相等的条件下,得到三组实验数据如表所示:
在恒容密闭容器中,初始投入量相等的条件下,得到三组实验数据如表所示:| 实验序号 | 温度( ) ) |  浓度( 浓度( ) ) | ||||||
 |  |  |  |  | 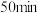 | 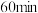 | ||
| 1 | 300 | 2.00 | 1.70 | 1.50 | 1.36 | 1.25 | 1.20 | 1.20 |
| 2 | 300 | 2.00 | 1.50 | 1.28 | 1.20 | 1.20 | 1.20 | 1.20 |
| 3 | 200 | 2.00 | 1.60 | 1.39 | 1.29 | 1.27 | 1.27 | 1.27 |
| A.当容器内的压强不再改变时,说明该可逆反应已达到化学平衡状态 |
B.实验2中,前 内以 内以 的浓度变化表示的化学反应速率为 的浓度变化表示的化学反应速率为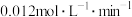 |
| C.比较实验1和2,说明实验2使用了更高效的催化剂 |
D.实验3中, 时向容器中充入一定量 时向容器中充入一定量 ,则正反应速率 ,则正反应速率 不变 不变 |
您最近一年使用:0次
2021-09-03更新
|
3953次组卷
|
12卷引用:浙江省“精诚联盟”2021-2022学年高二上学期返校考试化学试题
浙江省“精诚联盟”2021-2022学年高二上学期返校考试化学试题(已下线)第2章 化学反应速率与化学平衡(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)(已下线)第二单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)章末培优2 专题2 化学反应速率与化学平衡-2021-2022学年高二化学课后培优练(苏教教版2019选择性必修1)(已下线)2022年浙江省6月高考真题变式题11-20浙江省金华市江南中学等两校2022-2023学年高二上学期12月阶段测试化学试题重庆市万州第二高级中学2022-2023学年高二上学期12月线上考试化学试题福建省泉州市第六中学2022-2023学年高二上学期期中考化学试题江西省新余市第一中学2022-2023高二上学期期末考试化学试题(已下线)【知识图鉴】单元讲练测选择性必修1第2单元03巩固练吉林省长春外国语学校2022-2023学年高二上学期期末考试化学试卷四川省眉山市仁寿县2023-2024学年高二上学期1月期末联考化学试题
名校
解题方法
3 . 磷灰石的主要成分是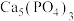 ,用磷灰石制备FePO4的流程如下:
,用磷灰石制备FePO4的流程如下:

下列说法错误的是
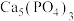 ,用磷灰石制备FePO4的流程如下:
,用磷灰石制备FePO4的流程如下:
下列说法错误的是
| A.用H3PO4溶液、H2SO4溶液分步浸取磷灰石比只用H2SO4溶液好 |
| B.用酸对磷灰石进行酸浸时,可用玻璃棒不断地搅拌使HF快速挥发 |
| C.用加热、矿石粉碎、搅拌、适当提高酸的浓度等方法来提高酸浸的效率 |
| D.加入“FeSO4,H2O2,调节pH”的过程中,加入H2O2的目的是氧化Fe2+ |
您最近一年使用:0次
名校
4 . 鱼浮灵是一种化学增氧剂,主要成分为过氧碳酸钠(2Na2CO3·3H2O2),分别在等体积双氧水中加入少量Na2CO3、NaCl和NaOH固体探究鱼浮灵增氧原理,实验结果如图所示。下列说法不正确 的是
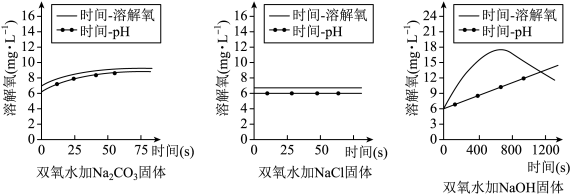

| A.Na2CO3对H2O2的分解有促进作用 | B.加入NaCl后溶液溶解氧变化不明显 |
| C.H2O2分解随pH增大而持续加快 | D.鱼浮灵使用时应根据pH控制投放量 |
您最近一年使用:0次
2022-06-22更新
|
296次组卷
|
5卷引用:浙江省宁波效实中学2021-2022学年高一下学期期中考试化学(选考)试题
20-21高三下·浙江·阶段练习
5 . 合成氨工业是人工固氮的重要途径,氨气是工农业生产中的重要物质。请回答以下问题:
(1)下列说法不正确的是___________
A.实验室制备氨气时,可以用CaCl2固体干燥氨气
B.在浓氨水中加入生石灰可制备少量氨气
C.合成氨塔中,需要有热交换装置,便于能量的有效利用
D.合成氨工业中,可将氨气液化,并不断将液氨移去,利于提高NH3的产率
(2)氨是制取硝酸的重要原料。氨的催化氧化过程主要有以下两个反应:
I.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔHI
4NO(g)+6H2O(g) ΔHI
II.4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔHII
2N2(g)+6H2O(g) ΔHII
不同温度下氨氧化的平衡常数如下(p=0.1013Mpa):
①下列说法正确的是___________
A.ΔHI>0,ΔHII>0
B.如果对反应不加控制,氨和氧气反应的最终产物主要是N2
C.为使反应有利于朝生成更多的NO方向进行,不必关注热力学问题(平衡移动问题),需要关注动力学问题(反应速率问题)
D.在实际生产中,需采用高压氧化,以利于提高NO的产率
E.反应中需控制氨氧比、选择性催化剂的形状、气固相接触时间等
②在实际工业生产中,温度一般需要在750℃~850℃左右,其主要原因是___________
(3)已知可通过下列方法合成尿素:
第一步:2NH3(1)+CO2(g) H2NCOONH4(1) ΔH=-159.5kJ/mol
H2NCOONH4(1) ΔH=-159.5kJ/mol
第二步:H2NCOONH4(1) CO(NH2)2(1)+H2O(1) ΔH=+28.5kJ/mol
CO(NH2)2(1)+H2O(1) ΔH=+28.5kJ/mol
在体积为5L的密闭容器中加入1molCO2和4molNH3,在一定条件下反应进行到10min时,测得CO2和尿素的物质的量均为0.25mol,如图所示。
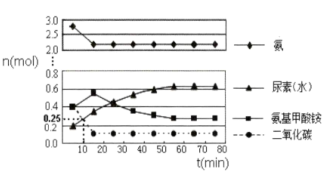
①若用单位时间内物质的量的变化来表示固体或纯液体的反应速率,则10min内第一步反应中生成H2NCOONH4(1)[氨基甲酸铵]的平均反应速率为___________
②反应进行15分钟后,随着时间的变化,尿素和氨基甲酸铵的物质的量变化比较明显,但氨气和二氧化碳的变化很小,其主要原因是___________ 。
(1)下列说法不正确的是
A.实验室制备氨气时,可以用CaCl2固体干燥氨气
B.在浓氨水中加入生石灰可制备少量氨气
C.合成氨塔中,需要有热交换装置,便于能量的有效利用
D.合成氨工业中,可将氨气液化,并不断将液氨移去,利于提高NH3的产率
(2)氨是制取硝酸的重要原料。氨的催化氧化过程主要有以下两个反应:
I.4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) ΔHI
4NO(g)+6H2O(g) ΔHIII.4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) ΔHII
2N2(g)+6H2O(g) ΔHII不同温度下氨氧化的平衡常数如下(p=0.1013Mpa):
| 温度(℃) | 300 | 500 | 700 | 900 | 1100 |
| 反应I(KI) | 6.3×1041 | 1.1×1026 | 2.1×1019 | 3.8×1015 | 3.4×1011 |
| 反应II(KII) | 7.3×1056 | 7.1×1034 | 2.6×1025 | 1.5×1020 | 6.7×1016 |
A.ΔHI>0,ΔHII>0
B.如果对反应不加控制,氨和氧气反应的最终产物主要是N2
C.为使反应有利于朝生成更多的NO方向进行,不必关注热力学问题(平衡移动问题),需要关注动力学问题(反应速率问题)
D.在实际生产中,需采用高压氧化,以利于提高NO的产率
E.反应中需控制氨氧比、选择性催化剂的形状、气固相接触时间等
②在实际工业生产中,温度一般需要在750℃~850℃左右,其主要原因是
(3)已知可通过下列方法合成尿素:
第一步:2NH3(1)+CO2(g)
 H2NCOONH4(1) ΔH=-159.5kJ/mol
H2NCOONH4(1) ΔH=-159.5kJ/mol第二步:H2NCOONH4(1)
 CO(NH2)2(1)+H2O(1) ΔH=+28.5kJ/mol
CO(NH2)2(1)+H2O(1) ΔH=+28.5kJ/mol在体积为5L的密闭容器中加入1molCO2和4molNH3,在一定条件下反应进行到10min时,测得CO2和尿素的物质的量均为0.25mol,如图所示。

①若用单位时间内物质的量的变化来表示固体或纯液体的反应速率,则10min内第一步反应中生成H2NCOONH4(1)[氨基甲酸铵]的平均反应速率为
②反应进行15分钟后,随着时间的变化,尿素和氨基甲酸铵的物质的量变化比较明显,但氨气和二氧化碳的变化很小,其主要原因是
您最近一年使用:0次
名校
解题方法
6 . Burns和Dainton研究发现 与
与 合成
合成 的反应机理如下:①
的反应机理如下:① 快;②
快;② 快;③
快;③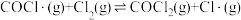 慢。其中反应②存在
慢。其中反应②存在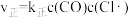 、
、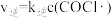 。下列说法不正确的是
。下列说法不正确的是
 与
与 合成
合成 的反应机理如下:①
的反应机理如下:① 快;②
快;② 快;③
快;③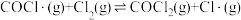 慢。其中反应②存在
慢。其中反应②存在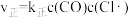 、
、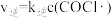 。下列说法不正确的是
。下列说法不正确的是| A.反应①的活化能小于反应③的活化能 |
B.反应②的平衡常数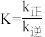 |
C.要提高合成 的速率,关键是提高反应③的速率 的速率,关键是提高反应③的速率 |
D.选择合适的催化剂能加快该反应的速率,并提高 的平衡产率 的平衡产率 |
您最近一年使用:0次
2021-12-04更新
|
287次组卷
|
2卷引用:吉林省长春市东北师大附中2021-2022学年高二上学期阶段测试化学试题
名校
7 . 处理、回收CO是环境科学家研究的热点课题。CO用于处理大气污染物N2O,发生的反应为:N2O(g)+CO(g)  CO2(g)+N2(g) ΔH=-365 kJ·mol-1。上述反应可用“Fe+”作催化剂,其总反应分两步进行:
CO2(g)+N2(g) ΔH=-365 kJ·mol-1。上述反应可用“Fe+”作催化剂,其总反应分两步进行:
第一步:Fe++N2O=FeO++N2;
第二步:FeO++CO=Fe++CO2,第二步反应不影响总反应达到平衡所用的时间。
下列说法中正确的是
 CO2(g)+N2(g) ΔH=-365 kJ·mol-1。上述反应可用“Fe+”作催化剂,其总反应分两步进行:
CO2(g)+N2(g) ΔH=-365 kJ·mol-1。上述反应可用“Fe+”作催化剂,其总反应分两步进行:第一步:Fe++N2O=FeO++N2;
第二步:FeO++CO=Fe++CO2,第二步反应不影响总反应达到平衡所用的时间。
下列说法中正确的是
| A.FeO+也是该反应的催化剂 |
| B.第一步中Fe+与N2O的碰撞仅部分有效 |
| C.第二步反应速率大于第一步反应速率 |
| D.增大CO的浓度可显著增大处理N2O的反应速率 |
您最近一年使用:0次
2020-11-05更新
|
210次组卷
|
2卷引用:湖北省四地六校2020-2021学年高二上学期联合考试化学试题
名校
8 . 碘在科研与生活中有重要应用。某兴趣小组用 淀粉溶液
淀粉溶液

 等式剂,探究反应条件对化学反应速率的影响。
等式剂,探究反应条件对化学反应速率的影响。
已知: (慢)
(慢)
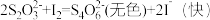
结合表中数据判断下列说法错误的是
 淀粉溶液
淀粉溶液

 等式剂,探究反应条件对化学反应速率的影响。
等式剂,探究反应条件对化学反应速率的影响。已知:
 (慢)
(慢)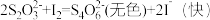
结合表中数据判断下列说法错误的是
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | |
试剂用量/ |  | 10.0 | 5.0 | 2.5 | 10.0 | 10.0 |
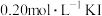 | 10.0 | 10.0 | 10.0 | 5.0 | 2.5 | |
 | 4.0 | 4.0 | 4.0 | 4.0 | 4.0 | |
 淀粉溶液 淀粉溶液 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | |
| 蒸馏水 | 0.0 | a | 7.5 | b | 7.5 | |
显色时间 | 35 | 21 | 123 | 56 | 107 | |
A.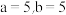 |
B.实验Ⅰ中,用 表示的反应速率为 表示的反应速率为 |
| C.反应液初始浓度越大,反应时间越短,平均反应速率越大 |
D.为确保能观察到蓝色,需满足的关系为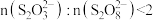 |
您最近一年使用:0次
2021-03-22更新
|
387次组卷
|
3卷引用:河北省石家庄市第二十七中学2021届高三诊断大联考化学试题
河北省石家庄市第二十七中学2021届高三诊断大联考化学试题(已下线)专题21 化学反应速率(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练湖南省邵东市第一中学2023-2024学年高二上学期10月月考化学试题
9 . 硫代硫酸钠与稀硫酸发生反应: (未配平)。在4只小烧杯中分别加入
(未配平)。在4只小烧杯中分别加入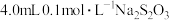 溶液与
溶液与 的稀硫酸。改变下表所示的条件:
的稀硫酸。改变下表所示的条件:
下列说法不正确的是
 (未配平)。在4只小烧杯中分别加入
(未配平)。在4只小烧杯中分别加入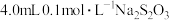 溶液与
溶液与 的稀硫酸。改变下表所示的条件:
的稀硫酸。改变下表所示的条件:| 小烧杯编号 | 小烧杯中新加入的物质 | 温度/℃ |
| i | 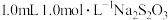 溶液 溶液 | 20 |
| ii | 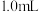 蒸馏水 蒸馏水 | 20 |
| iii | 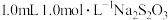 溶液 溶液 | 50 |
| iv | 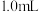 蒸馏水 蒸馏水 | 50 |
| A.i与ii对比可探究浓度对反应速率的影响 |
| B.i与iii对比可探究温度对反应速率的影响 |
C.生成沉淀的速率大小: |
| D.增大浓度、升高温度,反应速率增大 |
您最近一年使用:0次
解题方法
10 . 工业上利用 对烟道气进行脱硝(除氮氧化物)的SCR技术具有效率高、性能可靠的优势。SCR技术的原理为
对烟道气进行脱硝(除氮氧化物)的SCR技术具有效率高、性能可靠的优势。SCR技术的原理为 和NO在催化剂(
和NO在催化剂( )表面转化为
)表面转化为 和
和 ,反应进程中的相对能量变化如图所示。下列说法错误的是
,反应进程中的相对能量变化如图所示。下列说法错误的是

 对烟道气进行脱硝(除氮氧化物)的SCR技术具有效率高、性能可靠的优势。SCR技术的原理为
对烟道气进行脱硝(除氮氧化物)的SCR技术具有效率高、性能可靠的优势。SCR技术的原理为 和NO在催化剂(
和NO在催化剂( )表面转化为
)表面转化为 和
和 ,反应进程中的相对能量变化如图所示。下列说法错误的是
,反应进程中的相对能量变化如图所示。下列说法错误的是
A.总反应方程式为 |
B.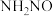 是脱硝反应的活性中间体 是脱硝反应的活性中间体 |
| C.升高温度,脱硝反应的正反应速率的增大程度大于其逆反应速率的增大程度 |
| D.决定反应速率的步骤是“H的移除” |
您最近一年使用:0次
2021-03-04更新
|
646次组卷
|
7卷引用:河北省名校联盟2021届高三下学期开学考试(新高考)化学试题
河北省名校联盟2021届高三下学期开学考试(新高考)化学试题福建省名校联盟2021届高三下学期开学考试(新高考)化学试题(已下线)考点17 化学反应速率及其影响因素-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点17 化学反应速率及其影响因素-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题10 化学反应速率与化学平衡-备战2022年高考化学学霸纠错(全国通用)(已下线)专题13 反应机理图(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(已下线)专题二 化学反应机理图象(练)



