名校
1 . 在一定条件下,[Zn(CN)4]2-与甲醛发生如下反应:[Zn(CN)4]2-+4HCHO+4H2O=[Zn(OH)4]2-+4HOCH2CN
已知:ⅰ. HCN为剧毒、易挥发的气体,其水溶液有极弱的酸性
ⅱ. Zn2++4CN- [Zn(CN)4]2- K1;Zn2++4OH-
[Zn(CN)4]2- K1;Zn2++4OH- [Zn(OH)4]2- K2
[Zn(OH)4]2- K2
下列说法不正确 的是
已知:ⅰ. HCN为剧毒、易挥发的气体,其水溶液有极弱的酸性
ⅱ. Zn2++4CN-
 [Zn(CN)4]2- K1;Zn2++4OH-
[Zn(CN)4]2- K1;Zn2++4OH- [Zn(OH)4]2- K2
[Zn(OH)4]2- K2下列说法
| A.反应前后Zn2+均提供4个空轨道容纳4对孤电子对 |
| B.HOCH2CN的氰基由CN-与甲醛发生反应而来 |
| C.依据上述[Zn(CN)4]2-与甲醛的反应可以证明:K1<K2 |
| D.上述反应必须在碱性条件下进行,既保证安全性,也能提高反应物转化率 |
您最近一年使用:0次
2022-05-31更新
|
781次组卷
|
3卷引用:北京市海淀区北京大学附属中学2022届高三下学期三模化学试题
北京市海淀区北京大学附属中学2022届高三下学期三模化学试题山西省晋中市祁县中学2022-2023学年高三上学期10月月考化学试题(已下线)第37讲 分子结构与性质(练)-2023年高考化学一轮复习讲练测(全国通用)
解题方法
2 . 室温下,1体积的水能溶解约2体积的Cl2.用试管收集Cl2后进行如图所示实验,下列对实验现象的分析或预测正确的是
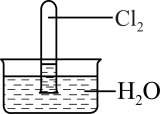
| A.试管内液面上升,证明Cl2与水发生了反应 |
| B.取出试管中的溶液,加入少量CaCO3粉末,溶液漂白能力减弱 |
C.取出试管中的溶液,光照一段时间后pH下降,与反应2HClO 2HCl+O2↑有关 2HCl+O2↑有关 |
| D.取出试管中的溶液,滴加紫色石蕊溶液,溶液先变红后褪色,加热后颜色又变为红色 |
您最近一年使用:0次
名校
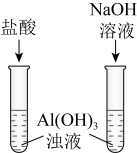
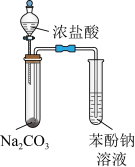
3 . 下列装置或操作能达到实验目的的是
| 装置或操作 |
|
|
| 目的 | A.证明铝元素既有金属性又有非金属性 | B.验证碳酸的酸性比苯酚的强 |
| 装置或操作 |
|
|
| 目的 | C.验证改变压强能破坏化学平衡状态 | D.鉴别苯和己烷 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 资料显示,I2-KI溶液可以清洗银镜。某小组同学设计实验探究银镜在I2-KI溶液中的溶解情况。
已知:I2微溶于水,易溶于KI溶液,并发生反应I2+I− I
I (棕色),I2和I
(棕色),I2和I 氧化性几乎相同;[Ag(S2O3)2]3−在水溶液中无色。
氧化性几乎相同;[Ag(S2O3)2]3−在水溶液中无色。
探究1:I2-KI溶液(向1mol·L−1KI溶液中加入I2至饱和)溶解银镜
【实验i】_____ 。
(2)能证明②中Ag已全部反应、未被包裹在黄色固体内的实验证据是_____ 。
探究2:I2-KI溶液能快速溶解银镜的原因
【实验ii~iv】向附着银镜的试管中加入相应试剂至浸没银镜,记录如下:
(3)ⅰi中,搅拌后银镜继续溶解的原因是_____ 。
(4)由i、iii可得到的结论是_____ 。
(5)设计iv的目的是_____ 。
探究3:I−的作用
【实验v】
说明:本实验中,检流计读数越大,说明氧化剂氧化性(或还原剂还原性)越强。
(6)步骤1接通电路后,正极的电极反应物为_____ 。
(7)补全步骤3的操作及现象:_____ ,_____ 。
(8)综合上述探究,从反应速率和物质性质的角度分析i中I2-KI溶液能快速全部溶解银镜的原因:_____ 。
已知:I2微溶于水,易溶于KI溶液,并发生反应I2+I−
 I
I (棕色),I2和I
(棕色),I2和I 氧化性几乎相同;[Ag(S2O3)2]3−在水溶液中无色。
氧化性几乎相同;[Ag(S2O3)2]3−在水溶液中无色。探究1:I2-KI溶液(向1mol·L−1KI溶液中加入I2至饱和)溶解银镜
【实验i】
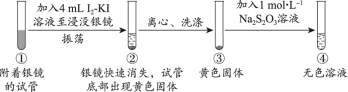
(2)能证明②中Ag已全部反应、未被包裹在黄色固体内的实验证据是
探究2:I2-KI溶液能快速溶解银镜的原因
【实验ii~iv】向附着银镜的试管中加入相应试剂至浸没银镜,记录如下:
| 序号 | 加入试剂 | 实验现象 |
| ⅰi | 4mL饱和碘水(向水中加入I2至饱和, | 30min后,银镜少部分溶解,溶液棕黄色变浅;放置24h后,与紫黑色固体接触部分银镜消失,紫黑色固体表面上有黄色固体,上层溶液接近无色;搅拌后,银镜继续溶解 |
| ⅱi | 4mL饱和碘水和0.66gKI固体(溶液中KI约1mol·L−1) | 15min后银镜部分溶解,溶液棕黄色变浅;放置24h后,试管壁上仍有未溶解的银镜,溶液无色 |
| iv | 4mL1mol·L−1KI溶液 | 放置24h,银镜不溶解,溶液无明显变化 |
(4)由i、iii可得到的结论是
(5)设计iv的目的是
探究3:I−的作用
【实验v】
| 实验装置 | 实验步骤及现象 |
| 1.按左图搭好装置,接通电路,检流计指针向 右微弱偏转,检流计读数为amA; 2.向石墨电极附近滴加饱和碘水,指针继续向 右偏转,检流计读数为bmA(b>a); 3.向左侧烧杯中加入_____,指针继续向右偏转,检流计读数cmA(c>b),有_____生成。 |
(6)步骤1接通电路后,正极的电极反应物为
(7)补全步骤3的操作及现象:
(8)综合上述探究,从反应速率和物质性质的角度分析i中I2-KI溶液能快速全部溶解银镜的原因:
您最近一年使用:0次
2024-04-13更新
|
433次组卷
|
3卷引用:2023-2024学年海淀区第二学期期中考试高三化学试卷
解题方法
5 . 工业上用铁粉还原AgCl制取银,某小组探究其过程和影响因素。
【实验A】在试管中加入NaCl溶液,然后滴入 溶液,产生白色沉淀。滤出白色沉淀,继续实验如下:
溶液,产生白色沉淀。滤出白色沉淀,继续实验如下:
②
(1)检验ⅱ中产物
①取ⅱ中上层清液,滴加_______ 溶液,产生蓝色沉淀,说明溶液中含有 。
。
②取ⅱ中少量灰黑色固体,洗涤后将固体等分两份。取其中一份,加入稀硝酸溶解,再加入NaCl溶液生成_______ (填实验现象),证明灰黑色固体中含有Ag。向另一份加入KI溶液,无明显现象。
(2)检验ⅲ中产物。
①取ⅲ中灰白色固体,洗涤。进行如下实验,确认灰白色固体中含AgCl:_______ 。
②取ⅲ中上层溶液,加几滴KSCN溶液。取样时间与溶液颜色如下表。
用离子方程式表示溶液变红的原因_______ , 。
。
(3)小组同学认为 可以直接氧化Ag继而生成AgCl,对此设计实验验证:
可以直接氧化Ag继而生成AgCl,对此设计实验验证:_______ 。结果发现,该实验产生AgCl所需的时间更长。说明AgCl的产生主要与 有关。
有关。
(4)实验A中的ⅰ~ⅲ中,ⅰ中AgCl溶解,ⅲ中又生成AgCl的原因是:_______ 。
实验反思:铁粉还原AgCl制取银时应控制铁粉、盐酸的浓度和浸泡时间等因素。
【实验A】在试管中加入NaCl溶液,然后滴入
 溶液,产生白色沉淀。滤出白色沉淀,继续实验如下:
溶液,产生白色沉淀。滤出白色沉淀,继续实验如下:

②

(1)检验ⅱ中产物
①取ⅱ中上层清液,滴加
 。
。②取ⅱ中少量灰黑色固体,洗涤后将固体等分两份。取其中一份,加入稀硝酸溶解,再加入NaCl溶液生成
(2)检验ⅲ中产物。
①取ⅲ中灰白色固体,洗涤。进行如下实验,确认灰白色固体中含AgCl:

②取ⅲ中上层溶液,加几滴KSCN溶液。取样时间与溶液颜色如下表。
| 取样时间 | 10分钟 | 12小时 | 24小时 |
| 溶液颜色 | 浅红色 | 红色 | 深红色 |
 。
。(3)小组同学认为
 可以直接氧化Ag继而生成AgCl,对此设计实验验证:
可以直接氧化Ag继而生成AgCl,对此设计实验验证: 有关。
有关。(4)实验A中的ⅰ~ⅲ中,ⅰ中AgCl溶解,ⅲ中又生成AgCl的原因是:
实验反思:铁粉还原AgCl制取银时应控制铁粉、盐酸的浓度和浸泡时间等因素。
您最近一年使用:0次
解题方法
6 . 利用下列实验药品,不能达到实验目的的是
| 实验目的 | 实验药品 | |
| A | 比较水和四氯化碳分子的极性 |  、 、 、橡胶棒、毛皮 、橡胶棒、毛皮 |
| B | 验证乙醇的消去产物乙烯 | 乙醇、酸性高锰酸钾溶液、浓硫酸 |
| C | 探究温度对化学平衡的影响 |  溶液、冷水、热水 溶液、冷水、热水 |
| D | 证明牺牲阳极法保护铁 | Fe、Zn、酸化的食盐水、 溶液 溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-03-17更新
|
407次组卷
|
2卷引用:北京市石景山区2022-2023学年高三下学期质量监控(零模)化学试题
解题方法
7 . 某化学小组探究铜和稀硝酸的反应:
资料1 铜与浓度低于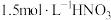 反应很慢,且放热极少。
反应很慢,且放热极少。
(1)实验预测
①铜与稀 反应的离子方程式为
反应的离子方程式为_______ 。
②小组同学预测铜与稀 的反应速率应逐渐减慢,其理论依据是
的反应速率应逐渐减慢,其理论依据是_______ 。
(2)实验实施
实验I:铜丝与 反应。
反应。
实验II:探究Cu与稀 在无氧环境下反应所得溶液显绿色的原因:
在无氧环境下反应所得溶液显绿色的原因:
资料2:
i.上述溶液中均不存在-3价的氮; 为淡黄色沉淀。
为淡黄色沉淀。
ii. 是一种弱酸,
是一种弱酸, ;
;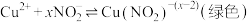
①通过上述实验,证明铜与稀 反应过程中可能有
反应过程中可能有 生成,理由是
生成,理由是_______ 。
②分析阶段B溶液呈绿色的原因_______ 。
③从平衡角度分析实验II中,阶段B溶液中滴加稀硫酸溶液由绿色变蓝的原因_______ 。
④写出铜和稀 反应的生成
反应的生成 的化学方程式
的化学方程式_______ 。
(3)继续探究:
探究铜和稀 反应速率变化的原因:小组同学依据实验I的数据,画出铜和稀硝酸反应的速率时间图像为下图:
反应速率变化的原因:小组同学依据实验I的数据,画出铜和稀硝酸反应的速率时间图像为下图:
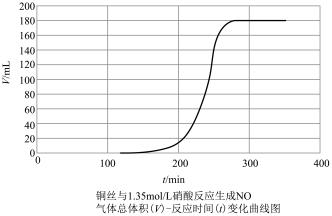
甲同学提出,铜与稀硝酸反应,反应开始较慢(阶段A),后较快(阶段B),可能是因为反应生成的产物 有催化作用,并通过实验证明了自己的猜想:甲同学设计的实验方案为
有催化作用,并通过实验证明了自己的猜想:甲同学设计的实验方案为_______ 。
(4)反思总结:通过上述实验探究过程,铜和 的反应实际过程可能为
的反应实际过程可能为_______ 。
资料1 铜与浓度低于
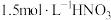 反应很慢,且放热极少。
反应很慢,且放热极少。(1)实验预测
①铜与稀
 反应的离子方程式为
反应的离子方程式为②小组同学预测铜与稀
 的反应速率应逐渐减慢,其理论依据是
的反应速率应逐渐减慢,其理论依据是(2)实验实施
实验I:铜丝与
 反应。
反应。| 实验装置 | 实验操作 | 实验现象 |
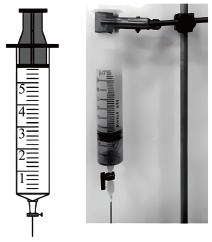 | 在洁净的注射器中装入已活化铜丝2.3g,再用注射器抽取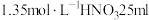 ,同时排尽注射器中的空气,关闭注射器止水开关,以保证铜丝与稀 ,同时排尽注射器中的空气,关闭注射器止水开关,以保证铜丝与稀 反应体系处于无氧环境中。 反应体系处于无氧环境中。 | 反应较慢阶段A:反应前90min几乎没有现象,90min左右才有很少气泡产生(该气体遇空气变成红棕色),溶液为浅蓝色;反应较快阶段B:之后溶液逐渐变为绿色;最后阶段C:在反应结束前15min左右时,体系溶液为深蓝色。 |
 在无氧环境下反应所得溶液显绿色的原因:
在无氧环境下反应所得溶液显绿色的原因:操作及现象 实验序号 | 取不同阶段的溶液进行实验操作 | 实验现象 | ||
| 阶段A溶液 | 阶段B溶液 | 阶段C溶液 | ||
| 1 | 滴加 酸性 酸性 溶液 溶液 | 褪色,滴6滴后溶液不褪色 | 褪色,但滴20滴后溶液仍然褪色 | 褪色,滴10滴后溶液不再褪色 |
| 2 | 滴加3% 溶液 溶液 | 无明显现象 | 少量淡黄色沉淀 | 较多黄色沉淀 |
| 3 | 滴加稀 溶液 溶液 | 无明显现象 | 变蓝色 | 无明显现象 |
i.上述溶液中均不存在-3价的氮;
 为淡黄色沉淀。
为淡黄色沉淀。ii.
 是一种弱酸,
是一种弱酸, ;
;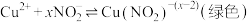
①通过上述实验,证明铜与稀
 反应过程中可能有
反应过程中可能有 生成,理由是
生成,理由是②分析阶段B溶液呈绿色的原因
③从平衡角度分析实验II中,阶段B溶液中滴加稀硫酸溶液由绿色变蓝的原因
④写出铜和稀
 反应的生成
反应的生成 的化学方程式
的化学方程式(3)继续探究:
探究铜和稀
 反应速率变化的原因:小组同学依据实验I的数据,画出铜和稀硝酸反应的速率时间图像为下图:
反应速率变化的原因:小组同学依据实验I的数据,画出铜和稀硝酸反应的速率时间图像为下图:
甲同学提出,铜与稀硝酸反应,反应开始较慢(阶段A),后较快(阶段B),可能是因为反应生成的产物
 有催化作用,并通过实验证明了自己的猜想:甲同学设计的实验方案为
有催化作用,并通过实验证明了自己的猜想:甲同学设计的实验方案为(4)反思总结:通过上述实验探究过程,铜和
 的反应实际过程可能为
的反应实际过程可能为
您最近一年使用:0次
2023-01-09更新
|
767次组卷
|
4卷引用:北京市顺义区2023届高三第一次统练化学试题
名校
解题方法
8 . 物质的大小会对其性质有极大影响。
(1)纳米金:具有高电子密度、介电特性和催化作用。纳米金的制法:将0.01%的 溶液煮沸,迅速加入1%的柠檬酸钠(
溶液煮沸,迅速加入1%的柠檬酸钠( )溶液,持续煮沸7~10分钟。制备时溶液会因为加入的柠檬酸钠的量不同而产生不同的颜色,如下表所示。
)溶液,持续煮沸7~10分钟。制备时溶液会因为加入的柠檬酸钠的量不同而产生不同的颜色,如下表所示。
资料: 的溶液呈黄色,其酸性比柠檬酸强。
的溶液呈黄色,其酸性比柠檬酸强。
①在制备过程中,存在如下反应,已知产物 是柠檬酸脱去一个羧基得到的,核磁共振氢谱显示其有4组峰。请补全并配平下面的反应方程式(要写出
是柠檬酸脱去一个羧基得到的,核磁共振氢谱显示其有4组峰。请补全并配平下面的反应方程式(要写出 的结构简式)
的结构简式) _______ 。
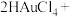 □
□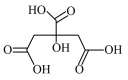 →□_______+□_______(
→□_______+□_______( )+□
)+□ +□HCl
+□HCl
②柠檬酸钠的作用是_______ ,如果一段时间后的液体仍为黄色,则可以_______ (填操作)来检验是否生成纳米金。
(2)微米水:可以高效诱导分子的还原反应,且不需要任何的外加还原剂或外加电荷。科学家使用上述方法制取纳米金时,引入了不加柠檬酸的对照组。令人惊奇的是对照组也发生了反应,他经过猜想与论证,最终将目光锁定在水身上,用如下装置(如图1所示)进行验证。

①使用丙酮酸( )来验证,通过检验由丙酮酸生成的产物
)来验证,通过检验由丙酮酸生成的产物_______ ,证明猜想成立。
②发现随着丙酮酸浓度的增加,还原效率会迅速降低,图2与图3中丙酮酸浓度均为10mol/L。

还原效率会随着雾化气体压强的增大而增大的原因是_______ 。
③为探究还原反应的具体过程,继续设计实验:向水中加入一种指示剂R,这种指示剂正常状态下不显色,R在遇到一定浓度的 与还原剂后会显示红色荧光,过程可以表示为:R(无色)
与还原剂后会显示红色荧光,过程可以表示为:R(无色) (红色荧光)。加入R后观测到的现象如图4所示。
(红色荧光)。加入R后观测到的现象如图4所示。

结合图4和上述实验,你可以得出什么推论?_______ 。
(3)综合上述内容,你对物质有了哪些更深入的认识?_______ 。
(1)纳米金:具有高电子密度、介电特性和催化作用。纳米金的制法:将0.01%的
 溶液煮沸,迅速加入1%的柠檬酸钠(
溶液煮沸,迅速加入1%的柠檬酸钠( )溶液,持续煮沸7~10分钟。制备时溶液会因为加入的柠檬酸钠的量不同而产生不同的颜色,如下表所示。
)溶液,持续煮沸7~10分钟。制备时溶液会因为加入的柠檬酸钠的量不同而产生不同的颜色,如下表所示。| 纳米金颗粒大小(nm) | 颜色 |
| 2~5 | 黄 |
| 10~20 | 红 |
| 30~80 | 紫 |
 的溶液呈黄色,其酸性比柠檬酸强。
的溶液呈黄色,其酸性比柠檬酸强。①在制备过程中,存在如下反应,已知产物
 是柠檬酸脱去一个羧基得到的,核磁共振氢谱显示其有4组峰。请补全并配平下面的反应方程式(要写出
是柠檬酸脱去一个羧基得到的,核磁共振氢谱显示其有4组峰。请补全并配平下面的反应方程式(要写出 的结构简式)
的结构简式) 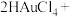 □
□ →□_______+□_______(
→□_______+□_______( )+□
)+□ +□HCl
+□HCl②柠檬酸钠的作用是
(2)微米水:可以高效诱导分子的还原反应,且不需要任何的外加还原剂或外加电荷。科学家使用上述方法制取纳米金时,引入了不加柠檬酸的对照组。令人惊奇的是对照组也发生了反应,他经过猜想与论证,最终将目光锁定在水身上,用如下装置(如图1所示)进行验证。

①使用丙酮酸(
 )来验证,通过检验由丙酮酸生成的产物
)来验证,通过检验由丙酮酸生成的产物②发现随着丙酮酸浓度的增加,还原效率会迅速降低,图2与图3中丙酮酸浓度均为10mol/L。

还原效率会随着雾化气体压强的增大而增大的原因是
③为探究还原反应的具体过程,继续设计实验:向水中加入一种指示剂R,这种指示剂正常状态下不显色,R在遇到一定浓度的
 与还原剂后会显示红色荧光,过程可以表示为:R(无色)
与还原剂后会显示红色荧光,过程可以表示为:R(无色) (红色荧光)。加入R后观测到的现象如图4所示。
(红色荧光)。加入R后观测到的现象如图4所示。
结合图4和上述实验,你可以得出什么推论?
(3)综合上述内容,你对物质有了哪些更深入的认识?
您最近一年使用:0次
2022-05-31更新
|
261次组卷
|
2卷引用:北京市东城区第五中学2022届高三三模化学试题
名校
解题方法
9 . 实验室探究NaHSO3溶液与Cu2+的反应。
I.如图所示制备(经检验装置气密性良好)。

(1)仪器a的名称是____ 。
(2)写出C中制备NaHSO3的离子方程式____ 。
II.探究NaHSO3溶液与Cu2+的反应,过程如图所示:
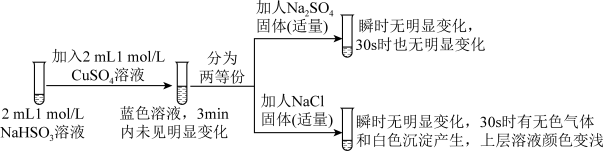
已知:硫酸亚铜易溶于水。
回答下列问题:
(3)加入NaCl固体后产生的无色气体和白色沉淀经检验分别是SO2和CuCl,说明发生了氧化还原反应。加入NaCl固体发生反应的原因。
a.Cl-改变了HSO 的还原性
的还原性
b.Cl-改变了Cu2+的氧化性
用原电池原理进行试验,探究上述现象可能的原因。
①由实验1、2可知原因a不合理,依据是_____ 。
②实验3:用如图所示装置实验,B中有白色沉淀生成,证明原因b合理。
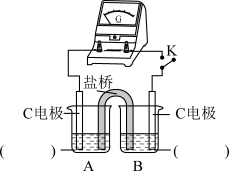
ⅰ.补全电化学装置示意图____ 。
ⅱ.写出B中的电极反应方程式____ 。
ⅲ.请从反应原理的角度解释原因:Cl-与Cu2+的还原产物Cu+形成沉淀,____ ,使HSO 与Cu2+的反应能够反应完全。
与Cu2+的反应能够反应完全。
III.金能与浓硝酸发生微弱反应生成Au3+,短时间几乎观察不到金溶解。金易溶于“王水”[浓硝酸与浓盐酸按体积比1∶3混合]
已知:Au3++4Cl-+H+ HAuCl4
HAuCl4
(4)利用(3)中实验探究的结论,分析“王水”溶金的原理:____ 。
I.如图所示制备(经检验装置气密性良好)。

(1)仪器a的名称是
(2)写出C中制备NaHSO3的离子方程式
II.探究NaHSO3溶液与Cu2+的反应,过程如图所示:

已知:硫酸亚铜易溶于水。
回答下列问题:
(3)加入NaCl固体后产生的无色气体和白色沉淀经检验分别是SO2和CuCl,说明发生了氧化还原反应。加入NaCl固体发生反应的原因。
a.Cl-改变了HSO
 的还原性
的还原性b.Cl-改变了Cu2+的氧化性
用原电池原理进行试验,探究上述现象可能的原因。
| 编号 | 实验1 | 实验2 |
| 实验 | 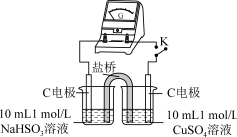 | 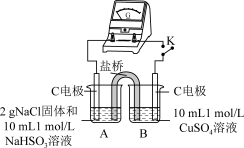 |
| 现象 | 闭合开关K,电流计指针发生微小偏转,烧杯中未见明显现象 | 闭合开关K,电流计指针发生微小偏转,烧杯中未见明显现象 |
②实验3:用如图所示装置实验,B中有白色沉淀生成,证明原因b合理。

ⅰ.补全电化学装置示意图
ⅱ.写出B中的电极反应方程式
ⅲ.请从反应原理的角度解释原因:Cl-与Cu2+的还原产物Cu+形成沉淀,
 与Cu2+的反应能够反应完全。
与Cu2+的反应能够反应完全。III.金能与浓硝酸发生微弱反应生成Au3+,短时间几乎观察不到金溶解。金易溶于“王水”[浓硝酸与浓盐酸按体积比1∶3混合]
已知:Au3++4Cl-+H+
 HAuCl4
HAuCl4(4)利用(3)中实验探究的结论,分析“王水”溶金的原理:
您最近一年使用:0次
名校
解题方法
10 . 实验小组同学为探究Fe2+性质,进行如下实验。
【实验Ⅰ】向2mL 溶液滴中几滴
溶液滴中几滴 KSCN溶液,无明显现象,再滴加几滴3%
KSCN溶液,无明显现象,再滴加几滴3% 溶液(用
溶液(用 酸化至
酸化至 ),溶液颜色变红。
),溶液颜色变红。
(1)甲同学通过上述实验分析 具有
具有_______ (填“氧化”或“还原”)性。
乙同学查阅资料发现 与
与 可发生反应,生成无色的配合物。为证实该性质,利用进行如下实验。
可发生反应,生成无色的配合物。为证实该性质,利用进行如下实验。
(2) 的制备:用过量
的制备:用过量 溶液与
溶液与 溶液反应得到
溶液反应得到 ,离子方程式为
,离子方程式为_______ 。
【实验Ⅱ】验证 与
与 发生反应
发生反应_______ 。
(4)从沉淀溶解平衡角度解释实验a和b最终溶液颜色不同的原因是_______ 。
丙同学设计实验进一步证明 可与
可与 反应。
反应。
【实验Ⅲ】
①X为_______ 。
②实验能够证实 可与
可与 反应,则应观察到的现象是
反应,则应观察到的现象是_______ 。
(6)实验Ⅲ中若未加适量水稀释,则无法通过现象得出结论。推测加水稀释的目的可能有:使后续实验颜色变化易于观察;降低 ,
,_______ 。
【实验Ⅰ】向2mL
 溶液滴中几滴
溶液滴中几滴 KSCN溶液,无明显现象,再滴加几滴3%
KSCN溶液,无明显现象,再滴加几滴3% 溶液(用
溶液(用 酸化至
酸化至 ),溶液颜色变红。
),溶液颜色变红。(1)甲同学通过上述实验分析
 具有
具有乙同学查阅资料发现
 与
与 可发生反应,生成无色的配合物。为证实该性质,利用进行如下实验。
可发生反应,生成无色的配合物。为证实该性质,利用进行如下实验。(2)
 的制备:用过量
的制备:用过量 溶液与
溶液与 溶液反应得到
溶液反应得到 ,离子方程式为
,离子方程式为【实验Ⅱ】验证
 与
与 发生反应
发生反应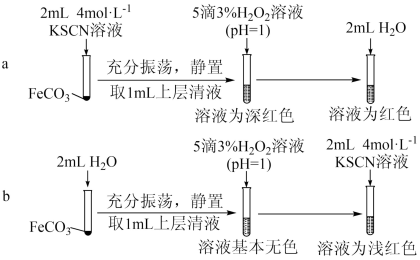
(4)从沉淀溶解平衡角度解释实验a和b最终溶液颜色不同的原因是
丙同学设计实验进一步证明
 可与
可与 反应。
反应。【实验Ⅲ】
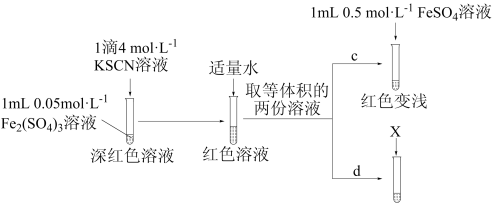
①X为
②实验能够证实
 可与
可与 反应,则应观察到的现象是
反应,则应观察到的现象是(6)实验Ⅲ中若未加适量水稀释,则无法通过现象得出结论。推测加水稀释的目的可能有:使后续实验颜色变化易于观察;降低
 ,
,
您最近一年使用:0次
2022-05-30更新
|
1314次组卷
|
11卷引用:北京市东城区2022届高三综合练习(二模)化学试题
北京市东城区2022届高三综合练习(二模)化学试题北京市育才学校2022届高三下学期三模化学试题北京市一零一中学2022届高三三模化学试题北京市北京一零一中学2022-2023学年高三上学期统练7化学试题北京市第八十中学2022-2023学年高三上学期期末测试化学试题(已下线)实验探究题北京师范大学附属中学预科部2023-2024学年高三上学期12月月考化学试题北京大学附属中学预科部2023-2024学年高三上学期12月阶段练习化学试题(已下线)考点14 铁及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点14 铁及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)