11-12高三上·浙江杭州·阶段练习
1 . 氨基磺酸(H2NSO3H)是一元固体强酸,溶于水和液氨,不溶于乙醇。在工业上用作酸性清洗剂、阻燃剂、磺化剂。用尿素[CO(NH2)2]和发烟硫酸(溶有SO3的硫酸)为原料合成氨基磺酸的路线如下:

(1)重结晶用10%~12%的硫酸作溶剂而不用水作溶剂的原因是______________
(2)“磺化”步骤中所发生的反应为:
①CO(NH2)2(s) + SO3(g) H2NCONHSO3H(s) △H<0
H2NCONHSO3H(s) △H<0
②H2NCONHSO3H + H2SO4 2H2NSO3H + CO2↑
2H2NSO3H + CO2↑
“磺化”过程应控制反应温度为75~80℃,若温度高于80℃,氨基磺酸的产率会降低,原因是_______________ 。
(3)测定产品中氨基磺酸纯度的方法如下:称取7.920g产品配成l000mL待测液,量取25.00mL待测液于锥形瓶中,加入2mL 0.2mol·L-1稀盐酸,用淀粉碘化钾试剂作指示剂,逐滴加入0.08000mol·L-1NaNO2溶液,当溶液恰好变蓝时,消耗NaNO2溶液25.00mL,此时氨基磺酸恰好被完全氧化成N2,NaNO2的还原产物也为N2。试求产品中氨基磺酸的质量分数________ 。
(4)以酚酞为指示剂,用NaOH进行酸碱中和滴定也能测定产品中氨基磺酸的纯度,测定结果通常比NaNO2法偏高,原因是氨基磺酸中混有___________ 杂质。

(1)重结晶用10%~12%的硫酸作溶剂而不用水作溶剂的原因是
(2)“磺化”步骤中所发生的反应为:
①CO(NH2)2(s) + SO3(g)
 H2NCONHSO3H(s) △H<0
H2NCONHSO3H(s) △H<0②H2NCONHSO3H + H2SO4
 2H2NSO3H + CO2↑
2H2NSO3H + CO2↑“磺化”过程应控制反应温度为75~80℃,若温度高于80℃,氨基磺酸的产率会降低,原因是
(3)测定产品中氨基磺酸纯度的方法如下:称取7.920g产品配成l000mL待测液,量取25.00mL待测液于锥形瓶中,加入2mL 0.2mol·L-1稀盐酸,用淀粉碘化钾试剂作指示剂,逐滴加入0.08000mol·L-1NaNO2溶液,当溶液恰好变蓝时,消耗NaNO2溶液25.00mL,此时氨基磺酸恰好被完全氧化成N2,NaNO2的还原产物也为N2。试求产品中氨基磺酸的质量分数
(4)以酚酞为指示剂,用NaOH进行酸碱中和滴定也能测定产品中氨基磺酸的纯度,测定结果通常比NaNO2法偏高,原因是氨基磺酸中混有
您最近一年使用:0次
10-11高三·安徽·阶段练习
名校
2 . 将煤气化转化成合成气,然后通过一碳化工路线合成各种油品和石化产品是一碳化工的极为重要的领域,具有广阔的前景,在未来相当一段时期将成为一碳化工的主要领域。
除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成。

(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g) CO(g)+H2(g),此反应是吸热反应。
CO(g)+H2(g),此反应是吸热反应。
① 此反应的化学平衡常数表达式为____________________ ;
②下列能增大碳的转化率的措施是____________________ ;
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:CH4 (g)+3/2O2 (g) CO (g)+2H2O (g) △H=-519kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CO (g)+2H2O (g) △H=-519kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
① X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
② Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③ Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是________ (填“X”或“Y”或“Z”),选择的理由是_____________________________ ;
(3)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应如下:2H2(g) + CO(g) CH3OH(g);ΔH =-90.8kJ·mol-1,T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g);ΔH =-90.8kJ·mol-1,T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
① 比较此时正、逆反应速率的大小:υ正________ υ逆(填“>”、“<”或“=”)。
② 若加入CO、H2后,在T5℃反应10min达到平衡,c(H2)=0.4 mol·L-1,则该时间内反应速率υ(CH3OH) =______________ mol-1·(Lmin)-1。
(4)生产过程中,合成气要进行循环,其目的是___________________________ 。
除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成。

(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g)
 CO(g)+H2(g),此反应是吸热反应。
CO(g)+H2(g),此反应是吸热反应。① 此反应的化学平衡常数表达式为
②下列能增大碳的转化率的措施是
| A.加入C(s) | B.加入H2O(g) | C.升高温度 | D.增大压强 |
 CO (g)+2H2O (g) △H=-519kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CO (g)+2H2O (g) △H=-519kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)① X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
② Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③ Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是
(3)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应如下:2H2(g) + CO(g)
 CH3OH(g);ΔH =-90.8kJ·mol-1,T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g);ΔH =-90.8kJ·mol-1,T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:| 物质 | H2 | CO | CH3OH |
| 浓度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
② 若加入CO、H2后,在T5℃反应10min达到平衡,c(H2)=0.4 mol·L-1,则该时间内反应速率υ(CH3OH) =
(4)生产过程中,合成气要进行循环,其目的是
您最近一年使用:0次
2016-12-09更新
|
808次组卷
|
3卷引用:2011届安徽省“江南十校”高三联考(理综)化学部分
(已下线)2011届安徽省“江南十校”高三联考(理综)化学部分河北省石家庄市第二中学2019-2020高一下学期期末考试模拟(四)化学试题海南省三亚市2023-2024学年鲁迅中学高二上学期化学期中测试
3 . 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应Ⅰ和Ⅱ来制备甲醇。请回答下列问题:
(1)将1.0molCH4和2.0molH2O(g)通入反应室(容积为100L)中,在一定条件下发生反应:
CH4(g)+H2O(g)⇌CO(g)+3H2(g)(Ⅰ)
CH4的转化率与温度、压强的关系如图1所示。

①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为__ 。
②图中的p1__ p2(填“<”、“>”或“=”),100℃时的平衡常数为__ 。
③该反应的△H__ 0,△S_ 0(填“<”、“>”或“=”)。
(2)在压强为0.1MPa条件下,amolCO与3amolH2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)⇌CH3OH(g)△H<0(Ⅱ)
①若容器的容积不变,下列措施可增大甲醇产率的是__ (填序号)。
A.升高温度
B.将CH3OH(g)从体系中分离出来
C.恒容下充入He,使体系的总压强增大
D.再充入amolCO和3amolH2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了下面的实验设计表中。
a.表中剩余的实验数据:n=__ ,m=__ 。
b.根据反应Ⅱ的特点,如图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线,请指明图2中的压强px=__ MPa。

(1)将1.0molCH4和2.0molH2O(g)通入反应室(容积为100L)中,在一定条件下发生反应:
CH4(g)+H2O(g)⇌CO(g)+3H2(g)(Ⅰ)
CH4的转化率与温度、压强的关系如图1所示。

①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为
②图中的p1
③该反应的△H
(2)在压强为0.1MPa条件下,amolCO与3amolH2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)⇌CH3OH(g)△H<0(Ⅱ)
①若容器的容积不变,下列措施可增大甲醇产率的是
A.升高温度
B.将CH3OH(g)从体系中分离出来
C.恒容下充入He,使体系的总压强增大
D.再充入amolCO和3amolH2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了下面的实验设计表中。
| 实验编号 | T(℃) |  | ρ(MPa) |
| 1 | 150 |  | 0.1 |
| 2 | n |  | 5 |
| 3 | 350 | m | 5 |
a.表中剩余的实验数据:n=
b.根据反应Ⅱ的特点,如图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线,请指明图2中的压强px=

您最近一年使用:0次
解题方法
4 . 甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
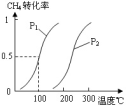
⑴①将1.0 mol CH4和2.0 mol H2O(g)通入容积100L的反应室,一定条件下发生反应:CH4(g) + H2O(g) ⇌ CO(g) + 3H2(g)
Ⅰ,CH4的转化率与温度、压强的关系如图。已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为:_____________ ;
②图中的压强P1_________ P2(填“大于”、“小于”或“等于”),100℃时的平衡常数为:_______ ;
③在其它条件不变的情况下降低温度 ,逆反应 速率将__________ (填“增大”、“减小”或“不变”)。
⑵在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g) + 2H2(g) ⇌ CH3OH(g)
Ⅱ。①若容器容积不变,下列措施可提高甲醇产率的是:________________ ;
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.加入更高效的催化剂
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在下面实验设计的表中,请帮他完成该表。
表中Ⅰ、Ⅱ、Ⅲ分别为:__________ 、____________ 、____________ 。

⑴①将1.0 mol CH4和2.0 mol H2O(g)通入容积100L的反应室,一定条件下发生反应:CH4(g) + H2O(g) ⇌ CO(g) + 3H2(g)
Ⅰ,CH4的转化率与温度、压强的关系如图。已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为:
②图中的压强P1
③在其它条件不变的情况下
⑵在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g) + 2H2(g) ⇌ CH3OH(g)
Ⅱ。①若容器容积不变,下列措施可提高甲醇产率的是:
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.加入更高效的催化剂
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在下面实验设计的表中,请帮他完成该表。
| 实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) |
| A | 150 | 1/3 | 0.1 |
| B | Ⅰ | Ⅱ | 5 |
| C | 350 | 1/3 | Ⅲ |
表中Ⅰ、Ⅱ、Ⅲ分别为:
您最近一年使用:0次
2010·江苏扬州·模拟预测
解题方法
5 . 甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ
CO(g)+3H2(g)……Ⅰ
CH4的转化率与温度、压强的关系如图。
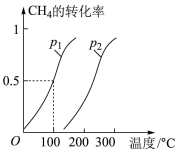
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为_______ 。
②图中的P1_______ P2(填“<”、“>”或“=”),100℃时平衡常数为_______ 。
③在其它条件不变的情况下降低温度,逆反应速率将_______ (填“增大”、“减小”或“不变”)。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH3OH(g) ……Ⅱ
CH3OH(g) ……Ⅱ
④该反应的△H_______ 0,△S_______ 0(填“<”、“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是_______ 。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
A.请在上表空格中填入剩余的实验条件数据_______ 。
B.根据反应Ⅱ的特点,在给出的坐标图中,画出其在0.1MPa和5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强_______ 。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:CH4(g)+H2O(g)
 CO(g)+3H2(g)……Ⅰ
CO(g)+3H2(g)……ⅠCH4的转化率与温度、压强的关系如图。
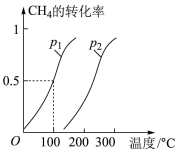
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为
②图中的P1
③在其它条件不变的情况下降低温度,逆反应速率将
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)
 CH3OH(g) ……Ⅱ
CH3OH(g) ……Ⅱ④该反应的△H
⑤若容器容积不变,下列措施可增加甲醇产率的是
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) |
| ⅰ | 150 | 1/3 | 0.1 |
| ⅱ | 5 | ||
| ⅲ | 350 | 5 |
B.根据反应Ⅱ的特点,在给出的坐标图中,画出其在0.1MPa和5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强

您最近一年使用:0次
10-11高三上·宁夏银川·阶段练习
解题方法
6 . 甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ
CO(g)+3H2(g)……Ⅰ
CH4的转化率与温度、压强的关系如右图。
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为_______ 。
②图中的P1____ P2(填“<”、“>”或“=”),100℃时平衡常数为______ 。
③该反应的△H____ 0(填“<”、“>”或“=”)。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH3OH(g);△H<0……Ⅱ。
CH3OH(g);△H<0……Ⅱ。
④若容器容积不变,下列措施可增加甲醇产率的是_____ 。
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1mol CO和3mol H2
⑤为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
A.则上表中剩余的实验条件数据:a=________ b=_______
B.根据反应Ⅱ的特点,右上图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=_________ MPa。
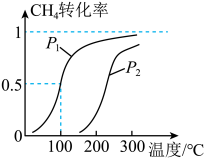
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g)
 CO(g)+3H2(g)……Ⅰ
CO(g)+3H2(g)……ⅠCH4的转化率与温度、压强的关系如右图。

①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为
②图中的P1
③该反应的△H
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)
 CH3OH(g);△H<0……Ⅱ。
CH3OH(g);△H<0……Ⅱ。④若容器容积不变,下列措施可增加甲醇产率的是
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1mol CO和3mol H2
⑤为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验编号 | T(℃) | n(CO)/n(H2) | P(MPa) |
1 | 150 | 1/3 | 0.1 |
2 | a | 1/3 | 5 |
3 | 350 | b | 5 |

A.则上表中剩余的实验条件数据:a=
B.根据反应Ⅱ的特点,右上图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=
您最近一年使用:0次
9-10高三·四川成都·阶段练习
7 . 据报道,在西藏冻土的一定深度下,发现了储量巨大的“可燃冰”,它主要是甲烷和水形成的水合物(CH4·nH2O)。
(1)在常温常压下,“可燃冰”会发生分解反应,其化学方程式是________ 。
(2)甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油。
①在101 KPa时,1.6 g CH4(g)与H2O(g)反应生成CO、H2,吸热20.64 kJ。则甲烷与H2O(g)反应的热化学方程式:________ 。
②CH4不完全燃烧也可制得合成气:CH4(g)+ O2(g)===CO(g)+2H2(g);
O2(g)===CO(g)+2H2(g);
△H=-35.4 kJ·mol-1。则从原料选择和能源利用角度,比较方法①和②,合成甲醇的适宜方法为______ (填序号);原因是____________ 。
③在温度为T,体积为10L的密闭容器中,加入1 mol CO、2 mol H2,发生反应
CO(g)+ 2H2(g) CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。
CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。
I.H2的转化率为________ ;
II.在相同条件下,若起始时向密闭容器中加入a mol CH3OH(g),反应平衡后吸收热量Q2kJ,且Q1+Q2=Q,则a=_____ mol。
III.已知起始到平衡后的CO浓度与时间的变化关系如右图所示。则t1时将体积变为5L后,平衡向_______ 反应方向移动(填“正”或“逆”);
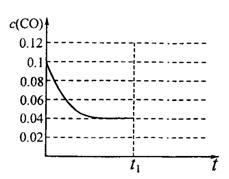
在上图中画出从tl开始到再次达到平衡后,CO浓度与时间的变化趋势曲线_____ 。
(3)将CH4设计成燃料电池,其利用率更高,装置示意如右图(A、B为多孔性碳棒)。
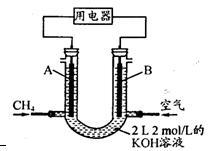
持续通入甲烷,在标准状况下,消耗甲烷体积VL。
①O<V≤44.8 L时,电池总反应方程式为____ ;
②44.8 L<V≤89.6 L时,负极电极反应为______ ;
③V=67.2 L时,溶液中离子浓度大小关系为______ ;
(1)在常温常压下,“可燃冰”会发生分解反应,其化学方程式是
(2)甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油。
①在101 KPa时,1.6 g CH4(g)与H2O(g)反应生成CO、H2,吸热20.64 kJ。则甲烷与H2O(g)反应的热化学方程式:
②CH4不完全燃烧也可制得合成气:CH4(g)+
 O2(g)===CO(g)+2H2(g);
O2(g)===CO(g)+2H2(g);△H=-35.4 kJ·mol-1。则从原料选择和能源利用角度,比较方法①和②,合成甲醇的适宜方法为
③在温度为T,体积为10L的密闭容器中,加入1 mol CO、2 mol H2,发生反应
CO(g)+ 2H2(g)
 CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。
CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。I.H2的转化率为
II.在相同条件下,若起始时向密闭容器中加入a mol CH3OH(g),反应平衡后吸收热量Q2kJ,且Q1+Q2=Q,则a=
III.已知起始到平衡后的CO浓度与时间的变化关系如右图所示。则t1时将体积变为5L后,平衡向

在上图中画出从tl开始到再次达到平衡后,CO浓度与时间的变化趋势曲线
(3)将CH4设计成燃料电池,其利用率更高,装置示意如右图(A、B为多孔性碳棒)。

持续通入甲烷,在标准状况下,消耗甲烷体积VL。
①O<V≤44.8 L时,电池总反应方程式为
②44.8 L<V≤89.6 L时,负极电极反应为
③V=67.2 L时,溶液中离子浓度大小关系为
您最近一年使用:0次
名校
解题方法
8 . 甲胺铅碘(CH3NH3PbI3)可用作全固态钙钛矿敏化太阳能电池的敏化剂,该物质可由甲胺(CH3NH2)、PbI2及HI为原料来合成。请回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)=CH3NH2(g)+H2O(g),已知该反应中相关化学键的键能数据如下表所示:
则该反应的△H=_______ kJ·mol-1。
(2)工业上利用水煤气合成甲醇的反应为CO(g)+2H2(g) CH3OH(g) △H<0。一定温度下,向体积为2L的密闭容器中加入CO和H2,5min末反应达到化学平衡状态,测得各组分浓度如下表所示。
CH3OH(g) △H<0。一定温度下,向体积为2L的密闭容器中加入CO和H2,5min末反应达到化学平衡状态,测得各组分浓度如下表所示。
①0~5min内,用CO表示的平均反应速率为_______ 。
②既能加快反应速率,又能提高氢气转化率的措施有_______ (答一条即可)。
③能说明上述反应已达化学平衡状态的是_______ (填字母)。
A.v正(CO)=2v逆(H2) B.混合气体密度保持不变
C.反应容器内压强保持不变 D.混合气体的平均摩尔质量不变
(3)常温下PbS饱和溶液中c(Pb2+)=2.0×10-14mol·L-1则Ksp(PbS)=_______ ;写出PbI2(s)与S2-反应生成PbS(s)的离子方程式_______ 。
(4)HI的分解反应曲线和液相法制备HI的反应曲线分别如图所示:
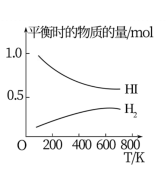
反应H2(g)+I2(g) 2HI(g)的△H
2HI(g)的△H_______ (填“>”或“<")0。
(1)制取甲胺的反应为CH3OH(g)+NH3(g)=CH3NH2(g)+H2O(g),已知该反应中相关化学键的键能数据如下表所示:
| 共价键 | C-O | H-O | N-H | C-N |
| 键能/(kJ·mol-1) | 351 | 463 | 393 | 293 |
则该反应的△H=
(2)工业上利用水煤气合成甲醇的反应为CO(g)+2H2(g)
 CH3OH(g) △H<0。一定温度下,向体积为2L的密闭容器中加入CO和H2,5min末反应达到化学平衡状态,测得各组分浓度如下表所示。
CH3OH(g) △H<0。一定温度下,向体积为2L的密闭容器中加入CO和H2,5min末反应达到化学平衡状态,测得各组分浓度如下表所示。| 物质 | CO | H2 | CH3OH |
| 浓度/(kJ·L-1) | 0.9 | 1.0 | 0.6 |
①0~5min内,用CO表示的平均反应速率为
②既能加快反应速率,又能提高氢气转化率的措施有
③能说明上述反应已达化学平衡状态的是
A.v正(CO)=2v逆(H2) B.混合气体密度保持不变
C.反应容器内压强保持不变 D.混合气体的平均摩尔质量不变
(3)常温下PbS饱和溶液中c(Pb2+)=2.0×10-14mol·L-1则Ksp(PbS)=
(4)HI的分解反应曲线和液相法制备HI的反应曲线分别如图所示:

反应H2(g)+I2(g)
 2HI(g)的△H
2HI(g)的△H
您最近一年使用:0次
解题方法
9 . 沼气的主要成分是CH4,还含有CO2、H2S等。Jo De Vrieze等设计了利用膜电解法脱除沼气中的CO2和H2S,并将阴极处理后气体制成高纯度生物甲烷,其流程如图所示。
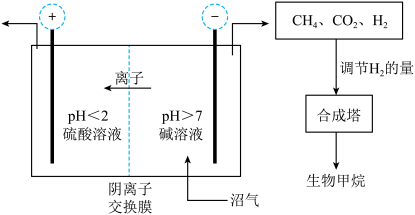
(1)需控制电解槽中阴极室pH>7,其目的是________________________________________ 。
(2)阳极室逸出CO2和__________ (填化学式);H2S在阳极上转化为SO42-而除去,其电极反应式为__________________________________________________ 。
(3)在合成塔中主要发生的反应为:
反应I:CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H1
反应II:CO2(g)+H2(g)=CO(g)+H2O(g) △H2
调节 =4,充入合成塔,当气体总压强为0.1MPa,平衡时各物质的物质的量分数如图1所示;不同压强时,CO2的平衡转化率如图2所示:
=4,充入合成塔,当气体总压强为0.1MPa,平衡时各物质的物质的量分数如图1所示;不同压强时,CO2的平衡转化率如图2所示:

①反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的△H=__________ (用△H1、△H2表示)。
②图1中,200~550℃时,CO2的物质的量分数随温度升高而增大的原因是_____________ 。
③图2中,相同温度下,压强越大,CO2的平衡转化率越大,其原因是_________________ 。

(1)需控制电解槽中阴极室pH>7,其目的是
(2)阳极室逸出CO2和
(3)在合成塔中主要发生的反应为:
反应I:CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H1
反应II:CO2(g)+H2(g)=CO(g)+H2O(g) △H2
调节
 =4,充入合成塔,当气体总压强为0.1MPa,平衡时各物质的物质的量分数如图1所示;不同压强时,CO2的平衡转化率如图2所示:
=4,充入合成塔,当气体总压强为0.1MPa,平衡时各物质的物质的量分数如图1所示;不同压强时,CO2的平衡转化率如图2所示:
①反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的△H=
②图1中,200~550℃时,CO2的物质的量分数随温度升高而增大的原因是
③图2中,相同温度下,压强越大,CO2的平衡转化率越大,其原因是
您最近一年使用:0次
名校
解题方法
10 . 工业上以CO和H2为原料合成甲醇的反应: ,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇,如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是
,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇,如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是
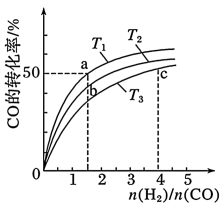
 ,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇,如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是
,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇,如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是
| A.H2转化率:c>a>b |
| B.上述三种温度之间关系为T1>T2>T3 |
C.a点状态下再通入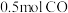 和 和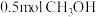 平衡向正方向移动 平衡向正方向移动 |
D.c点状态下再通入 和 和 ,新平衡中 ,新平衡中 的体积分数增大 的体积分数增大 |
您最近一年使用:0次
2021-10-10更新
|
489次组卷
|
6卷引用:江苏省海安高级中学2020届高三第二次月考化学试题



