名校
1 . 下述反应可制备特种陶瓷的原料MgO:MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g) △H>0,该反应在某密闭容器中达到平衡时,下列分析正确的是
MgO(s)+CO2(g)+SO2(g) △H>0,该反应在某密闭容器中达到平衡时,下列分析正确的是
 MgO(s)+CO2(g)+SO2(g) △H>0,该反应在某密闭容器中达到平衡时,下列分析正确的是
MgO(s)+CO2(g)+SO2(g) △H>0,该反应在某密闭容器中达到平衡时,下列分析正确的是| A.恒温时,增大压强平衡逆向移动,平衡常数减小 |
| B.容积不变时,升高温度,混合气体的平均相对分子质量减小 |
| C.恒温恒容时,分离出部分CO2气体可提高MgSO4的转化率 |
D.恒温恒容时,冲入CO气体,达到新平衡时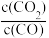 增大 增大 |
您最近一年使用:0次
名校
2 . 利用传感技术可探究压强对
 化学平衡移动的影响。在常温、100kPa条件下,往注射器中充入等物质的量的
化学平衡移动的影响。在常温、100kPa条件下,往注射器中充入等物质的量的 和
和 ,当活塞位置不变时,分别在
,当活塞位置不变时,分别在 、
、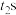 时快速拉伸或压缩注射器,该过程中混合气体压强随时间的变化如图乙所示。下列说法中不正确的是
时快速拉伸或压缩注射器,该过程中混合气体压强随时间的变化如图乙所示。下列说法中不正确的是


 化学平衡移动的影响。在常温、100kPa条件下,往注射器中充入等物质的量的
化学平衡移动的影响。在常温、100kPa条件下,往注射器中充入等物质的量的 和
和 ,当活塞位置不变时,分别在
,当活塞位置不变时,分别在 、
、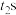 时快速拉伸或压缩注射器,该过程中混合气体压强随时间的变化如图乙所示。下列说法中不正确的是
时快速拉伸或压缩注射器,该过程中混合气体压强随时间的变化如图乙所示。下列说法中不正确的是
| A.E点到F点的变化是压缩注射器所致 |
B.B点到D点 、 、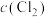 、 、 都减小 都减小 |
C.若容器绝热,则平衡常数 |
| D.C点到D点混合气体颜色由深到浅 |
您最近一年使用:0次
2023-08-20更新
|
291次组卷
|
2卷引用:福建省宁德市部分一级达标中学2022-2023学年高二上学期11月期中考试化学(C卷)试题
名校
解题方法
3 . 硫酸锌是一种重要的工业原料,ZnSO4∙H2O可用于制造印染用的媒染剂,木材及皮革保存剂等。以炼锌厂锌渣为原料,含ZnO、FeO、CuO、CdO等,生产ZnSO4∙H2O的流程如下:
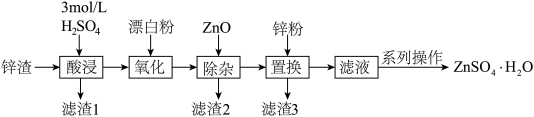
已知:①当溶液中剩余离子浓度小于1×10-5 mol∙L-1时,认为生成沉淀的反应进行完全;
②常温下,Ksp[Fe(OH)3]= 4.0×10-38,Ksp[Fe(OH)2]= 4.9×10-17,Ksp[Cu(OH)2]= 2.2×10-20,Ksp[Zn(OH)2]=1×10-17。
(1)“酸浸”时,需不断通入高温水蒸气,其目的是___________ (填字母)。用18 mol∙L-1的浓硫酸配制3 mol∙L-1H2SO4溶液,下列操作会使所配溶液浓度偏小的是___________ (填字母)。
(2)结合必要的化学反应方程式,从平衡角度解释加入ZnO得到滤渣2的原理:___________ 。除杂过程中,若控制pH=4,溶液中c(Fe3+)=___________ mol∙L-1。结合实际生产情况一般取pH4.5~5.0,pH不宜过大的原因是___________ 。
(3)滤渣3含有Zn和___________ (写化学式)。
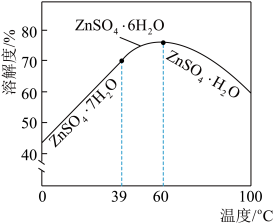
(4)硫酸锌晶体的溶解度与温度的变化如图所示。“系列操作”是:___________ ,洗涤、干燥。

已知:①当溶液中剩余离子浓度小于1×10-5 mol∙L-1时,认为生成沉淀的反应进行完全;
②常温下,Ksp[Fe(OH)3]= 4.0×10-38,Ksp[Fe(OH)2]= 4.9×10-17,Ksp[Cu(OH)2]= 2.2×10-20,Ksp[Zn(OH)2]=1×10-17。
(1)“酸浸”时,需不断通入高温水蒸气,其目的是

(2)结合必要的化学反应方程式,从平衡角度解释加入ZnO得到滤渣2的原理:
(3)滤渣3含有Zn和
(4)硫酸锌晶体的溶解度与温度的变化如图所示。“系列操作”是:

您最近一年使用:0次
2023-01-08更新
|
285次组卷
|
3卷引用:福建省宁德市2022-2023学年高二上学期期末居家检测化学试题
福建省宁德市2022-2023学年高二上学期期末居家检测化学试题山西省名校联考2022-2023学年高二上学期期末考试化学试题(已下线)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(21-24)
名校
4 . I.由γ羟基丁酸(HOCH2CH2CH2COOH )生成γ丁内酯的反应如下: HOCH2CH2CH2COOH
 +H2O,在298 K下,γ羟基丁酸水溶液的初始浓度为0.180 mol/L,测得γ丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
+H2O,在298 K下,γ羟基丁酸水溶液的初始浓度为0.180 mol/L,测得γ丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
(1)该反应在50~80 min内的平均反应速率为_______ mol/(L·min)。
(2)120 min时γ羟基丁酸的转化率为_______ 。
II.某学习小组欲探究外界条件对化学反应速率的影响,设计实验如下表所示:
(3)实验I、II探究的是:其它条件相同时,Na2S2O3溶液的浓度对反应速率的影响,若实验III、IV也想达到与实验I、II相同的探究目的,则X=_______ 。
(4)探究温度对反应速率的影响的实验组是_______ 。实验根据溶液出现淡黄色浑浊所需时间,可判断反应的快慢。该探究实验中发生反应的离子方程式为_____ 。

 +H2O,在298 K下,γ羟基丁酸水溶液的初始浓度为0.180 mol/L,测得γ丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
+H2O,在298 K下,γ羟基丁酸水溶液的初始浓度为0.180 mol/L,测得γ丁内酯的浓度随时间变化的数据如表所示。回答下列问题:| t/min | 21 | 50 | 80 | 100 | 120 | 160 | 220 | ∞ |
| c/(mol·L-1) | 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
(2)120 min时γ羟基丁酸的转化率为
II.某学习小组欲探究外界条件对化学反应速率的影响,设计实验如下表所示:
| 实验序号 | 温度 | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | V/mL | ||
| I | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| II | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| III | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| IV | 35 | 5 | 0.2 | X | 0.2 | Y |
(4)探究温度对反应速率的影响的实验组是
您最近一年使用:0次
名校
5 . 下列装置及设计符合规范的是
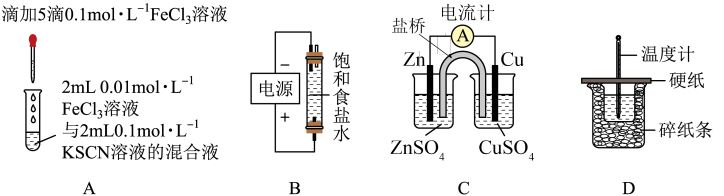

| A.装置A探究浓度对化学平衡的影响 | B.装置B用于制备少量含NaClO的消毒液 |
| C.装置C用于在锌表面镀铜 | D.装置D测定中和反应的反应热 |
您最近一年使用:0次
2022-12-11更新
|
241次组卷
|
4卷引用:福建省泉州第五中学2022-2023学年高二上学期期中考化学试题
6 . 反应3Fe(s)+4H2O(g)⇌Fe3O4(s)+4H2(g),在一容积可变的密闭容器中进行,试回答:
(1)增加Fe的量,其反应速率_______ (填“增大”“不变”或“减小”,下同),平衡_______ 移动(填“不”“向正反应方向”或“向逆反应方向”,下同)。
(2)将容器的体积缩小一半,其正反应速率_______ ,平衡_______ 移动。
(3)保持体积不变,充入N2使体系压强增大,其正反应速率_______ ,平衡_______ 移动。
(4)保持压强不变,充入N2使容器的体积增大,其反应速率_______ ;
(5)在一定温度下,将一定量反应物充入该密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是_______ (填序号)。
a.容器中Fe、H2O、Fe3O4、H2共存
b.H2O、H2的物质的量之比为1:1
c.容器中的压强不随时间变化
d.容器中混合气体的平均相对分子质量保持不变
e.断裂4molH-O键的同时断裂4molH-H键
(1)增加Fe的量,其反应速率
(2)将容器的体积缩小一半,其正反应速率
(3)保持体积不变,充入N2使体系压强增大,其正反应速率
(4)保持压强不变,充入N2使容器的体积增大,其反应速率
(5)在一定温度下,将一定量反应物充入该密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是
a.容器中Fe、H2O、Fe3O4、H2共存
b.H2O、H2的物质的量之比为1:1
c.容器中的压强不随时间变化
d.容器中混合气体的平均相对分子质量保持不变
e.断裂4molH-O键的同时断裂4molH-H键
您最近一年使用:0次
名校
解题方法
7 . 下列事实不能用勒夏特列原理解释的是
A.氯水中存在的平衡:Cl2+H2O H++Cl-+HClO,当加入适当的NaHCO3(s)后,溶液颜色变浅 H++Cl-+HClO,当加入适当的NaHCO3(s)后,溶液颜色变浅 |
B.在K2Cr2O7溶液中存在如下平衡, +H2O +H2O 2 2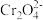 +2H+,若向K2Cr2O7溶液中滴入5~15滴浓硫酸,溶液颜色橙色加深 +2H+,若向K2Cr2O7溶液中滴入5~15滴浓硫酸,溶液颜色橙色加深 |
C.对于反应体系CO(g)+NO2(g)  NO(g)+CO2(g),给平衡体系增大压强可使颜色变深 NO(g)+CO2(g),给平衡体系增大压强可使颜色变深 |
D.对于反应2NO2(g)  N2O4(g) ΔH<0,平衡体系升高温度颜色变深 N2O4(g) ΔH<0,平衡体系升高温度颜色变深 |
您最近一年使用:0次
2022-12-03更新
|
175次组卷
|
3卷引用:福建省泉州市永春第一中学2022-2023学年高二上学期期末考试化学试题
8 . 下列有关实验探究方案设计合理的是
| 选项 | 实验方案 | 实验目的 |
| A | 向等体积等浓度的H2O2溶液中分别加入5滴等浓度的CuSO4和FeCl3溶液,观察气体产生的速度 | 比较Cu2+和Fe3+的催化效果 |
| B | 先将注射器充满NO2气体,然后将活塞往里推,压缩体积,观察注射器内气体颜色变化 | 验证压强对平衡的影响 |
| C | 在锥形瓶内各盛有2g锌粒(颗粒大小基本相同),然后通过分液漏斗分别加入40mL1mol/L和40mL18mol/L的硫酸,比较两者收集10mL氢气所用的时间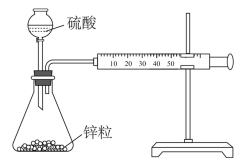 | 探究硫酸浓度对反应速率的影响 |
| D | 在FeCl3+3KSCN Fe(SCN)3+3KCl平衡体系中加入KCl晶体,观察并比较实验现象 Fe(SCN)3+3KCl平衡体系中加入KCl晶体,观察并比较实验现象 | 探究离子浓度对平衡移动的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-11-12更新
|
161次组卷
|
2卷引用:福建省龙岩市一级校联盟(九校)联考2022-2023学年高二上学期半期考化学试题
名校
解题方法
9 . 下列叙述与图对应的是

A.对达到平衡状态的反应:A(g)+3B(g)  2C(g),图①表示在t0时刻充入了一定量的C,平衡逆向移动 2C(g),图①表示在t0时刻充入了一定量的C,平衡逆向移动 |
B.由图②可知,p2>p1、T1>T2满足反应:2A(g)+B(g)  2C(g) ΔH<0 2C(g) ΔH<0 |
C.图③为只改变某一条件,化学反应aA(g)+B(g)  cC(g)的平衡变化图像,则图像中b、c、d三点对应的正反应速率最大的是b点 cC(g)的平衡变化图像,则图像中b、c、d三点对应的正反应速率最大的是b点 |
D.对于反应2X(g)+3Y(g)  2Z(g) ΔH<0,图④ 2Z(g) ΔH<0,图④ 轴可以表示Y的百分含量 轴可以表示Y的百分含量 |
您最近一年使用:0次
2022-11-09更新
|
338次组卷
|
2卷引用:福建省莆田第一中学2022-2023学年高二上学期第一学段考试化学试题
名校
10 . 一定条件下密闭容器中发生的可逆反应: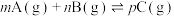 ,符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度)。则下列判断正确的是
,符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度)。则下列判断正确的是
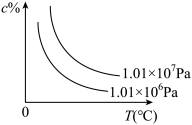
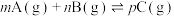 ,符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度)。则下列判断正确的是
,符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度)。则下列判断正确的是
A. | B.m+n>p |
| C.加入催化剂,c%增加 | D.增加A的浓度,A的转化率提高 |
您最近一年使用:0次
2022-10-21更新
|
327次组卷
|
5卷引用:福建省泉州第五中学2022-2023学年高二上学期期中考化学试题



